
DIC是以血小板和凝血因子消耗、大量微血栓形成、继发性广泛出血为特点的一种获得性综合征。新生儿DIC的发病率明显高于成人,大大增加了新生儿的围生期病死率。现主要讨论新生儿DIC的诊断和治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
DIC是以血小板和凝血因子消耗、大量微血栓形成、继发性广泛出血为特点的一种获得性综合征。新生儿DIC的发病率明显高于儿童或成人,大大增加了新生儿的围生期病死率。成人DIC的诊断和治疗已经制定了一系列标准,但不适合于新生儿,尤其是早产儿。本文主要讨论新生儿DIC的诊断和治疗。
新生儿凝血因子(尤其是Vit K依赖性凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ和组织因子)和抗凝因子浓度与活性显著低于儿童和成人,6个月后才能达到成人水平。新生儿出生24 h内血小板反应低下,纤溶系统活性也明显低于年长儿和成人。在无高危因素(如动静脉置管、危重疾病等)的条件下,新生儿促凝系统与抗凝系统保持动态平衡。
(1)新生儿脓毒症时血液呈高凝状态,凝血因子和血小板被大量消耗,微循环血栓形成,严重者可进一步导致多脏器功能衰竭,甚至死亡。(2)缺氧缺血:缺氧缺血使内皮细胞受损,释放组织因子,导致DIC的发生。D-二聚体、纤维蛋白原降解产物(FDP)水平明显升高,同时伴有抗凝因子[抗凝血酶、蛋白C(PC)、蛋白S]的消耗,血小板减少,凝血酶原、部分凝血酶原时间延长。(3)其他导致新生儿DIC的常见原因:低体温、代谢性酸中毒、产科并发症(胎盘早剥、重度子 前期、死胎)、呼吸系统疾病(呼吸窘迫综合征、羊水吸入综合征等)、消化系统疾病(坏死性小肠结肠炎、肝功能异常)、血液系统疾病(蛋白C/S缺陷、红细胞增多症)、代谢性疾病(血色病、半乳糖血症)、血管畸形、恶性肿瘤等。
前期、死胎)、呼吸系统疾病(呼吸窘迫综合征、羊水吸入综合征等)、消化系统疾病(坏死性小肠结肠炎、肝功能异常)、血液系统疾病(蛋白C/S缺陷、红细胞增多症)、代谢性疾病(血色病、半乳糖血症)、血管畸形、恶性肿瘤等。
血小板减少是DIC最常见的征象之一。血小板计数<150×109/L预测血栓形成的敏感性和特异性分别为39%和88%,阳性和阴性预测价值分别为81%和54%[1]。
凝血酶原时间(PT)和国际标准化比值(INR)反映外源性凝血途径(凝血因子Ⅶ、Ⅹ和Ⅱ),危重新生儿由于Vit K的相对缺乏,此2项检查常有明显异常。INR>1.5预测危重新生儿凝血酶和纤溶酶增高的敏感性和特异性分别为11%和95%[1]。活化部分凝血酶原时间(APTT)反映内源性凝血途径(接触途径)和共同途径(Ⅻ、Ⅺ、Ⅸ、Ⅷ、Ⅹ、Ⅴ、Ⅱ和Ⅰ)。APTT与年龄相关,对排除凝血功能异常有重要意义,但易受其他因素(如狼疮抗凝物质)干扰。APTT延长可反映凝血功能障碍和凝血因子的消耗,也可见于血友病患者。如患儿体内存在凝血因子抗体或应用抗凝药物[如肝素、凝血酶抗体、活化蛋白C(aPc)等],APTT也可明显延长。
FIB是一种急时相反应蛋白,其下降并伴血小板减少往往预示DIC发生。FIB<1.5 g/L用于诊断DIC的敏感性和特异性分别为12%和98%[1]。分析FIB需结合其他急时相反应蛋白(如CRP),在感染性疾病也可明显升高。
D-二聚体由纤维蛋白分解产生,是凝血系统和纤溶系统活化的重要标志。在血栓形成、栓塞、组织损伤及出生后短时间内D-二聚体均可显著升高。由于感染、恶性肿瘤、缺氧等可激活凝血系统,在这些条件下D-二聚体也可明显升高。即便如此,D-二聚体仍是一个很有价值的指标,其特异性低,敏感性很高,阴性结果可排除DIC。
有研究显示,通过检测凝血酶原片段-1,-2,或凝血酶的下游产物(如纤维蛋白肽A或可溶性纤维蛋白)来检测凝血酶的产生可早期诊断DIC,但目前临床实验室尚不能常规检测这些项目。标本量的要求进一步限制了很多检测项目在新生儿的应用。Shirahata等[7]于1983年制定了新生儿的DIC评分标准,见表1,此标准所需血量少,检测时间短,受组织因子影响小。随着NICU收治对象的变化,Shirahata等[7]又于1998年制定了极低出生体质量儿DIC的评分标准,见表2。此标准采用血小板、FIB及D-二聚体3个指标,并认为D-二聚体有更高的诊断价值,而FIB意义不大。由于更侧重DIC的早期诊断和治疗,此标准放宽了对患儿出血倾向和酸中毒、低氧血症、低体温、低血压等基础状况的要求。然而,这2个评分标准都是建立在回顾分析基础上的,其可靠性和有效性尚需多中心研究证实,从而限制了该2项评分标准在临床中的广泛应用。
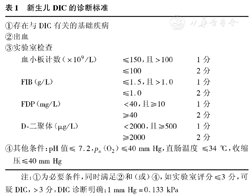
新生儿DIC的诊断标准
新生儿DIC的诊断标准
| ①存在与DIC有关的基础疾病 | |||
| ②出血 | |||
| ③实验室检查 | |||
| 血小板计数(×109/L) | ≤150,且>100 | 1分 | |
| ≤100 | 2分 | ||
| FIB(g/L) | ≤1.5,且>1.0 | 1分 | |
| ≤1.0 | 2分 | ||
| FDP(mg/L) | <40,且≥10 | 1分 | |
| ≥40 | 2分 | ||
| D-二聚体(μg/L) | <2000,且≥500 | 1分 | |
| ≥2000 | 2分 | ||
| ④其他条件:pH值≤ 7.2,pa(O2)≤40 mm Hg,直肠温度≤34 ℃,收缩压≤40 mm Hg | |||
注:①为必要条件,同时满足②和(或)④,如实验室评分≤3分,可疑DIC,>3分,DIC诊断明确;1 mm Hg=0.133 kPa
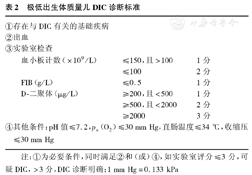
极低出生体质量儿DIC诊断标准
极低出生体质量儿DIC诊断标准
| ①存在与DIC有关的基础疾病 | |||
| ②出血 | |||
| ③实验室检查 | |||
| 血小板计数(×109/L) | ≤150,且>100 | 1分 | |
| ≤100 | 2分 | ||
| FIB(g/L) | ≤0.5 | 1分 | |
| D-二聚体(μg/L) | ≥200,且<500 | 1分 | |
| ≥500,且<2000 | 2分 | ||
| ≥2000 | 3分 | ||
| ④其他条件:pH值≤7.2,pa(O2)≤30 mm Hg,直肠温度≤34 ℃,收缩压≤30 mm Hg | |||
注:①为必要条件,同时满足②和(或)④,如实验室评分≤3分,可疑DIC,>3分,DIC诊断明确;1 mm Hg=0.133 kPa
这对DIC是否能治疗成功至关重要。及早使用抗生素、识别并治疗发生DIC的高危因素经常可逆转疾病的发展。任何导致循环障碍与休克的因素都必须得到及时处理。一旦发生DIC则需要特异性的治疗。
FFP经常被作为维持正常PT/INR值及维持FIB≥1 g/L的经验治疗[8,9]。目前尚无关于新生儿DIC应用FFP的剂量和有效性的随机临床试验研究。有研究认为,DIC治疗成功的关键在于基础疾病的治疗,而是否应用FFP以及任何针对凝血功能的治疗在治愈率与生存率方面无明显差异[10]。虽然目前无证据支持在无出血的情况下或在侵袭性操作中预防性使用FFP,但仍建议在严重的凝血指标异常患儿中无急性出血也要考虑使用FFP[11]。近年来,病毒灭活的高纯度重组血浆衍生蛋白替代治疗在欧洲已被批准应用于临床,可在一定程度上减少FFP的使用。
DIC时是否应用肝素治疗取决于血浆的抗凝血酶水平。多个小样本的临床试验证实肝素(包括普通肝素和低分子质量肝素)对改善凝血试验是有效的,尚缺乏大样本的随机临床研究。有研究认为,在合并新生儿呼吸窘迫综合征的DIC患儿中应用肝素可缩短机械通气时间,缩短DIC病程[12]。然而,由于存在出血的高危因素,肝素在新生儿的应用主要是预防经外周中心静脉置管患儿血栓形成和体内确定有血栓形成患儿的溶栓治疗。
抗凝血酶在脓毒症时大量消耗,是疾病进入危重状态的重要标志。应用外源性抗凝血酶阻断DIC的瀑布效应并抑制炎性反应是近20年来DIC治疗的热点。Japanese Society of Thrombosis and Hemostasis推荐应用抗凝血酶治疗成人DIC[13]。但抗凝血酶与肝素同时应用有相互拮抗作用,增加了出血的风险。新生儿应用抗凝血酶尚缺乏随机临床试验研究。
作为重要的抗凝因子,PC还可以抑制炎性反应及其引起的细胞凋亡。有研究指出,低PC水平是极低出生体质量儿死亡的独立危险因素[4,5]。目前尚未发现在足月儿或早产儿中应用aPC有增加出血的风险[14]。然而,由于目前缺乏随机临床试验资料,aPC应用仅局限于有PC缺乏临床表现的患者,不推荐在新生儿中应用aPC[15]。
目前DIC的治疗主要集中在抗凝和抑制炎性反应方面,但在DIC的晚期却往往表现为大量出血。在严重出血情况下,应用重组Ⅶa因子可有显著的止血作用,但这仅局限于常规治疗失败的危及生命的严重出血状况[16]。






























