
儿童急性髓系白血病(AML)的发生率仅次于儿童急性淋巴细胞白血病,占儿童急性白血病的20%左右。一直以来儿童AML的预后较儿童急性淋巴细胞白血病差,国际儿童白血病协助组纷纷就其诊治和预后进行了持续重点的研究随访,经过对儿童AML治疗方案的研究调整和综合支持治疗的改善,儿童AML的预后有了显著进步。现就近年儿童AML化疗方面的研究和进展进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童急性髓系白血病(acute myeloid leukemia,AML)是一组多异质性带有髓系特点的恶性血液系统疾病,目前先进的治疗水平可使患者获得接近70%的总体生存(OS)率和超过50%的无病生存(DFS)率,但AML治疗相关并发症的发生率和病死率较高,且复发率在30%左右[1]。近年来,儿童AML的治疗通过危险度分层、合理的化疗方案调整、加强综合支持管理及造血干细胞移植和新药应用,儿童AML预后在不断改善。
诱导缓解治疗是AML患儿能否长期DFS的关键,追求最大程度地杀灭白血病细胞,尽快达到完全缓解(complete remission,CR)。目前的诱导缓解化疗方案仍多以经典的柔红霉素(DNR)和阿糖胞苷(Ara-c)组成的DA方案为基础,加上其他的化疗药物。有较大的国际白血病协作组均曾试图通过增加经典化疗药物的剂量、延长化疗时间或缩短诱导缓解化疗间隔时间提高DFS率,但效果并不显著,提示既往经典的化疗方案已经遭遇瓶颈。目前的方案多倾向于联合使用新的有抗白血病作用的化疗药物、制定新的化疗方案及根据危险度分组化疗。以下是国际先进AML协作组诱导缓解治疗方案介绍,见表1。
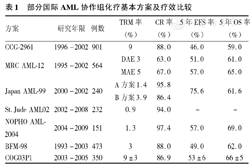
部分国际AML协作组化疗基本方案及疗效比较
部分国际AML协作组化疗基本方案及疗效比较
| 方案 | 研究年限 | 例数 | TRM率(%) | CR率(%) | 5年EFS率v | 5年OS率(%) |
|---|---|---|---|---|---|---|
| CCG-2961 | 1996-2002 | 901 | 9 | 88.0 | 46.0 | 59.0 |
| MRC AML-12 | 1995-2002 | 564 | DAE 3 | 63.0 | 51.0 | 61.0 |
| MAE 5 | 67.0 | 57.0 | 65.0 | |||
| Japan AML-99 | 2000-2002 | 240 | A方案1.4 | 95.8 | 75.6 | 61.6 |
| B方案3.9 | 86.4 | |||||
| St.Jude AML02 | 2002-2008 | 232 | 0.9 | 94.0 | - | - |
| NOPHO AML-2004 | 2004-2009 | 151 | 1.3 | 97.4 | 57.0 | 69.0 |
| BFM-98 | 1993-2003 | 473 | 3 | 88.0 | 49.0 | 62.0 |
| COG03P1 | 2003-2005 | 350 | 9±3 | 86.9 | 53±6 | 66±5 |
美国儿童癌症协作组(CCG)2896方案采用5联诱导化疗方案DCTER[地塞米松(DEX),Ara-c,6-硫鸟嘌呤(6-TG),依托泊苷(VP-16),DNR],给予每日2次×4 d的DCTER诱导化疗,间隔6 d,结果显示:集中定时与标准时间的诱导化疗比较CR率分别为51%和44%,5年DFS率分别为39%和32%,差异均无统计学意义,提示集中定时的诱导化疗并不能提高CR率。随后CCG2961方案[2](1996年8月至2002年)共纳入901例AML患者,中位随访时间为56个月。诱导化疗方案中引入去甲氧柔红霉素(IDA),诱导缓解化疗方案IdaDCTER[IDA 5 mg/(m2·d),第1-9天,继用DNR 20 mg/(m2·d),第10-13天;Ara-c 200 mg/(m2·d),第1-4天;VP-16 100 mg/(m2·d),第1-4天;6-TG 100 mg/(m2·d),口服,第1-13天;DEX 6 mg/(m2·d),口服,第1-3天],CR率为88%,5年DFS率为46%,长期生存(overall survival,OS)率为59%,治疗相关死亡(treatment related mortality,TRM)率为9%,提示引入IDA后CR率和DFS率均较CCG2896有所改善。
英国医学研究理事会(MRC)AML-12方案[3](1995年4月至2002年)共纳入564例AML患者,中位随访时间为9.5年,随机给予2个疗程DAE或MAE方案诱导缓解化疗[Ara-c 100 mg/m2,q12h,第1-10天;VP-16 100 mg/m2,第1-5天;DNR 50 mg/m2,第1、3、5天或米托蒽醌(MIT)12 mg/m2,第1、3、5天],CR率分别为63%和67%,TRM率分别为3%和5%,DFS率分别为55%和63%,复发率(relapse rate,RR)分别为39%和32%。2组缓解情况相当,MAE组的长期预后较好,RR有显著降低。MRC目前正在进行AML-17方案,主要观察研究CD33单克隆抗体(gemtuzumab ozogamicin,GO)的作用,进一步比较DAE、DAE+GO(3 mg/m2)和DAE+GO(6 mg/m2)3个方案的诱导化疗效果,结果尚未见发表。
日本白血病协作组AML-99方案[4](2000年1月至2002年12月)共纳入了240例0~18岁的AML患者,中位随访时间为55个月。根据初诊年龄和WBC进行分组:方案A适用于<2岁或初诊WBC<100×109/L的患者(214例),方案B适用于>2岁或初诊WBC≥100×109/L的患者(26例)。A方案的CR、TRM率分别为95.8%和1.4%;B方案的CR、TRM率分别为86.4%和3.9%。总CR率为94.6%,5年OS和无事件生存(EFS)率分别为75.6%和61.6%,提示基于危险度分组的诱导化疗方案明显改善了疗效和预后。
德国BFM-98方案[5](1993年6月至2003年7月)共纳入473例0~18岁的新诊断AML患者,中位随访时间为3.4年。第一疗程诱导化疗方案为AIE[Ara-c 100 mg/(m2·d),第1-2天,继而100 mg/m2,q12h,第3-8天;IDA 12 mg/(m2·d),第3-5天;VP-16 150 mg/(m2·d),第6-8天]。第二疗程诱导化疗方案为HAM[Ara-c 3 g/m2,q12 h,第1-3天;MIT 10 mg/(m2·d),第4-5天]。与BFM-93方案相比,化疗第15天骨髓中原始细胞比例明显下降。化疗第15天骨髓中原始细胞≥5%和<5%者CR、EFS率分别为76.9%和93.8%,33%和54%,差异有统计学意义。总CR率为88%,TRM率为3%,5年OS率为(62±3)%,5年DFS率为(57±3)%。
美国COG03P1方案[6](2003年12月至2005年11月)共纳入1个月~21岁AML患者350例。第一疗程诱导化疗方案为ADE10+ GO[Ara-c 100 mg/m2,q12 h,第1-10天;DNR 50mg/(m2·d),第1、3、5天;VP-16 100 mg/(m2·d),第1-5天;GO 3 mg/(m2·d),第6天]。第二疗程诱导化疗方案为ADE8[Ara-c 100 mg/m2,q12h,第1-8天;DNR 50 mg/(m2·d),第1,3,5天;VP-16 100 mg/(m2·d),第1-5天]。第一疗程CR率为83.1%,第二疗程CR率为86.9%,TRM率为2.6%,第一疗程诱导缓解后3年EFS、OS和TRM率分别为(53±6)%,(66±5)%和(9±3)%。第二疗程诱导缓解后3年OS、DFS和RR分别为(72±6)%、(60±6)%和(33±6)%,说明联合使用GO可以提高CR率,改善长期预后。
美国St.Jude儿童医院开展了AML02方案[7](2002年10月至2008年7月),共纳入中位年龄9.4岁的AML患者232例。第一疗程诱导化疗方案研究不同剂量Ara-c的作用:DNR 50 mg/(m2·d),第2、4、6天;VP-16 100 mg/(m2·d),第2-6天;大剂量Ara-c 3 g/m2,q12 h,第1、3、5天;小剂量Ara-c 100 mg/m2,q12 h,第1-10天。第22天复查骨髓,如骨髓中白血病细胞>0.01,则立即开始第二疗程诱导化疗DAE+GO(3 mg/m2);如<0.01,则等待骨髓象恢复后开始第二疗程诱导化疗DAE。结果显示不同剂量Ara-c组第22天骨髓MRD无统计学差异;不同剂量组3年EFS率、OS率和RR分别为60.2%比65.7%,68.8%比73.4%和17.5%比21.5%,高剂量组RR低,而长期预后并没有改善。第一疗程诱导缓解化疗后MRD阳性组和阴性组3年RR为38.6%比16.9%。第一疗程CR率为80%,第二疗程CR率为94%,TRM率为1%,提示GO联合标准治疗方案可以提高CR率,且安全性较高。
北欧小儿血液及肿瘤学会(NOPHO)AML-2004方案[8](2004年1月至2009年9月)共纳入151例0~18岁AML患儿。第一疗程诱导缓解化疗方案AIET[Ara-c 200 mg/(m2·d),第1-4天;VP-16 100 mg/(m2·d),第1-4天;6-TG 100 mg/(m2·d),口服,q12 h,第1-4天;IDA 12 mg/(m2·d),第2、4、6天],第15天复查骨髓,如骨髓幼稚细胞<0.05,直至骨髓象恢复后进入第二疗程诱导缓解化疗AM方案[Ara-c 100 mg/(m2·d),第1-5天;MIT 10 mg/(m2·d),第1-3天];如骨髓幼稚细胞>0.05,则立即予以第二疗程化疗。2个疗程后仍未缓解者则予以FLAG方案继续诱导缓解化疗,缓解者即进入巩固治疗阶段。总CR率为97.4%,TRM率为1.3%,3年EFS和OS率分别为57%和69%,是目前报道的CR率最高的方案,显示基于治疗反应的化疗方案可显著提高疗效和预后。
中华医学会儿科学分会血液学组制定了AML-2006诊疗建议[9],中危AML及除外APL的低危AML患者首选DAE诱导缓解方案,次选HAD方案;高危AML患者推荐首先选用IA方案,无条件使用IA方案时则选用DAE方案。重庆医科大学附属儿童医院采纳该方案治疗82例AML患儿,第一疗程CR率为80.5%(66/82例),第二疗程总CR率为87.8%(72/82例),虽然没有治疗相关死亡,但有5例在诱导缓解中放弃继续治疗。与国际先进治疗方案相比,我国AML-2006方案诱导缓解化疗的强度相对较低,一个疗程的DNR剂量为120 mg/m2(国际方案多为150 mg/m2),Ara-c的剂量常为1.4 g/m2(国际方案2 g/m2);除去IDA的应用外不同危险因素分组的治疗尚未能得到充分体现,基于治疗反应和(或)MRD的化疗方案调整也需要进一步研究。
关于AML诱导缓解化疗后评估各个协作组有不同的要求,St.Jude AML02方案评价第22天骨髓,NOPHO AML-2004方案评价第15天骨髓,美国NCCN 2012年诊疗指南推荐第7-10天行骨髓检查评估诱导化疗反应:(1)诱导未缓解,是指骨髓中原始细胞>0.15,行大剂量Ara-c合并蒽环类抗生素再次诱导化疗或按照诱导化疗失败治疗;(2)诱导后骨髓中细胞明显减少但无低增生,按照原诱导方案再次化疗;(3)骨髓低增生;是指骨髓中有核细胞<0.10~0.20,残余原始细胞<0.05~0.10,则等待造血恢复后再评估。诱导化疗失败后的治疗推荐进入临床试验性治疗或行异基因造血干细胞移植(Allo-HSCT),等待供者过程中不能参加临床试验性治疗者则予以大剂量Ara-c和蒽环类抗生素为主的化疗或予以强有力支持治疗。
AML诱导缓解后治疗主要有2种选择,缓解后巩固化疗和造血干细胞移植(HSCT)治疗,以下主要介绍巩固或强化化疗的研究结果和进展。
美国CCG2961方案[2]巩固化疗随机比较氟达拉滨FAMP/AC/IDA [FAMP 10.5 mg/m2初始量,然后30.5 mg/(m2·d),第1-2天;Ara-c 390 mg/m2初始量,然后2400 mg/(m2·d),第3-5天;IDA 12 mg/(m2·d),第0-2天]与DCTER方案,前者Ara-c总剂量达到7590 mg/m2,2种方案的5年OS和DFS率分别为59%比46%和56%比49%,差异无统计学意义,FAMP/AC/IDA方案显著降低了RR(3%比7%),但是TRM率提高了2倍(8%比4%)。巩固化疗后,有条件者进行Allo-HSCT,否则再接受1个疗程大剂量Ara-c(HidAC)(3 g/m2,q12 h×8,第0天,第7天)+左旋门冬酰胺酶(L-Asp)(6000 U/m2,第1天,第8天)强化治疗;之后随机接受IL-2治疗或随访。
英国MRC-12方案[3]巩固化疗有3个疗程,第一疗程均采用MACE方案[安吖啶100 mg/(m2·d),第1-5天,Ara-c 200 mg/(m2·d),第1-5天,VP-16 100 mg/(m2·d),第1-5天]。第一疗程巩固化疗后,随机分组,一组患者接受额外的CLASP方案[Ara-c 3 g/m2,q12 h,第1、2、8、9天;L-ASP 6000 U/(m2·d),第2、9天],随后中高危患儿有同胞相合供者时行Allo-HSCT,而低危和没有供者的中、高危患者接受第三疗程中剂量Ara-c(MidAC)方案[MIT 10 mg/(m2·d),第1-5天,Ara-c 1 g/m2,q12 h,第1-3天]。另一组患者不用CLASP方案,接受Allo-HSCT或第三疗程MidAC方案。2组之间长期预后差异无统计学意义,说明增加以大剂量Ara-c为主CLASP方案(共5个疗程)与没有该方案的4个疗程的化疗相比并不能改善预后。
日本白血病协作组AML-99方案[4]诱导缓解后治疗也是基于危险度分组,根据初诊年龄、WBC、细胞遗传学和初始治疗反应将诱导缓解后患儿分为低、中和高危组,其中低危组患儿只给予巩固化疗;高危组患儿有供者行Allo-HSCT,否则巩固化疗6疗程;中危组有供者时行2疗程巩固化疗后行Allo-HSCT,无供者行巩固化疗5疗程。低、中、高危组5年DFS和OS率分别为71.3%、59.8%、56.5%和86.2%、72.3%、56.5%,差异无统计学意义,说明诱导缓解后危险度分层治疗是有效的。
德国BFM-98方案[5]诱导缓解后治疗包括巩固化疗、强化化疗、HSCT和1年的低剂量维持治疗。巩固化疗比较了AI+haM方案和持续6周的CONS方案。AI方案[Ara-c 500 mg/(m2·d),第1-4天;IDA 7 mg/(m2·d),第3、5天];haM方案:[Ara-c 1 g/m2,q12 h,第1-3天;MIT 10 mg/(m2·d),第4-5天]。6周CONS方案[6-TG 60 mg/(m2·d),口服,第1-43天;泼尼松龙40 mg/(m2·d),口服,第1-28天;VCR 1.5 mg/(m2·d),第1、8、15、22天;IDA 7 mg/(m2·d),第1、8、15、22天;Ara-c 75 mg/(m2·d),第3-6、10-13、17-20、24-27、31-34、38-41天]。2个方案OS、EFS和DFS率差异无统计学意义,差别主要在治疗的周期和毒性反应2个方面。AI+haM组比CONS组的治疗周期短15 d,同时致死性的不良反应发生较少,因此随后的BFM-2004方案放弃了CONS方案。之后1个疗程的强化化疗为HAE方案(Ara-c 3 g/m2,q12 h,第1-3天;VP-16 125 mg/m2,第2-5天]。
美国COG03P1方案[6]缓解后治疗为强化化疗和Allo-HSCT。第一疗程强化化疗方案AE[Ara-c 1 g/m2,q12 h,第1-5天;VP-16 150 mg/(m2·d),第1-5天];第二疗程强化化疗方案MA+GO[MIT 12 mg/(m2·d),第3-6天;Ara-c 1 g/m2,q12 h,第1-4天;GO 3 mg/(m2·d),第7天];第三疗程强化化疗方案HDAC+L-ASP[Ara-c 3 g/m2,q12 h,第1、2、8、9天;L-ASP 6000 U/m2,im,第2、9天]。第一个疗程强化化疗后有条件者行Allo-HSCT,无条件者进入后2个疗程强化化疗。第一疗程强化化疗后移植组和化疗组3年OS率和DFS率分别为(80±10)%比(73±6)%,(75±12)%比(57±7)%,RR为(18±10)%比(36±7)%,提示移植组较化疗组预后好,复发率低,但是没有危险度分组。
St.Jude 02方案[7]诱导缓解后化疗共3个疗程。第一疗程化疗方案因危险因素不同而不同:[Ara-c 500 mg/(m2·d),第1-5天;克拉屈滨9 mg/(m2·d),第1-5天]用于伴t(9;11)和inv(16)患者;[Ara-c 3 g/m2,q12 h,第1-3天;VP-16 125 mg/(m2·d),第2-5天]用于M4/M5不伴t(9;11)或inv(6)者;[Ara-c 3 g/m2,q12 h,第1-3天;MIT10 mg/(m2·d),第3-4天]用于其他患者。第二疗程化疗方案为:[Ara-C 3 g/m2,q12 h,第1、2、8、9天和L-ASP 6000 U/m2,于第4、8次Ara-c滴完后3 h肌注]。第三疗程化疗方案[MIT 10 mg/(m2·d),第1-3天;Ara-c 1 g/m2,q12 h,第1-3天]。低、中危组患者没有供者时行3个疗程巩固化疗;高危组和有供者的中危组患儿行Allo-HSCT。低、中、高危组3年EFS率、OS率分别为(82.1±6.1)%、(62.9±7.0)%、(46.7±6.8)%(P<0.0001),(89.1±4.8)%、(72.5±6.4)%、(54.8±6.8)%(P<0.0001)。高危组患儿移植组和化疗组3年OS率为57.5%比50.5%(P= 0.85),但第一疗程诱导化疗后MRD>1%的高危组患儿,移植组和化疗组3年OS率为(43.5±12.4)%比(23.1±10.1)%(P=0.14),移植优势明显。
综上所述,目前AML诱导后巩固或强化化疗方案多采用了以中大剂量Ara-c为主,共2~6个疗程,而且以2、3个疗程为主,额外的中大剂量Ara-c方案并不能进一步改善EFS和OS[10]。结合我国AML-2006诊疗建议,其诱导后巩固化疗至少6个疗程,其中2疗程HA以及后续额外的第4个疗程中剂量Ara-c的作用值得考虑和研究。目前国际儿童AML的研究还提示基于诱导化疗后骨髓反应和MRD水平的危险因素分组,有利于预后判断和指导治疗选择。目前的研究结果还明确了后续维持治疗和自体造血干细胞移植在儿童AML治疗中没有显著的作用或益处;Allo-HSCT在中高危AML患儿的治疗中有明显的优势。
1998年,日本学者最早提出了预激化疗方案,即粒细胞生长因子与化疗药物提前和同时使用,动员白血病细胞进入细胞周期,从而起到化疗增敏作用的疗法。既往多个随机临床试验证实FLAG化疗方案可以有效改善难治、复发性AML患者预后。欧洲BFM协作组纳入394例难治复发性AML患者,在FLAG方案的基础上加入脂质体DNR,CR率为64%,4年OS率为38%,较之前的方案有显著改善[11]。随着对于肿瘤发生机制认识的不断加深,逐渐发现了多种新药,如单克隆抗体、抑制核酸合成药物、抑制信号通路药物等,目前研究的方向主要为如何合理组合不同药物、筛选合适患者[12]。
目前进入临床的主要为针对FLT3的抑制剂。2006年4月美国食品药品管理局(FDA)批准CEP-701用于治疗AML,CEP-701是一种口服的FLT3抑制剂;其他还有索拉菲尼,一种口服靶向治疗药物。对于成人难治复发性AML患者研究显示:索拉菲尼单药或者合用Ara-c和IDA均可以改善FLT3+难治性AML患者的预后[13,14]。最新发现的选择性FLT3基因突变的靶向治疗药物为AC220,安全有效,需要大样本的随机临床试验证实其临床有效性[15]。
免疫治疗主要有单克隆抗体靶向治疗、过继性细胞免疫治疗以及疫苗治疗等。进入临床的主要有CD33单克隆抗体GO。英国MRC协作组、美国St.Jude儿童医院、COG协作组已经将GO纳入3期临床试验,且取得了较好的疗效。过继性细胞免疫治疗中主要是细胞因子诱导的杀伤细胞(CIK),Schmidt-Wolf等[16]将CIK细胞的治疗首次应用于临床,首次证明了CIK细胞的体内及体外抗癌活性。对于CIK细胞治疗AML仍需要大量的临床研究进一步证实。白血病的疫苗治疗仍处于临床研究阶段,还需要进一步的研究。
1997年,Bonnet和Dick[17]首先发现了LSC,并指出形成白血病的根源是LSC。LSC的靶向治疗主要有针对LSC表面分子、针对LSC特殊分子调控机制、诱导LSC的免疫反应等。研究发现CD47可能成为LSC靶向治疗的有效靶点[18]。还有研究表明,T淋巴细胞免疫球蛋白黏蛋白3(TIM-3)表达于多数LSC表面,而在造血干细胞表面不表达[19]。实验中建立了抗人TIM-3的小鼠IgG2a抗体,能在不损害人体正常造血干细胞重建的情况下消灭LSC。
目前研究较多的中药为冬凌草甲素,是一种从唇形科香茶菜属植物中分离出的贝壳杉烯二萜类天然有机化合物,有较强的抗肿瘤活性。上海血液病研究所已经开始冬凌草甲素靶向治疗伴有t(8;21)(q22;q22)染色体易位AML患者的试验,希望尽早投入临床,造福AML患者。
除外化疗方案及其他治疗手段的改善,临床支持治疗手段的完善也提高了AML患儿的预后,特别是对于感染的预防和治疗。英国MRC协作组一系列AML方案的回顾性分析发现:比较1996至2002年20例和2003至2011年40例AML患儿的治疗,发现TRM率由前者的23.4%下降至2.5%,说明近10年支持治疗的改善在整个治疗方案中发挥了重要作用[20]。



























