小阴茎是46,XY性发育异常儿童常见的临床表现。由于病因复杂,儿童期诊断手段有限,有些患者很难明确病因。下丘脑-垂体-性腺轴及雄激素合成和转化过程中任何一个环节出现异常皆会影响阴茎的发育。通过对近年的阴茎统计数据进行比较,试图找到适合临床应用的参考数据,用于小阴茎的诊断。对于按男性抚养的患儿,改善阴茎外观的治疗包括药物治疗和手术治疗。外源性雄激素和绒毛膜促性腺激素治疗是主要方法,其可有效刺激发育不全的阴茎生长,但合适的治疗时机、剂量、是否有不良反应等并未达成共识。手术治疗可改善尿道下裂所致阴茎外形异常和重建尿道。促性腺激素的治疗可应用于有生育要求的患者。对于社会性别女性的患者,需要切除男性性腺,并在青春期开始后进行雌激素替代治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
性发育异常(disorders of sex development,DSD)[1]是2006年Lawson Wilkins儿科内分泌协会(Lawson Wilkins Pediatric Endocrine Society,LWPES)和欧洲儿科内分泌协会(European Society for Pediatric Endocrinology,ESPE)联合会议对性发育相关疾病的重新命名,将DSD分为性染色异常DSD、46,XX DSD和46,XY DSD。46,XY DSD病因很多,主要分为性腺(睾丸)发育异常和雄激素合成或功能障碍两大类。阴茎短小是大多数46,XY DSD最常见的体征,常伴不同程度的阴茎发育异常。导致阴茎短小的病因复杂,受临床诊断手段限制致其诊断困难。由于部分患者的病因不明,所以缺乏针对小阴茎的规范治疗。现就46,XY DSD儿童小阴茎的诊断和治疗进行综述,并提出诊疗建议。
小阴茎是指在非勃起状态下,阴茎伸展长度低于同年龄或相同青春期分期人群平均值2.5个标准差以下者,部分患者伴隐睾、尿道下裂或者睾丸发育不良等临床表现。正确的测量方法为诊断小阴茎的基础。儿童阴茎标准的测量方法是被检查者平卧于检查台,将阴茎无张力牵拉使其充分自然伸展,测量从耻骨联合阴茎根部至顶端的距离即为阴茎长度(不包括包皮长度)。测量肥胖或隐匿性阴茎、埋藏阴茎患儿时须尽量推开耻骨联合前脂肪垫及周围组织,以使其测量准确。
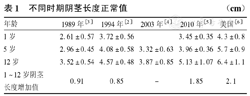
诊断小阴茎需要正常阴茎长度的参考值。不同种族、地区、时期儿童阴茎长度的正常值不同。国内目前尚无统一的正常值标准,常用的是1994年陈冠瑞[2]的数据,其1、5、12岁的数据分别为(3.72±0.56) cm、(4.08±0.58) cm和(4.57±0.48) cm。国内不同年代不同地区均有新生儿到成人各年龄段正常男性阴茎的测定数值报道,见表1[3,4,5]。分析不同时期的数据,阴茎长度呈逐渐增加的趋势。1989年王桂茹等[3]报道1岁时阴茎长度是(2.61±0.57) cm,2010年付超和李旭良[5]报道为(3.45±0.35) cm。同样是处于青春前期,1989年数据显示5岁时阴茎长度为(2.96±0.45) cm,2003年刘小青等[4]的数据为(3.32±0.63) cm,2010年付超和李旭良[5]的数据为(3.96±0.36) cm。12岁时为男童开始青春期发育的年龄,阴茎长度1989年、2003年和2010年的数据分别为(3.52±0.54) cm,(3.87±0.85) cm,(5.13±1.07) cm。从数据变化趋势上看1989年、2003年和2010年的数据呈现很好的连续性变化,而陈冠瑞[2]的1994年1岁和5岁时阴茎长度明显高于1989年、2003年和2010年的数据,12岁时的数据低于2010年的阴茎长度,同时其阴茎在青春前期的增加值是最小的。1994年的数据每年龄段的例数为25~45例,2010年的数据年龄的人数超过100例,且入组样本包括了南方和北方人群。所以,1994年的数据值合理性受到挑战。Behrman等[6]报道各个年龄段的阴茎长度已经明显高于2003年和2010年中国文献报告的数据,见表1,故作者认为国外阴茎数据正常值不适合中国人小阴茎的诊断。综上所述,作者推荐使用2010年的阴茎长度数据作为小阴茎诊断参考值。
阴茎的发育主要依赖于由睾丸间质细胞分泌的睾酮,在5α-还原酶作用下转化为双氢睾酮(DHT),再作用于雄激素受体并使阴茎增长。妊娠前15周胎盘分泌的绒毛膜促性腺激素(HCG)刺激睾丸间质细胞分化并分泌睾酮。15周后胎儿下丘脑、垂体发育成熟,由下丘脑产生的促性腺激素释放激素(GnRH)刺激腺垂体分泌促性腺激素,包括促黄体生成素(LH)和促卵泡刺激素(FSH),与HCG共同作用,刺激睾丸间质细胞分泌睾酮,并转化为DHT后与靶细胞的受体结合,刺激阴茎发育成熟。因此,下丘脑-垂体-性腺轴(HPG轴)及雄激素合成和转化过程中任何一个环节出现异常,激素受体及其后信号传导系统的异常,均可影响阴茎的发育,形成小阴茎。根据HPG轴功能和作用异常,小阴茎的病因分类如下:(1)低促性腺激素性腺发育不良(HH):病变原发于下丘脑和垂体,包括下丘脑GnRH缺乏和垂体促性腺激素缺乏,主要疾病有Kallmann综合征、特发性或继发性GnRH缺乏、多发性垂体激素缺乏症(MPHD)、单纯性FSH或LH缺乏等;(2)高促性腺激素性腺发育不良:由于性激素低下促性腺激素水平反馈性升高,包括促性腺激素受体缺陷(LH、FSH受体缺陷);病变原发于睾丸的原发性性腺发育不全;雄激素合成或代谢障碍:如雄激素不敏感综合征及5α-还原酶缺乏症;(3)性染色体异常:主要是染色体数目异常,常见的是先天性睾丸发育不全(Klinefelter综合征);(4)先天性肾上腺皮质增生症:主要是睾酮合成减少的先天性肾上腺皮质增生症类型;(5)特发性小阴茎:即无明确病因,但青春期后发育可基本正常者。其致病原因至今仍不明确,目前多数学者认为可能是因下丘脑、垂体及性腺睾丸结构与功能异常,以及编码5α-还原酶或雄激素受体的基因突变所致。由于儿童期HPG轴处于相对静止期,GnRH、LH和FSH水平处于相对低水平,影响HH和高促性激素激素性腺发育不良的正确鉴别诊断。对于先天性肾上腺皮质功能不全、Kallmann综合征[7]、Klinefelter综合征和MPHD等,由于其有特征性的临床表现及相关的致病基因,可以临床确诊后进行针对性治疗。但是有相当部分的患者,因目前临床诊断手段不足,病因诊断分型非常困难,临床予以对因治疗方案和时机一直存在争议。
近年来,及早明确病因诊断受到重视,故小青春期这个特定的窗口期内特定的性激素水平检测帮助病因的诊断成为研究热点[8]。但是鉴于小青春期的个体差异性较强,捕捉到其有指导意义的性激素水平变化时机的概率较小,故有待进一步探讨和研究。
一项研究显示:62.7%的小阴茎患者在儿童时期就感到焦虑,余37.3%的患者在青春期才开始焦虑[9],故认为早期治疗使小阴茎在青春期前或青春期得到纠正,可减少成长过程中及成年后的性心理障碍。临床治疗方法包括药物治疗、手术治疗及心理治疗等。药物治疗是男童小阴茎的主要治疗方法。如果明确病因,可根据病因给予适当的激素替代治疗。儿童小阴茎患者的心理治疗是有必要的,但是目前缺乏对于小阴茎患者心理问题的评估和治疗的文献报道。现主要对药物治疗部分进行综述。
主要药物包括庚酸睾酮(TE)、十一酸睾酮和DHT等,给药方式包括针剂、口服制剂、外用软膏和贴剂等。无论是HH还是高促性腺激素性腺功能低下症患儿均可以应用雄激素治疗。自1973年Guthrie等[9]首次报道睾酮治疗婴儿及儿童先天性小阴茎效果良好后,至今30多年众多文献陆续报道睾酮治疗能有效改善阴茎外观[10,11,12,13]。部分型雄激素不敏感综合征(partial androgen insensitivity syndrome,PAIS)的小阴茎患者使用高剂量睾酮能有效增大阴茎[14,15];5α-还原酶2缺乏症(5α-R2-D)的小阴茎患者,使用DHT软膏0.2~0.3 mg/(kg·d),3~4个月有效且血清DHT达到正常范围[16];单纯性小阴茎男童,间断肌肉注射TE 25 mg治疗有效[17],与5-α还原酶2型(SRD5A2)和雄激素受体(androgen receptor,AR)基因突变的存在与否无关;合并严重阴茎下弯尿道下裂的患儿行矫形手术后使用睾酮或DHT治疗,使阴茎长度和周径得到充分增长并显著改善阴茎皮肤的血循环和质地的柔软性,为其后成功的尿道成形术打下了良好的基础[18]。但是,睾酮治疗目前合适的时机存有争议。
有学者认为给药越早疗效越好,青春期后对药物应答差[9]。婴儿期由于胎儿GnRH脉冲发动的继续,出生6个月内FSH、LH、睾酮分泌增高,以后下降[19]。婴儿期阴茎上的AR处于高水平,数目较多,对雄激素作用较为敏感,此时外源性补充雄激素符合生理激素水平规律且效果好。进入青春期,随着正常的性成熟阴茎体的SRD5A2和AR蛋白逐渐减少,这些是保证雄激素活性的必要条件[20],延迟治疗导致错过雄激素活性的峰值期。因此,主张早期用药物治疗。武学焱和李乃适[21]认为,对儿童阴茎短小的治疗,应从发现时起就及时开始小剂量的雄激素治疗,以使患儿阴茎达到同年龄儿童的大小。也有学者认为在婴幼儿期、青春前期及青春期给药均可获满意疗效[22]。陈佳佳等[23]报道婴幼儿和儿童期治疗的小阴茎患者,应用小剂量十一酸睾酮胶丸口服治疗有效。
Husmann和Cain[24]报道使用HH小阴茎的SD大鼠分别予以DHT 1.5 mg/100 g每周1次和睾酮4 mg/100 g每周1次口服治疗进行比较试验,前组在7、28、56及84 d开始用药的大鼠,最终(98 d)均为永久性小阴茎,而后组在56、84 d开始用药的大鼠阴茎长度和重量均完全正常化。前组中血浆DHT的水平高于正常生理水平的2.4倍,而后者高于1.5倍,因此,超剂量的DHT可能加速AR受体提前下调,导致阴茎停止生长。相反,接近生理水平的DHT让AR在阴茎生长得到持续的充分的空间[25]。故治疗中疗程和剂量的选择对小阴茎的治疗是至关重要的。
HH所致小阴茎患儿小青春期内可予补充促性腺激素治疗,如LH、FSH、HCG和人绝经期促性腺激素(HMG)等,其治疗有效[26]。治疗剂量需根据患者血清FSH与LH水平进行调整,使其保持在3个月龄时的血清FSH与LH正常值。
HCG在结构和功能上和LH相似,其是胎盘滋养层细胞分泌的一种促性腺激素,是胚胎期刺激睾丸发育的生理活性物质。HCG作用于睾丸间质细胞(LC)的LH/HCG受体,刺激其发育增大并分泌睾酮促进发育不良的阴茎生长。临床常用其治疗HH所致的小阴茎、小睾丸,可诱发青春期第二性征发育,有较好的疗效。目前治疗方案不统一,通常HCG每疗程总量为10 000 U,一个疗程疗效不佳者3个月后再重复1个疗程[27]。HCG治疗有以下优点:(1)其半衰期为12~36 h,不会在体内长期存留,睾丸正常者使用后血清睾酮明显上升,阴茎大小的变化及激素水平的变化在短期内完成;(2)儿童的HPG轴的发育尚未完善,呈不反应状态,很难通过测定促性腺激素或性腺激素来评估儿童的某些内分泌功能(如下丘脑和垂体功能),故临床病因诊断困难。而HCG可进行诊断性治疗,初步判断病因。使用后患儿血清睾酮升高,且阴茎长大,提示睾丸功能正常,多为HH,此类患儿用促性腺激素治疗效果较佳,阴茎可达同龄人的大小[27]。HCG治疗也有一定的局限性:其对于原发性睾丸功能不全或无睾丸者完全无效;HCG治疗效果好的患儿,HCG治疗后血清睾酮水平短期内明显升高,有可能因此导致儿童提前发育、睾丸萎缩及骨骺提前闭合等雄激素的不良反应。
陈海涛等[28]研究显示HCG治疗可通过HH小阴茎患儿阴茎组织睾酮、DHT水平升高,促进阴茎的生长。睾酮及DHT与阴茎体上的AR结合后使之活化,靶细胞核中的AR以二聚体的形式与特定DNA序列结合,并与其他转录因子相互作用,产生蛋白激酶、生长因子等促进上皮细胞生长,从而促进阴茎生长发育。
邓常开和李旭良[29]研究显示HCG和外用睾酮霜用药后阴茎均有显著增长,2组用药后增加值比较无统计学差异。HCG组用药后睾丸体积有显著增长,睾酮水平升高,而应用睾酮组用药后睾丸体积增长无统计学差异。该研究进一步证实,单独使用睾酮仅能够促进阴茎的生长,但是不能改善睾丸功能。
对于有生育要求的HH患者目前常用的促性腺激素治疗方案主要有HCG/HMG或HCG/FSH方案[30]。HMG是从绝经期妇女尿液中提取的,不仅包含了FSH,还有一定量的LH。通常先用HCG(2000~5000 IU,2~3次/周)6~12个月,诱导第二性征的发育,待睾丸增长到一定的容积并使睾丸局部睾酮浓度达到一定水平时,加用HMG(75~150 IU,2、3次/周),2种药物联合肌肉注射直至满足患者的生育要求。HCG/FSH联合治疗,HCG(2000~5000 IU,2、3次/周)一段时间后联用FSH(75~150 IU,2、3次/周)。国内、外学者近些年来都曾对该方案的安全性及有效性进行了临床观察,几乎所有的患者均可实现男性性征的发育,80%~95%的患者均可实现精子的生成。11例Kallmann综合征患者同时给予促性腺激素和性激素联合替代治疗,随访12~23个月,平均15个月,所有患者阴茎长度、睾丸体积、性激素水平均较治疗前明显改善,第二性征均有不同程度的发育和改善,但生精功能均无恢复,分析原因可能与患者均在18岁以后开始治疗有关[31]。
单次应用GnRHa效果不佳。理想的用药方式是模拟人体的脉冲分泌。GnRHa微量泵模拟下丘脑脉冲分泌模式输注GnRHa,促进垂体促性腺激素的分泌,作用于睾丸促进雄激素的分泌和生精功能。微量泵以每90 min一次脉冲皮下输注,每次5~20 μg。此治疗方法使正常睾丸组织产生雄激素和促进精子生成,2项功能都得以恢复,长期规则治疗疗效肯定。Delemarre-van de Waal[32]用GnRHa微量泵治疗68例HH患者,促性腺激素和性激素水平升高,患者睾丸、阴茎皆增大,58例出现生精功能。当出现生精功能后,联合HCG治疗,取得较好的疗效,其中10例已生育。
手术治疗方法主要为阴茎延长术,青春期后阴茎较短者可使用,但不主张应用于婴幼儿。合并隐睾的患儿需行睾丸下降固定术。对于小阴茎或合并尿道下裂的患者,需要进行阴茎阴囊畸形的矫正和尿道的重建。尿道下裂的治疗历经100多年的发展,手术方法和技术日臻完善。片面追求一期修复可能会面临较高的并发症风险,造成再次修复的难度进一步加大,甚至遗留阴茎外观及功能上的严重障碍。分期修复的概念又重新被提出并受到关注。罗意革等[33]提出选择一期修复还是分期修复,应当根据患者的尿道下裂的轻重和复杂程度来决定,严格评估病情及用于修复尿道的带蒂皮瓣的长度及血运状况,修复条件不良的病例则应首选分期修复。对于选择社会性别为女性的患者,应在性别决定后切除睾丸组织,避免癌变。CAIS患者睾丸肿瘤发病率尚无确切数据,最近研究显示为14%[34],青春期前发生率低,至青春期后随年龄增长可高达30%以上[35]。46,XY DSD患者的外生殖器如呈女性表型,若选择女性社会性别多无需外阴整形。但患者的阴道往往较短或仅呈浅窝状,在必要时进行阴道扩张非手术疗法或阴道成形手术疗法,重建阴道以满足其正常性生活与心理发育所需[36]。
虽然国内外有大量的46,XY DSD小阴茎治疗的文献报道,但由于儿童期病因复杂,鉴别诊断困难,所以有可能HH和高促性腺激素性发育低下的患者均应用了相同的治疗,导致对药物治疗的效果评价不够客观和准确。综合各文献报道笔者提出对46,XY DSD致小阴茎患者的治疗策略。
首先,由于46,XY DSD患者不仅表现为小阴茎,同时也有性腺发育异常等其他表现,所以,对于合并严重的男性化不全的患者应该首先考虑患者的性别确定。Palmer等[37]提出性别确定应该考虑:(1)患者的心理性别;(2)生殖潜力;(3)手术的可能选择;(4)青春期性激素的替代治疗的需要。
其次,尽早明确病因对46,XY DSD进行鉴别诊断。包括先天性肾上腺皮质增生症、Kallmann综合征、Klinefelter综合征、雄激素不敏感综合征等疾病,由于有典型临床特征性表现,可以应用目前的诊疗手段明确诊断,确定患者病变而确定进一步的治疗。
对于不能明确诊断的患者,建议根据是否进入青春期发育年龄进行治疗。由于青春期前,男童主要是阴茎增大治疗即可以满足患者的治疗需求。建议青春期前的患者单独使用睾酮制剂治疗。达到青春期发育年龄的患者,睾丸和垂体功能正常的HH患者,可以应用GnRH微量泵治疗;垂体功能异常的患者可使用HCG或LH、FSH制剂治疗。该治疗可以改善患者HPG轴的功能,促进睾丸生精功能而使达到生育的目的。对于高促性腺激素性腺发育不良患者应用GnRH、HCG、LH、FSH治疗无效,仅能够应用睾酮制剂治疗。对于雄激素不敏感综合征患者需要加大睾酮剂量以获得疗效。5α-R2-D需要应用DHT或大剂量的睾酮治疗。对于生育年龄且睾丸功能正常的患者在生育期通过GnRHa和促性腺激素的联合治疗,可能获得生育能力。对于选择社会性别为女性的患者,在青春期开始后应当给予雌激素替代治疗,维持女性第二性征[38]。
综上所述,儿童小阴茎就诊者并不少见,病因复杂,部分病例诊断困难,但患者同样有治疗要求。目前临床治疗以药物治疗为主,其中外源性雄激素和HCG为主要方法,其可有效刺激发育不全的阴茎生长。目前文献资料可能由于治疗前病因不明导致治疗方案缺乏针对性,影响对治疗效果的长期评价。如何选择最合适的治疗时机、最适当的药物类型和剂量、最佳的治疗疗程,目前仍存在争议,可予以个体化治疗方案以获得最佳效果。