
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
华法林是预防和治疗血栓栓塞性疾病的一线口服抗凝药物,但自华法林被应用于临床之日起,其狭窄的治疗范围、巨大的抗凝效果个体差异及抗凝不当所致的不良反应就一直困扰着每一位处方华法林的医师。虽然临床上可通过测定凝血酶原时间(prothrombin time,PT)及国际标准化比值(international normalized ratio,INR)来监测华法林抗凝效果、调整给药剂量,但有研究结果表明,在抗凝治疗的前4天检测INR值预测维持剂量只有69%的成功率,即使INR达到治疗范围,也不一定表示达到真正的抗凝目的[1];且少数患者由于凝血因子Ⅸ的突变,尽管PT无明显延长,却仍可引起出血[2];因此,仅依靠测定PT和INR值来决定华法林剂量仍有一定的滞后性和局限性。此外,频繁抽血监测PT和INR值,不仅给患者带来了痛苦、不便和经济负担,也增大了出血的风险。因此,一直以来很多研究人员都在为如何更准确地预测华法林的个体化给药剂量做各种尝试,但直到近年来学者在分子生物学领域突破性地明确了肝脏细胞色素P450 2C9(CYP2C9)、维生素K还氧化物还原酶复合体1(VKORC1)等基因的多态性与华法林个体剂量和抗凝效果有关之后,建立"量体裁衣"式的华法林个体化给药模型才逐渐成为可能。
临床使用的华法林制剂是S-华法林和R-华法林的消旋体混合物,其中S-华法林为优势对映体,其抗凝活性是R-华法林的3~5倍,在体内主要由CYP2C9进行代谢。CYP2C9的酶基因有两个重要的单核苷酸多态性(single nucleotide polymorphism,SNP)——CYP2C9*2和CYP2C9*3。研究表明,具有这两种突变的个体代谢华法林的能力明显下降,表现为对华法林更加敏感,所需华法林剂量明显降低,出血不良反应的风险也随之增加[1,3]。
CYP2C9等位基因分布具有明显的种族差异,与高加索人和黑人相比,亚洲人CYP2C9基因变异发生率明显偏低。中国不同民族人群的CYP2C9基因分布也不完全相同,据报道中国大陆汉族人[4]、新疆维吾尔自治区汉族[5]与回族人[6]的CYP2C9基因频率类似,而中国维吾尔族人[5]、藏族人[7]及蒙古族人[8]的CYP2C9基因与汉族人存在明显差异。
中国人的CYP2C9基因变异频率远低于白人和黑人,但所需华法林平均维持剂量却明显较低。要达到同一目标INR水平(2~3),白人的平均稳定剂量约为4.5 mg/d,黑人约为5.7 mg/d,而亚洲人仅为3.0 mg/d[9]。因此,CYP2C9基因多态性并不能单独解释不同种族间华法林剂量的差异。近年来国内外已有多项研究结果显示,VKORC1的基因多态性与华法林个体剂量差异有密切关系。Bodin等[10]报告华法林维持剂量与VKORC1-1639G/A基因多态性相关,携带1639GG基因型的患者所需的日平均华法林剂量较1639AA型患者增加61%[11]。总体看来,VKORC1基因较CYP2C9基因对华法林剂量的影响程度更大。VKORC1-1639 A等位基因频率在中国人群中的分布超过90%,而在高加索人的分布仅为38.79%[9],这可能是导致中国人华法林平均维持剂量低于白种人的主要原因。
CYP4F2是维生素K氧化酶,可使体内还原型维生素K氧化成氧化型维生素K。CYP4F2*3(rs2108622C>T)突变导致该酶活性降低,还原型维生素K的浓度升高,因此,CYP4F2突变型患者所需华法林剂量高于野生型[12]。Meta分析的结果显示,CYP4F2*3杂合突变(CT基因型)和纯合突变(TT基因型)的患者比野生型(CC基因型)患者的华法林剂量分别高出10%和21%[13]。对中国汉族人群的研究结果同样表明,CYP4F2 CT或TT基因型患者华法林维持剂量明显高于CC基因型患者[(3.36±0.14)mg/d比(2.77±0.14)mg/d,P=0.004][14]。总体来说,CYP4F2*3可以解释1%~10%的华法林剂量个体差异[15]。
Rieder等[16]对欧洲人进行研究发现,GGCX rs11676382能解释2%的华法林剂量变异。Cavallari等[17]发现非洲裔美国人中GGCX rs10654848(CAA)16/17重复的发生率是高加索人的10倍(2.6%比0.27%),该基因型的非洲裔美国人的华法林需要量明显升高,能解释非洲裔美国人2%的华法林剂量变异。Kimura等[18]在日本人群中发现,携带GGCX-8016G>A变异的患者华法林稳定剂量明显降低,该SNP可解释4.6%的剂量差异。Huang等[19]对中国人的研究表明,GGCX-3261G>A能解释中国人2.3%的华法林剂量变异。
CALU基因是否对华法林剂量产生影响目前还存在争议。Scott等[20]研究认为CALU对非洲裔美国人无影响,但有的研究结果却证明,CALU rs339097基因对黑人的华法林剂量有影响[21]。Lee等[22]对中国汉族人13个基因的SNP进行筛选,未发现CALU基因对华法林剂量产生影响;而刘寅强等[23]的研究结果却显示CALU rs339097基因多态性与华法林稳态剂量相关。
apoE基因多态性对华法林剂量的影响在不同种族间有不同的报道结果。Kohnke等[24]对高加索人群的研究结果显示,apoE*E4突变后华法林稳定剂量明显增加,可解释约6%的剂量个体差异;而apoE ε2变异对埃及人华法林维持剂量有影响,但影响程度比对欧洲人小,与亚洲人和非洲人比较接近[25]。对于中国人群,Huang等[26]的研究结果是阴性的,即apoE基因多态性对华法林维持剂量无影响。
有研究结果表明,EPHX1基因多态性对意大利人[27]和亚洲人[28]华法林维持剂量无影响,但有学者对300例高龄高加索人进行研究后却发现,EPHX1基因多态性对华法林维持剂量有明显影响,与VKORC1、CYP2C9、CYP4F2基因一起能解释26.6%的华法林剂量变异[29]。Gu等[30]对中国西南地区汉族患者的研究也发现,EPHX1 691A>G(rs4653436)基因变异导致华法林剂量明显降低,该SNP可解释3.7%的个体剂量差异。
除上述基因外,还有些文献报道显示,华法林剂量可能与POR、ORM1/ORM2、ABCB1等影响华法林代谢、结合或转运的其他基因的变异相关,但这些基因的遗传多态性对华法林剂量影响较小,或在不同研究中存在不一致的结论,仍需进一步探讨。
早在1999年之前,欧美的一些研究机构就因为华法林维持剂量的个体化差异过大而尝试通过不同途径来达到华法林的个体化给药[31,32],其中比较有代表性的是多元线性回归法和计算机编程法,两者的本质都是以若干个自变量(如年龄、体重等)来决定一个因变量(即华法林的个体化给药剂量)。实际的临床应用结果证明,仅由非遗传因素(身高、体重、年龄、吸烟、喝酒、合并用药、合并疾病等)构建的华法林剂量预测模型根本达不到设想的那样将用药剂量精确个体化,所能做到的仅仅是减少临床调整华法林剂量的次数而已。但随着CYP2C9和VKORC1的基因多态性对华法林剂量的影响机制日渐明朗,越来越多的研究已将遗传因素作为最重要的变量加入模型,得到的华法林预测剂量准确性大大提高。
2009年,国际华法林遗传药理学协会整合了4个洲、9个国家、21个研究机构、5 700例样本的资料后,回顾性地比较了药物遗传学模式(包含CYP2C9和VKORC1)、临床模式及固定剂量三种给药模式之间的差别,得出药物遗传学模式预测的华法林剂量较临床模式及固定剂量模式更为准确的结果[33],并提供了一个迄今为止样本量最大的模型,这是一项具有里程碑意义的研究。此外,Gage等[34]在1 015例多种族患者数据的基础上构建了一个华法林剂量预测模型,其中纳入的非遗传因素非常全面,并据此建立了一个免费的华法林剂量估算网站(www.warfarindosing.com),初次使用华法林的患者只需输入所需的相关数据,就能得到一个预测剂量(可解释53%的个体剂量差异),而当该患者以该剂量服用3到4次后再次回到该网站继续输入测定的INR值,则预测剂量将更加精确。Horne等[35]针对服用华法林1周后已获得INR值结果的患者(来自3个洲13个临床中心的2 022例患者),建立了一个基于遗传因素、临床因素和INR值的华法林剂量校正模型,经过验证,结果提示相关性为69.1%,平均绝对误差为4.7 mg/周,证明该模型准确性值得信任。
我国也有不少学者致力于构建适合中国人的华法林剂量预测模型。Huang等[36]用266例中国患者数据建立了一个华法林个体给药剂量预测公式(r2=0.541),并用121例患者数据进行了前瞻性验证,结果表明包含遗传因素的模型较非遗传因素模型获得稳定剂量的时间更短、达稳定剂量的例数更多,且该模型更有利于携带变异基因的患者提早获得稳定剂量。都丽萍等[4]的研究也显示包括年龄、体重、CYP2C9及VKORC1基因型的多变量模型能解释约55.0%的个体间剂量差异,较非遗传因素模型预测剂量更加准确。
基于大量华法林药物基因组学研究结果,美国食品药品监督管理局于2007年批准更新了华法林的药品说明书,要求在警示信息中标明人的遗传差异可能影响患者对该药的反应,并在2010年再度修订说明书,对携带不同CYP2C9和VKORC1基因型的患者,分别给出了预期的华法林每日维持剂量范围(表1),这是华法林个体化给药的一大进步。
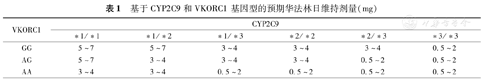
基于CYP2C9和VKORC1基因型的预期华法林日维持剂量(mg)
基于CYP2C9和VKORC1基因型的预期华法林日维持剂量(mg)
| VKORC1 | CYP2C9 | |||||
|---|---|---|---|---|---|---|
| *1/*1 | *1/*2 | *1/*3 | *2/*2 | *2/*3 | *3/*3 | |
| GG | 5~7 | 5~7 | 3~4 | 3~4 | 3~4 | 0.5~2 |
| AG | 5~7 | 3~4 | 3~4 | 3~4 | 0.5~2 | 0.5~2 |
| AA | 3~4 | 3~4 | 0.5~2 | 0.5~2 | 0.5~2 | 0.5~2 |
虽然目前已证实,基因指导的华法林剂量预测模型在预测准确度上明显优于非基因模型,且可降低门诊患者因服用华法林导致出血或栓塞而住院的风险[37],但对于是否能改善患者的抗凝疗效和安全性,以及能否对临床结局产生积极作用还存在争议。为比较基因指导组和临床指导组的抗凝效果及安全性,美国和欧洲近期分别开展了两项前瞻性的多中心随机对照盲法试验,COAG试验纳入了美国18家医院955例患者,主要终点是反映抗凝疗效的TTR%(即INR在目标范围内的时间占比),次要终点包括INR≥4发生率、大出血或血栓等不良事件发生率、INR首次达标时间、华法林达稳定剂量时间等;结果显示基因指导组与临床指导组无论是主要终点还是次要终点均无明显差异,基因指导的华法林初始剂量调整策略不能改善4周的抗凝效果[38]。EU-PACT试验则纳入了英国和瑞典共5家医院427例患者,方法学与COAG试验基本一致,结果却截然相反,基因指导组在主要终点和大部分次要终点方面均优于对照组[39]。这两项相互矛盾的研究结果同时发表在N Engl J Med 2013年第24期上。
此外,基因筛查的便利性和经济性也是临床实际中需要考虑的问题。传统的基因检测所需的出报告时间一般为一至数天,尽管最新的检测技术已能做到最快1 h出结果[40],但尚未普及,且费用昂贵,经济学评价认为没有良好的成本效益比[41]。因此,2012年美国胸科医师协会发表的抗凝抗栓指南中并未推荐常规筛查基因型来指导华法林剂量[42]。
医学发展到今天,已逐渐进入精准医疗的时代,对患者从基因水平进行个体化治疗,是未来医学发展的方向。尽管目前的临床实际工作中,华法林相关基因检测一般仅用于某些抗凝异常(INR过高或过低,怀疑华法林敏感或耐药)患者的验证和解释,还未真正开展基因导向的华法林个体化抗凝治疗,但随着药物基因组学研究的不断深入、基因检测技术的不断改进、检测成本的不断降低,我们有理由相信,根据患者不同的基因类型量身定制最佳的华法林给药方案,或许在不久的将来可能真正实现。


























