
输血相关急性肺损伤(TRALI)是指输血后6 h内发生的急性肺损伤(ALI),是输血导致患者死亡的主要原因之一。目前对TRALI发病机制的假说包括"二次打击"学说与"阈值模型"学说等。超过80% TRALI是由输注的血液制品中含特异性抗人类白细胞抗原(HLA)或人类中性粒细胞抗原(HNA)抗体介导的,并且导致TRALI发生的血液制品,主要来源于有多次妊娠史的女性献血者。目前,多个国家实行以男性献血者为主体,供应高血浆含量血液制品的临床预防、控制TRALI策略,以效降低TRALI发生率。笔者拟就TRALI的定义、发病机制、诊断、预防控制策略进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
输血是一把双刃剑,一方面可拯救患者生命,另一方面可导致输血患者发生严重的输血并发症,如输血传染性疾病、输血反应及其他输血相关疾病等。近20年来,由于经血传播疾病检测技术不断进步,如核酸检测等技术的应用,使经血传播疾病的检出率显著升高。输血导致患者死亡的主要原因为异体输血引起的急性免疫反应及输血相关败血症[1,2]。输血相关急性肺损伤(transfusion related acute lung injury,TRALI)是致命的输血并发症之一。接受心脏外科手术、严重感染和危重等患者需进行输血治疗时,TRALI发病率显著增加[1,2,3]。TRALI目前被认为是输血导致患者死亡的主要原因之一。笔者拟就TRALI的定义、发病机制、诊断、预防控制策略进行综述,旨在为国内因输血导致TRALI的研究提供参考。
TRALI是一种特殊形式的急性肺损伤(acute lung injury,ALI),最早于1950年被报导,其临床表现与其他形式的肺损伤相似,主要表现为呼吸窘迫、严重低氧血症、肺水肿等,也可见发热、心动过速、低血压,甚至高血压等症状,无输血相关循环超负荷(transfusion-associated circulatory overload,TACO)等临床表现[4]。1983年,TRALI最早由Popovsky等[5,6]定义。2004年加拿大多伦多共识会议将TRALI定义为:①急性低氧血症(氧合指数≤40 kPa);②胸部X射线摄影检查显示双侧肺浸润,但无肺血管超负荷迹象;③无左心房高压,左心房压<18 mmHg(1 mmHg=0.133 kPa);④输血后6 h内发生ALI,不伴其他ALI危险因素。若伴其他ALI危险因素,则定义为"可疑TRALI"[7]。2005年,美国国立心肺血液研究所(National Heart Lung and Blood Institute,NHLBI)对TRALI作出了与加拿大多伦多共识会议有一定差异的定义[8]。此二者的区别主要为:NHLBI有关TRALI的诊断标准,需排除输血以外引起TRALI的危险因素,而加拿大共识则接受了"可能"存在输血合并其他引起TRALI的危险因素,并定义为"可疑TRALI"。此外,文献报道,对危重或外伤患者采取输血治疗措施后6~72 h内发生的TRALI,被称为"迟发性TRALI"[9]。
目前,临床对于TRALI发病机制尚未完全阐明,但是已有相关研究发现,TRALI发病与中性粒细胞有关。因为严重TRALI患者肺部均存在中性粒细胞浸润与肺泡水肿现象[9,10]。研究报道,供血者血液成分中含抗人类白细胞抗原(human leucocyte antigen,HLA)-Ⅰ及-Ⅱ抗体,以及抗人类中性粒细胞抗原(human neutrophil antigen,HNA)抗体,可与受血者的中性粒细胞和(或)内皮细胞发生同种免疫反应,进而导致TRALI[6]。研究发现,86% TRALI由HLA或HNA抗体所致,被动输入的抗体与肺内皮细胞的抗原决定簇发生反应,形成抗原-抗体复合物,进而直接或间接激活嗜中性粒细胞,而激活的中性粒细胞被隔离在肺毛细血管内,可释放有毒介质,损坏血管内皮细胞,从而破坏血管完整性,渗漏的液体和炎症细胞可导致肺水肿,而致TRALI的发生[10]。
除抗体外,还有多种因素与TRALI发病相关。输入含特异性白细胞抗体的血液成分后,只有少数受血者发生TRALI,大多数受血者并未发生TRALI[11,12]。有些患者输入不含HLA或HNA抗体的血液成分,也可发生TRALI,这类TRALI称为非免疫性TRALI或非抗体依赖性TRALI[11,12]。血液存储过程中积聚的可溶性因子,即生物反应调节剂(biologic response modifiers,BRM),如生物活性脂质、CD40配体及各种细胞因子等,均可激活中性粒细胞,导致非免疫性TRALI或非抗体依赖性TRALI的发生。
基于上述研究结果,有学者提出"二次打击"学说[13,14],以解释TRALI发病过程。"第一次打击"为宿主因素,如感染、近期手术(特别是心脏手术)、恶性血液病和大量输血等,导致宿主发生中性粒细胞和(或)肺血管内皮细胞等特异性炎症反应。"第二次打击"为输入含抗体和(或)BRM的血液制品后,激活肺部中性粒细胞,进而发生一系列反应,并释放氧自由基和蛋白酶,导致肺血管内皮细胞受损,增加肺毛细血管通透性,引起肺泡毛细血管渗漏,继而引起肺水肿,发生TRALI。
虽然"二次打击"学说支持导致TRALI的众多临床研究结果,但却无法解释非危重患者所发生的TRALI。因此,有学者提出一个补充机制,称为"阈值模型"学说[15],目的是融合抗体介导的TRALI与TRALI的"二次打击"学说。该模型学说认为,通过联合献血者和受血者某些特异性因素,确定导致TRALI发生的特异性因素的临床阈值,如含白细胞抗体滴度较低的血液制品输入接受外科手术的危重患者,可能发生TRALI,即被称为白细胞抗体滴度低阈值;但相同血液制品输入携带同源抗原的疾病严重程度较轻的受血者后,却无明显输血不良反应,即被称为高阈值。
临床对于TRALI主要根据其临床表现进行诊断,即患者接受输血后6 h内出现呼吸窘迫、严重低氧血症、肺水肿及双侧肺蓬松浸润等症状,但应注意与TACO进行鉴别诊断,因二者具有相似的临床表现。输血后,应密切监测患者外周血细胞计数,若发现白细胞计数减少,则应怀疑发生TRALI。当输血患者疑似发生TRALI时,临床医师应立即与相应血站联系,血站应立即对相关供血者血液进行HLA与HNA抗体检测,同时检测该输血患者HLA与HNA基因分型。HNA与HLA抗体血清学检测方法包括粒细胞免疫荧光试验(granulocyte immuno fluorescence test,GIFT)和粒细胞凝集试验(granulocyte agglutination test,GAT)。采用已知HNA抗原表型的粒细胞作为谱细胞,应用GIFT和GAT试验,可鉴定HNA抗体的特异性,但目前只有少数实验室具备HNA抗体检测技术条件,因此迄今对供血者血液进行HNA抗体检测仍较为困难。
对于非免疫性TRALI,目前通过评估血液制品BRM含量进行诊断。但这种鉴别诊断非免疫性TRALI的方法仅限于科学研究阶段,尚未应用于临床。
1985年,Popovsky等[5]研究结果显示,TRALI发生率为20/10万,然而TRALI发生率与献血人群结构、血液制品种类,以及采供血机构是否实施TRALI预防控制策略等密切相关。英国(1999-2004年)和德国(2006-2007年)于实施TRALI预防控制策略前,输血患者接受新鲜冰冻血浆(fresh frozen plasma,FFP),浓缩血小板(platelet concentrate,PC)及红细胞输注时,导致的TRALI发生率依次降低,见表1。超过80% TRALI是由HLA-Ⅰ及-Ⅱ抗体及HNA抗体所致。英国(1999-2004年)和德国(2006-2007年)临床发现的TRALI病例中,检测发现特异性HLA、HNA抗体及未确定特异性抗体的构成比,见表2。不同抗体导致的TRALI,严重程度不相同,含有HNA-3a抗体及同时含有HLA-Ⅰ及-Ⅱ抗体的患者接受输血治疗后,发生TRALI的死亡风险较高[16]。输注有多次妊娠史的女性献血者血液,导致输血患者产生HLA和HNA抗体的几率较大。Triulzi等[17]对7 841例献血者询问妊娠史和输血史,并进行白细胞抗体筛查的研究结果表明,有妊娠史的女性献血者HLA抗体检出率为11.2%~32.2%,显著高于男性和无妊娠史女性献血者HLA抗体检出率(<2%)。Gottschall等[18]对1 171例献血者HNA抗体进行筛查的结果显示,HNA抗体检出率为0.7%(8/1 171)。因此,采供血机构于采供血环节预防TRALI发生的策略应包括,避免采集有多次妊娠史女性献血者的血浆或血浆含量高的血液制品,即使需采集,也应于采集前进行血液HLA抗体筛查。目前,英国、荷兰、美国等多个国家已经实施血浆含量高的血液制品应主要来源于男性献血者,对采集有妊娠史女性献血者血液时,应筛查血液HLA抗体,以达到预防、控制TRALI的目的。
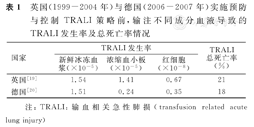
英国(1999-2004年)与德国(2006-2007年)实施预防与控制TRALI策略前,输注不同成分血液导致的TRALI发生率及总死亡率情况

英国(1999-2004年)与德国(2006-2007年),接受调查的TRALI患者中,检测发现HLA、HNA抗体及未确定特异性抗体构成比情况(%)
英国血液预警输血严重危害系统(Serious Hazards of Transfusion,SHOT)制定了一系列措施,以有效降低输注血液制品时导致TRALI的发生风险,具体如下:①2003年底,英国实施FFP主要来源于男性献血者,临床尽量避免使用女性献血者FFP;2010年实现FFP 100%来源于男性献血者。②2003年底,每单位PC悬液由4份全血制备而成,而这4份全血以男性献血者全血为主,女性献血者全血不得超过1份;每单位PC悬液残留血浆不得超过30 mL。③2004年初,每单位浓缩红细胞中血浆含量减少至20 mL左右,并添加红细胞保存液[21]。通过上述措施,英国成功将临床输注FFP和血小板导致的TRALI发生率与输注红细胞导致的TRALI发生率的比值,从2003年的8.9倍降低至2010年的3.6倍[21];TRALI发生例数亦显著降低,见图1[21]。
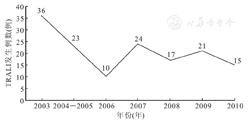

注:TRALI:输血相关性急性肺损伤(transfusion related acute lung injury)
美国联邦法律规定,采供血机构负责调查输血不良反应,其中包括TRALI。美国食品药品监督管理局(Food and Drug Administration,FDA)血液制品顾问委员会(Blood Products Advisory Committee,BPAC)建议,应对多次引起TRALI发生的献血者进行调查,延迟其继续献血时间[22,23,24,25]。美国血库协会(American Association of Blood Banks,AABB)标准规定,对于与TRALI有"牵连"的献血者,应评估其继续献血资格。该标准定义"牵连"是依据TRALI的定义,即受血者输血后6 h内发生TRALI,供血者血液中检测出特异性HLA或HNA抗体,并且与受血者的HLA或HNA抗原分型相对应,或与之发生交叉反应[22,23,24,25]。
2006年,美国红十字会所属的部分血液中心,开始实施主要采集男性献血者血液,作为输注用血浆来源的TRALI预防、控制策略。2007年底,美国红十字会所属血液中心采集的输注用血浆中,95%来源于男性献血者[22]。面对血液供应紧张的难题,美国红十字会则采取以下措施,并取得很好效果[22]。①按照O、A、B及AB血型分组,O、A及B血型输注用血浆应超过99%来源于男性献血者,AB血型输注用血浆约60%来源于男性献血者。②对妊娠史超过4次的女性献血者,首先筛查其HLA-Ⅰ及-Ⅱ抗体,若一旦发现上述抗体呈阳性,则禁止将其血液作为单采血浆与单采血小板等血浆含量高的血液制品来源。上述策略可有效预防、控制输血导致的TRALI。
AABB标准实施后,美国2家大型三级医院因输血导致的TRALI发生率,从2006年的25.7/10万下降至2009年的8.1/10万[23]。2006年,美国红十字会报告32例因输血导致的可疑TRALI病例(当年55%输注用血浆来自男性献血者),而实施上述TRALI预防、控制策略后,2008年仅报告7例因输血导致的可疑TRALI病例(当年95%输注用血浆来自男性献血者)[26]。
目前,我国输血不良反应监测体系尚不完善,仍未建立血液预警系统(hemovigilance)[27],《临床输血技术规范》[28]也未对TRALI的处理措施及预防、控制策略进行相应规定,我国临床医师对TRALI的认识尚有待提高,实验室未广泛开展特异性HLA与HNA抗体检测。由此给TRALI的诊断、追踪调查、献血者屏蔽等预防、控制措施的开展,带来很大困难。我国有关TRALI发生率的系统性调查研究文献迄今仍较少。安群星等[29]对中文期刊报道的24例TRALI患者进行分析发现,TRALI导致的病死率为37.5%(9/24)。陈长城等[30]回顾性分析11例接受心脏手术后发生TRALI患者的研究结果显示,6例患者死亡。在我国,TRALI仍为被严重低估的输血不良反应,应引起临床高度重视。
TRALI为致命的输血相关并发症,由多种因素相互作用所致,最终发展为中性粒细胞活化和ALI。"二次打击"和"阈值模型"学说对TRALI发病机制的解释,获得较多临床研究支持,但仍未完全阐明。输注的血液制品中含有HLA和HNA抗体等白细胞抗体,是导致TRALI发生的重要危险因素,而有妊娠史女性献血者白细胞抗体检出率,并且显著高于其他类型献血者。以男性献血者为主体,供应高血浆含量血液制品,筛查有妊娠史女性献血者的HLA抗体,是目前多个国家预防、控制TRALI发生的有效策略。针对我国TRALI发生风险被低估的现状,笔者认为,首先应尽快完善国家级血液预警系统,制定预防、控制TRALI措施,并建立、健全适合我国国情的TRALI预防、控制策略;其次,临床医师应严格把控输血适应症,减少不必要的输血,提高对TRALI的认识,掌握相关诊疗技能;再次,建议大力开展自体输血,这样既可缓解目前血液供应紧张问题,又可有效减少TRALI发生率。
无



























