
建立定量检测血浆5-氟尿嘧啶(5-FU)的液相色谱串联质谱(LC-MS/MS)方法,评价5-FU药物浓度监测在癌症患者化疗效果评估和毒性预测中的应用。
用LC-MS/MS方法定量检测血浆中5-FU含量。参照美国食品和药物管理局(FDA)的生物分析方法验证导则标准对所建方法进行线性、检出限、精密度、准确性和稳定性等基本性能验证。收集2013年4至12月在复旦大学附属中山医院肿瘤内科接受5-FU化疗的消化道肿瘤患者35例,连续监测血浆5-FU浓度,评价5-FU浓度与化疗效果和毒性作用之间的关系。
血浆5-FU的检测线性范围为49 ~ 9 800 ng/ml;定量限为49.0 ng/ml;批内、批间的变异系数(CV)分别<3%和<6%;低、中、高浓度质控品的提取回收率分别为103.36%、88.12%和91.26%,相应的内标提取回收率分别为109.69%、91.06%和88.81%;低、中、高浓度质控品的添加回收率分别为112.16%、99.12%和92.28%;低、中、高浓度质控品反复冻融2次(-80 ℃)的检测偏差分别为-11.69%、2.42%和-8.09%;低、中、高浓度样本在室温保存6和24 h的检测偏差分别为-6.21%、9.85%、-0.81%和-12.82%、1.38%、-6.06%;低、中、高浓度样本在2~8 ℃保存2和14 d的检测偏差分别为-11.97%、1.42%、-10.91%和0.56%、0.14%、3.82%。35例结直肠癌患者中,通过检测5-FU浓度计算44 h曲线下面积(AUC),浓度分布为3.44~53.43 mg/L·h,和5-FU初始剂量无相关性(R2=0.004,P>0.05)。5-FU 44 h AUC>30 mg/L·h组发生化疗相关不良反应的风险性显著高于44 h AUC < 30 mg/L·h组(χ2=12.600,P<0.01);AUC > 20 mg/L·h组的化疗效果显著优于AUC < 20 mg/L·h组(χ2=5.358,P<0.05)。
建立的LC-MS/MS检测方法基本性能符合评价标准,能够灵敏且准确地检测血浆5-FU浓度,提高临床5-FU相关化疗方案的有效性和安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
1957年,5-氟尿嘧啶(5-FU)在临床成功应用,开启了嘧啶类抗代谢肿瘤药物的新纪元[1,2]。以5-FU为主联合其他抗肿瘤药物,如奥沙利铂、靶向药物等的化疗方案是临床治疗结直肠癌、胃癌等上皮细胞恶性肿瘤的最常用方案。多项研究显示[3,4],5-FU无论是单独使用或是与其他抗肿瘤药物联用,都有着明确的抗肿瘤效果。但是,5-FU在体内生物半衰期短、个体差异大、脂溶性低、药物对组织细胞内浸透性差,且有明显的消化道反应和骨髓抑制作用,这都影响了5-FU的临床疗效和应用[5]。此外,5-FU在体内消除呈非线性,加剧了个体间的疗效差异,明显限制其进一步应用。5-FU浓度测定可以有效地辅助临床调整药物剂量,提高化疗效果并减低不良反应[6,7]。本研究建立了一种能快速定量检测血浆5-FU的液相色谱串联质谱(LC-MS/MS)方法,并对其进行检测性能和临床应用评价。
Waters® Xevo™ TQ MS ACQUITY UPLC® System,色谱柱为BEH HILIC 2.1 mm ×100 mm,孔径1.7 μm(Waters),保持柱温30 ℃。
标准品为纯5-FU(2.45 mg,美国Toronto Research Chemicals公司);内标品为5-FU-d3(2.73 mg,美国IsoSciences公司);甲醇(色谱纯,德国Merck公司);乙腈(色谱纯,德国Merck公司)。
将2.46 mg纯5-FU溶于10 ml甲醇,得到浓度为245 μg/ml的母液,将母液和乙腈按一定比例稀释,分别获得工作浓度为49、245、490、980、1 960、4 900和9 800 ng/ml的标准品,各级标准品中加入10 μl内标品,充分混匀后分装。含内标品的标准品按每管50 μl分装,-80 ℃保存备用,不能反复使用。
将纯度为2.73 mg 5-FU-d3溶于10 ml甲醇,得到浓度为271.1 μg/ml的内标储备液,再将10 μl内标储备液和990 μl乙腈充分混匀得到终浓度2.711 μg/ml的内标品。标准品按每管50 μl分装,-80 ℃保存备用,不能反复使用。
QC1:8.16 μg/ml标准品储备液+10 μl内标+ 981.84 μl配制溶液,得到终浓度:400 ng/ml。QC2:12.25 μg/ml标准品储备液+10 μl内标+ 977.76 μl配制溶液,得到终浓度:600 ng/ml。QC3:61.22 μg/ml标准品储备液+10 μl内标+ 928.78 μl配制溶液,得到终浓度:3 000 ng/ml。
流动相A2为25 mmol乙酸铵水溶液;流动相B1为乙腈,流速:0.3 ml/min进行梯度洗脱。时间<2 min: A2∶B1为5%∶95%;2 min≤时间<4 min :A2∶B1为50%∶50%;时间=4 min:A2∶B1为5%∶95%。
取待测血浆25 μl,内标品5 μl和470 μl乙腈,采用蛋白质沉淀法,震荡器充分混匀30 s,25 000×g离心10 min,吸取上清液进样。标准品、质控品的处理方式与待测样本一致。
取25 μl样品上清液加入质谱分析仪进行检测。5-FU和5-FU-d3的锥孔电压为40 V,碰撞能量为25 V,母离子>子离子分别为129>42和131>43。
参照美国食品和药品管理局(FDA)的生物分析方法验证导则标准对建立的LC-MS/MS方法进行基本分析性能验证。
将浓度为245 μg/ml标准品稀释为49、245、490、980、1 960、4 900和9 800 ng/ml,重复检测2次取均值。各浓度检测偏倚(Dev)<15%,且曲线的回归系数(R2)>0.99可判断为呈线性。
5-FU定量限是指满足变异系数(CV)≤ 20%、有效偏差为±20%以内、信噪比>10∶1的最低浓度。
使用高、中、低3个浓度水平的血浆质控品作为待测样品,分别同时检测15次,评价批内精密度;每次检出前新鲜配制高、中、低浓度水平质控品,连续检测5 d,重复3次,评价批间精密度。精密度评价标准要求,偏差必须落在±15%之内,CV必须≤15%方能达到检测要求。
(1)提取回收率:通过对比空白基质添加分析物或内标提取后的分析物或内标峰面积与空白基质提取后添加分析物或内标的峰面积,计算提取回收率。分别检测高、中、低浓度质控品的提取回收率,每份样本重复检测5次取均值。提取回收率在80%~120%之间判断为可接受。(2)添加回收率:在3份已知浓度的混合血浆中同时加入不同浓度的5-FU标准品作为待测样本,每份样本重复检测5次取均值,并与理论值进行比较计算回收率。回收率在80%~120%之间判断为可接受。
分别检测高、中、低浓度样本在-80 ℃反复冻融2次;室温保存0、6、24 h和2~8 ℃保存0、2、14 d的检测值,每份样本重复测定5次取平均值。稳定性实验评价标准要求,准确度均值偏差必须在理论值的±15%之内,CV必须≤ 15%。
收集2013年4至12月复旦大学附属中山医院接受5-FU化疗的消化道肿瘤患者35例,连续监测血浆5-FU浓度。在每个化疗周期,通过收集病史、影像学检查结果和实验室检查结果对患者的不良反应进行评估和分级,并评价化疗效果和疾病进程。
使用Microsoft Office Excel计算均值( )、标准差(s)、CV、Dev和回收率。曲线回归系数采用Spearman进行相关分析。使用SPSS 17.0软件进行统计分析,年龄、性别、化疗方案、化疗剂量、5-FU血浆浓度和不良反应发生的比较采用χ2检验或Fisher精确概率法,以P< 0.05为差异有统计学意义。
)、标准差(s)、CV、Dev和回收率。曲线回归系数采用Spearman进行相关分析。使用SPSS 17.0软件进行统计分析,年龄、性别、化疗方案、化疗剂量、5-FU血浆浓度和不良反应发生的比较采用χ2检验或Fisher精确概率法,以P< 0.05为差异有统计学意义。
LC-MS/MS检测血浆5-FU的色谱图和定标曲线见图1。5-FU的检测线性范围为49~9 800 ng/ml,见表1。
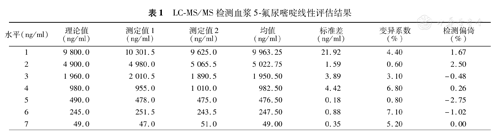
LC-MS/MS检测血浆5-氟尿嘧啶线性评估结果
LC-MS/MS检测血浆5-氟尿嘧啶线性评估结果
| 水平(ng/ml) | 理论值(ng/ml) | 测定值1(ng/ml) | 测定值2(ng/ml) | 均值(ng/ml) | 标准差(ng/ml) | 变异系数(%) | 检测偏倚(%) |
|---|---|---|---|---|---|---|---|
| 1 | 9 800.0 | 10 301.5 | 9 625.0 | 9 963.25 | 21.92 | 4.40 | 1.67 |
| 2 | 4 900.0 | 4 980.0 | 5 065.5 | 5 022.75 | 1.59 | 0.60 | 2.50 |
| 3 | 1 960.0 | 2 010.5 | 1 890.5 | 1 950.50 | 3.89 | 3.10 | -0.48 |
| 4 | 980.0 | 955.0 | 1 010.0 | 982.50 | 4.42 | 6.80 | 0.26 |
| 5 | 490.0 | 478.0 | 475.0 | 476.50 | 0.18 | 0.80 | -2.75 |
| 6 | 245.0 | 251.5 | 243.5 | 247.50 | 0.88 | 7.10 | -1.02 |
| 7 | 49.0 | 47.0 | 51.0 | 49.00 | 0.35 | 5.20 | 0.00 |
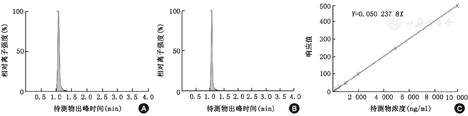

注:A、B图分别为5-氟尿嘧啶、5-氟尿嘧啶-内标的色谱图;C图为LC-MS/MS检测血浆5-氟尿嘧啶的标准曲线
LC-MS/MS检测血浆5-FU的定量限为49.0 ng/ml。
LC-MS/MS检测血浆5-FU的低、中、高浓度批内CV为2.35%、1.66%和2.64%;批间CV为2.2%、5.07%和5.25%。
提取回收率为绝对回收率,用绝对响应(峰高或峰面积)直接计算,与样品检测灵敏度有关,反映了方法的萃取效率。在基质效应不存在的前提下,标准品回收实验的提取回收率最低为78.62%,最高为121.73%;内标回收实验的提取回收率最低为73.47%,最高为117.55%。低、中、高浓度质控品的平均提取回收率分别为103.36%、88.12%和91.26%,相应的内标平均提取回收率分别为109.69%、91.06%和88.81%,准确度均符合要求。
最低为90.81%,最高为108.2%,准确度符合要求。
低、中、高浓度质控品反复冻融2次(-80 ℃)的检测偏差分别为-11.69%、2.42%和-8.09%;在室温保存6 h和24 h的检测偏差分别为-6.21%、9.85%、-0.81%和-12.82%、1.38%、-6.06%;在2~8 ℃保存2 d和14 d的检测偏差分别为-11.97%、1.42%、-10.91%和0.56%、0.14%、3.82%,具体结果见表2。
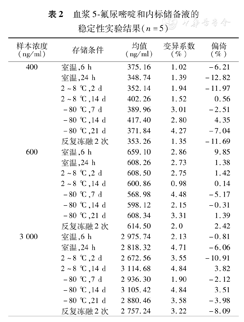
血浆5-氟尿嘧啶和内标储备液的稳定性实验结果(n=5)
血浆5-氟尿嘧啶和内标储备液的稳定性实验结果(n=5)
| 样本浓度(ng/ml) | 存储条件 | 均值(ng/ml) | 变异系数(%) | 偏倚(%) |
|---|---|---|---|---|
| 400 | 室温,6 h | 375.16 | 1.02 | -6.21 |
| 室温,24 h | 348.74 | 1.39 | -12.82 | |
| 2~8 ℃,2 d | 352.14 | 1.94 | -11.97 | |
| 2~8 ℃,14 d | 402.26 | 1.52 | 0.56 | |
| -80 ℃,7 d | 389.96 | 3.01 | -2.51 | |
| -80 ℃,14 d | 417.40 | 2.80 | 4.35 | |
| -80 ℃,21 d | 371.84 | 4.27 | -7.04 | |
| 反复冻融2次 | 353.26 | 1.35 | -11.69 | |
| 600 | 室温,6 h | 659.10 | 2.86 | 9.85 |
| 室温,24 h | 608.26 | 2.73 | 1.38 | |
| 2~8 ℃,2 d | 608.50 | 2.75 | 1.42 | |
| 2~8 ℃,14 d | 600.86 | 0.98 | 0.14 | |
| -80 ℃,7 d | 568.98 | 4.48 | -5.17 | |
| -80 ℃,14 d | 598.12 | 2.15 | -0.31 | |
| -80 ℃,21 d | 608.34 | 3.31 | 1.39 | |
| 反复冻融2次 | 614.50 | 2.0 | 2.42 | |
| 3 000 | 室温,6 h | 2 975.74 | 2.13 | -0.81 |
| 室温,24 h | 2 818.32 | 4.71 | -6.06 | |
| 2~8 ℃,2 d | 2 672.56 | 3.55 | -10.91 | |
| 2~8 ℃,14 d | 3 114.68 | 4.84 | 3.82 | |
| -80 ℃,7 d | 2 936.30 | 1.90 | -2.12 | |
| -80 ℃,14 d | 3 105.42 | 4.84 | 3.51 | |
| -80 ℃,21 d | 2 880.46 | 3.58 | -3.98 | |
| 反复冻融2次 | 2 757.24 | 3.22 | -8.09 |
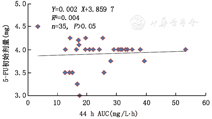
35例结直肠癌患者中,根据输液1 h后5-FU检测浓度,计算44 h连续静脉滴注5-FU的药时曲线下面积(AUC),其分布为3.44 ~ 53.43 mg/L·h,44 h AUC水平和初始5-FU剂量无相关性(R2=0.004,P>0.05),见图2。药物浓度计算公式=(5-FU峰值浓度×44/1 000)mg/L·h。

应用实体瘤的疗效评价标准(RECIST),疗效反应分为4种:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。设定CR、PR和SD患者为治疗有效组,PD患者为治疗无效组,44 h AUC>20 mg/L·h为有效治疗浓度[8]。28例治疗有效患者中,7例患者44 h AUC < 20 mg/L·h,21例患者44 h AUC > 20 mg/L·h;7例治疗无效患者中,5例患者44 h AUC < 20 mg/L·h,2例患者44 h AUC > 20 mg/L·h。44 h AUC > 20 mg/L·h。比较治疗有效组和治疗无效组间的5-FU 44 h AUC水平,结果显示两组间5-FU浓度存在统计学差异,当有效治疗浓度> 20 mg/L·h,临床治疗效果较好(χ 2=5.358,P<0.05)。
设定44 h AUC < 30 mg/L·h为安全治疗浓度,44 h AUC > 30 mg/L·h易发生5-FU相关化疗不良反应 [8]。35例患者中,16例患者发生G1~G4级不良反应(包括呕吐、腹泻和中性粒细胞减少)。其中,3例患者44 h AUC < 30 mg/L·h,13例患者44 h AUC > 30 mg/L·h。19例患者未出现不良反应,其中,15例患者44 h AUC < 30 mg/L·h,4例患者44 h AUC > 30 mg/L·h。比较未发生不良反应组和发生G1~G4级不良反应组间44 h AUC水平,结果显示发生不良反应组的5-FU水平显著高于无不良反应组,当44 h AUC > 30 mg/L·h,发生不良反应的风险性增加(χ 2=12.600,P<0.01)。
5-FU是最常用的消化道恶性肿瘤化疗药物,其体内代谢、消除受多种因素影响。目前临床主要根据体表面积换算5-FU给药剂量,使得相同治疗剂量下部分患者无法达到有效的血药浓度,而部分患者则会发生明显不良反应或毒性蓄积。因此,通过检测5-FU血药浓度评价治疗效果和预测毒副作用具有重要的临床意义。
目前常用色谱法、高效液相色谱(HPLC)法和化学法测定5-FU浓度。色谱法因仪器昂贵、步骤繁琐,增加了检验难度;HPLC虽然测定结果准确,但存在标本流动相配置复杂、检测时间长和检测线性窄等问题;化学法利用抗原抗体反应,易受5-FU前体和代谢产物的干扰,影响检测结果准确性[9]。
本研究建立的LC-MS/MS方法具备以下优点:(1)所需样本量少:HPLC所需样本量为500 μl左右;而LC-MS/MS仅需25 μl,且检测速度快,4 min即可完成检测;(2)线性范围宽,定量检出限低:本方法血浆5-FU的检测线性范围为49~9 800 ng/ml,定量检出限为49.0 ng/ml,其高灵敏度和宽检测线性范围等优势可以满足临床对血浆5-FU浓度监测的要求;(3)检测性能稳定:精密度、稳定性和回收率等参数均符合美国FDA要求。
5-FU稳态血药浓度(或曲线下面积)与不良反应及治疗反应具有相关性[10],临床上通过将5-FU稳态血药浓度维持在合适水平以确保化疗效果,同时尽量减少不良反应的发生率。本研究中35例患者均采用FOLFIRI化疗方案(伊立替康+亚叶酸钙+5-FU),初始剂量为体表面积校准后的标准剂量,随访6个标准化疗疗程。结果显示,44 h AUC可以反映5-FU稳态药物浓度水平,且与校准后的初始剂量无相关性,个体差异大。这主要是由于体内5-FU的代谢、清除与多种因素有关,药代动力学具有非线性和易饱和性的特点,即使按体表面积校准了初始计量,不同个体间稳态浓度间的差异依旧显著,并引起治疗效果和不良反应发生的差别。
FOLFIRI化疗方案引起的不良反应主要是胃肠道反应和骨髓抑制。按常规体表面积换算5-FU给药剂量,部分患者不能达到有效的血药浓度,而部分患者则可能发生不良反应或蓄积中毒[8]。我们发现在35例随访病例中,骨髓抑制和腹泻等5-FU相关不良反应发生率和5-FU稳态血药浓度呈明显正相关。
在接受FOLFIRI化疗方案的患者中,治疗效果和5-FU稳态血药浓度水平存在相关性。本研究成果和文献报道相似[11,12],通过检测5-FU稳态浓度有助于临床评估和预测患者疗效。
综上所述,本研究建立了可靠的检测血浆5-FU的LC-MS/MS方法,采用同位素内标法定量,操作简便,分析时间短,样本用量少,灵敏度和特异性较高,适用于临床监测化疗患者血浆5-FU水平,可为使用个性化化疗方案提供依据。



























