
探讨不同病理类型子宫肌瘤的3.0 T磁共振(MR)扩散加权成像(DWI)特征。
回顾分析2012年6月至2015年4月,在温州医科大学附属第二医院经手术病理证实的57例、60个子宫肌瘤病灶(单发38例、多发19例),按不同病理结果类型分3组,其中富细胞性组17个,变性组10个(间质水肿、囊变4个,玻璃样变4个,出血坏死2个),普通未变性组33个。所有患者均行MR常规序列及DWI扫描。对比分析不同组间子宫肌瘤的DWI信号特征,取病灶感兴趣区及邻近正常子宫肌层(对照组)测得表观扩散系数(ADC)值并进行统计学分析。
(1)富细胞性组肌瘤在DWI主要表现为高信号(15/17);变性组肌瘤在DWI可表现为低、等、高信号;普通未变性组肌瘤在DWI以等信号多见(57.6%,19/33)。(2)富细胞性组、变性组、普通未变性组肌瘤的ADC值分别为[(1.01±0.14)×10-3 mm2/s]、[(1.73±0.49)×10-3 mm2/s]及[(1.38±0.22)×10-3 mm2/s],邻近正常子宫肌层(对照组)的ADC值为[(1.35±0.16)×10-3 mm2/s]。普通未变性组肌瘤与对照组间ADC值比较差异无统计学意义(P=0.623),余组间两两比较差异均有统计学意义(均P<0.05)。(3)诊断富细胞性组的受试者工作特征(ROC)曲线下面积为0.950,最佳鉴别阈值为(1.11×10-3 mm2/s),敏感度与特异度分别为88.2%和93.0%。
不同病理类型的子宫肌瘤具有一定的DWI信号特征,其ADC值也存在差异,两者结合能更准确反映病变的组织病理学特性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
子宫肌瘤是最常见的妇科肿瘤,在育龄期妇女中发生率占20%~30%,发病率随年龄增长有所增加[1]。病理上子宫肌瘤分为富细胞性、变性、普通未变性、恶变等几种类型[2]。不同类型子宫肌瘤的治疗方法不尽相同,准确评价肌瘤的病理类型,对指导临床制定治疗方案及随访观察疗效至关重要[3,4]。磁共振(MR)检查作为子宫肌瘤诊断最准确的影像技术,其应用日渐增加,但常规MR序列鉴别其病理类型存在一定困难[5]。扩散加权成像(diffusion-weighted imaging,DWI)是目前唯一能够观察活体组织内水分子扩散运动的无创性检查方法,越来越多的应用于盆腔肿瘤性病变的诊断[6,7]。然而,有关不同病理类型子宫肌瘤DWI特征的报道较少[8]。本研究通过分析不同病理类型子宫肌瘤的DWI信号特征及表观扩散系数(apparent diffusion coefficient,ADC)值,提高对不同病理类型子宫肌瘤诊断的准确性。
回顾分析2012年6月至2015年4月,在温州医科大学附属第二医院经手术病理证实的子宫肌瘤患者57例,60个病灶。包括富细胞性17个,变性10个(间质水肿、囊变4个,玻璃样变4个,出血坏死2个),普通未变性33个。年龄22~68(46±9)岁,体重37.5~75.0(56.8±8.7) kg。核对手术及病理记录,确保MRI与病理取材所选病灶一致。本研究经医院医学伦理委员会批准(批准文号:2015-11),患者知情同意。纳入标准:病灶直径>0.5 cm;能与病理报告所描述病灶准确对应。排除标准:病灶直径<0.5 cm、瘢痕子宫及存在影响肌瘤观察的其他病变。
所有患者均在术前行盆腔MR检查。设备采用美国GE HDxt 3.0 T MR扫描仪,腹部相控阵线圈,仰卧位扫描。扫描参数:层厚6 mm,层间距1 mm,层数20~40层。包括MR常规序列,即横断面自旋回波序列(SE)T1WI,重复时间(TR) 575.0 ms,回波时间(TE) 7.4 ms,回波链长度(ETL)=3;横断面、冠状面、矢状面脂肪抑制快速自旋回波序列(FSE)T2WI,TR 3 050 ms,TE 68 ms,ETL=16及DWI TR 4 000 ms,TE 65.5 ms,b=1 000 s/mm2。
(1)由2名盆腔影像诊断经验丰富的放射科医师共同阅片,诊断结果不一致时讨论并得出一致性结果。MRI观察指标包括子宫肌瘤的位置、大小、形态及信号特征。在不同序列,病灶信号按其主要信号成分(主要信号范围大于病灶的50%)分为高、稍高、等、稍低、低信号5类[9]。具体定义如下:T1WI上低、等、高信号分别同盆腔的液体、盆壁的肌肉及脂肪信号进行对比;脂肪抑制T2WI上低、等、高信号分别同盆壁的脂肪、肌肉及子宫内膜信号进行对比;DWI上低、等、高信号分别同盆壁的肌肉、子宫肌层及子宫内膜信号进行对比,介于两种组织信号之间者称为稍高或稍低信号[10]。(2)ADC值测量:一位高年资医师独立利用后处理工作站(美国GE AW)的Functool 4.5软件,在相应的DWI尽可能大的选取圆形或类圆形感兴趣区(ROI)进行测量,测量3次,取平均值。ROI选择:结合T2WI序列,选择病灶的中心部分,减少邻近组织对ADC值的影响。若病灶信号不均匀,则避开明显的坏死囊变区[7]。选取所有病灶邻近的正常子宫肌层测量ADC值作为对照组,正常肌层距病灶>1 cm且避开血管及结合带[6]。
采用SPSS 19.0软件进行分析,每组数据的正态性检验行K-S检验,多组间ADC值比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD(Least-Significant Difference)检验。以P<0.05为差异有统计学意义。应用受试者工作特征(ROC)曲线确定ADC值鉴别富细胞性肌瘤的诊断阈值。
60个肌瘤中浆膜下4个,黏膜下15个,肌壁间41个(表1)。在T2WI测得肌瘤最大径为0.9~20.2 cm,平均(5.3±4.5) cm。病灶在T1WI多呈等信号(76.7%,46/60),7个富细胞性肌瘤及1个变性肌瘤呈稍高信号,4个变性肌瘤及1个普通未变性肌瘤呈稍低信号,1个普通未变性肌瘤呈低信号。在T2WI富细胞性肌瘤多呈稍高或不均匀高信号(15/17),2个呈等信号;7个变性肌瘤呈稍高或不均匀高信号,3个呈稍低或低信号;普通未变性肌瘤多呈低信号(81.8%,27/33),5个呈稍高信号,1个呈等信号。
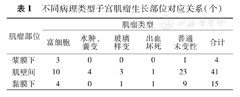
不同病理类型子宫肌瘤生长部位对应关系(个)
不同病理类型子宫肌瘤生长部位对应关系(个)
| 肌瘤部位 | 肌瘤类型 | |||||
|---|---|---|---|---|---|---|
| 富细胞 | 水肿、囊变 | 玻璃样变 | 出血坏死 | 普通未变性 | 合计 | |
| 浆膜下 | 3 | 0 | 0 | 0 | 1 | 4 |
| 肌壁间 | 10 | 4 | 3 | 1 | 23 | 41 |
| 黏膜下 | 4 | 0 | 1 | 1 | 9 | 15 |
17例富细胞性肌瘤在DWI呈高或稍高信号;4例变性肌瘤在DWI呈高或稍高信号,2例呈等信号,4例呈稍低或低信号;5例普通未变性肌瘤呈高或稍高信号,19例呈等信号,9例呈稍低或低信号(表2,图1)。
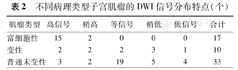
不同病理类型子宫肌瘤的DWI信号分布特点(个)
不同病理类型子宫肌瘤的DWI信号分布特点(个)
| 肌瘤类型 | 高信号 | 稍高 | 等信号 | 稍低 | 低信号 | 合计 |
|---|---|---|---|---|---|---|
| 富细胞性 | 15 | 2 | 0 | 0 | 0 | 17 |
| 变性 | 2 | 2 | 2 | 3 | 1 | 10 |
| 普通未变性 | 3 | 2 | 19 | 5 | 4 | 33 |

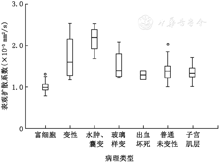
富细胞性组肌瘤ADC值为(1.01±0.14)×10-3 mm2/s;变性组肌瘤ADC值为(1.73±0.49)×10-3 mm2/s,其中水肿、囊变,玻璃样变,出血坏死型肌瘤ADC值分别为(2.15±0.35)×10-3 mm2/s、(1.53±0.39)×10-3 mm2/s和(1.28±0.15)×10-3 mm2/s;普通未变性组肌瘤ADC值为(1.38±0.22)×10-3 mm2/s。邻近正常子宫肌层(对照组)的ADC值为(1.35±0.16 )×10-3 mm2/s (图2)。富细胞性、变性、普通未变性组肌瘤及对照组的ADC值均符合正态分布,该四组间比较差异有统计学意义(F=21.172,P<0.05),普通未变性组肌瘤与对照组的ADC值差异无统计学意义(P=0.623),余组间两两比较差异均有统计学意义(均P<0.05)。诊断富细胞性肌瘤的ROC曲线下面积为0.950,最佳鉴别阈值为1.11×10-3 mm2/s,敏感度与特异度分别为88.2%和93.0%。

子宫肌瘤是妇科常见病,患者出现临床症状时,需要根据不同病理类型选择药物或手术治疗。Yamashita等[4]研究发现促性腺激素释放激素类似物治疗在富细胞性肌瘤中作用显著,对变性及普通未变性肌瘤效果欠佳。陈加优等[11]则认为富细胞性子宫肌瘤有复发及恶变倾向。Shimada等[12]指出子宫动脉栓塞术对完全透明样变肌瘤的疗效不佳。因此治疗前通过MR准确评价子宫肌瘤病理类型,做出准确的分型诊断,将更有助于临床选择最佳治疗方案。
本研究中富细胞性肌瘤在DWI上多呈高信号,变性组肌瘤可呈低、等、高信号,普通未变性肌瘤则多呈等信号。提示当常规序列难以鉴别子宫肌瘤病理类型时,若DWI为高信号,则富细胞性肌瘤可能;若信号较低则肌瘤变性可能。表明DWI序列在一定程度上反映了病变的病理组织学特征,对病灶的定性诊断有较大的帮助。本研究中2例变性肌瘤及2例普通未变性肌瘤在DWI亦为高信号,其ADC值未见明显减低,且病灶在T2WI序列上均呈稍高信号,考虑DWI高信号原因主要为T2透过效应的影响[13]。另1例DWI高信号的普通未变性肌瘤,ADC值减低,在T2WI序列上呈稍高信号,与富细胞性肌瘤相似,考虑该肌瘤的病理改变介于富细胞及普通未变性型之间,细胞排列较紧密、丰富,但尚未达到病理诊断富细胞性的标准。因此,单凭DWI信号特征尚不能准确的对子宫肌瘤做出分型诊断。
ADC值是反映水分子的扩散及毛细血管微循环(灌注)的参数,去除了T2透过效应的影响,能更准确评价病变的扩散受限程度,ADC值的大小与细胞密度、核质比、病变的结构、微环境改变、组织成分如水肿、坏死、纤维化等密切相关[6]。
本研究结果显示富细胞性组肌瘤的ADC值低于变性组、普通未变性组,原因在于富细胞性肌瘤平滑肌细胞束丰富,排列紧密[7],使细胞外间隙变窄,水分子扩散受限,导致ADC值减低。富细胞性组肌瘤的DWI信号特征及ADC值均与其余两组差异显著,在DWI上信号增高,而ADC值减低,与子宫平滑肌肉瘤等恶性病变的特征相似,该研究结果支持既往学者提出交界性平滑肌瘤的概念[14]。普通未变性肌瘤即典型的子宫肌瘤,由致密的束状梭形平滑肌细胞和数量不等的纤维结缔组织构成,以平滑肌细胞为主,纤维结缔组织将其分隔、固定,肌瘤本身没有包膜,但其外围有边界清晰的假包膜[1],其ADC值与未受累子宫肌层间差异无统计学意义,与前文所述普通未变性肌瘤DWI多呈等信号相符。变性肌瘤为普通未变性肌瘤中出现广泛的退行性变。本研究变性组肌瘤的ADC值高于其余两组,其中水肿、囊变型肌瘤的ADC值高于其他变性类型,原因为水肿样变性会扩大细胞外的间隙,使ADC值增高[15]。Sheerin等[13]认为,细胞毒性水肿导致ADC值减低,血管源性水肿时ADC值不减低,提示水肿、囊变型肌瘤为血管源性水肿可能。Shimada等[12]研究指出,玻璃样变肌瘤的细胞外间隙有蛋白质样组织沉积,限制了组织的扩散及灌注,使ADC值减低。本研究中玻璃样变肌瘤的ADC值较普通未变性组未见明显降低,可能由于Shimada等在小b值(b=1.51和55.3 s/mm2)下进行研究,b值越小,微血管灌注效应的影响越大[10],即灌注减低,ADC值减低;灌注增加,ADC值升高。本研究在b=1 000 s/mm2的条件下进行,高b值条件减小了灌注对ADC值的影响。
富细胞性肌瘤的特殊性质决定了鉴别诊断的重要性,ROC曲线结果表明,根据最佳鉴别阈值(1.11×10-3 mm2/s),判定富细胞、非富细胞性肌瘤具有很高的敏感度与特异度,提示ADC值在富细胞性肌瘤的鉴别诊断中作用突出。本研究中没有黏液样变性及恶性子宫肌瘤病例,对这两种肌瘤的DWI特征及ADC值尚需要后序研究来完善。
综上所述,不同病理类型子宫肌瘤的DWI信号有一定特征,各种类型病变之间ADC值差异亦有统计学意义,两者结合可从水分子扩散角度对子宫肌瘤进行分型诊断,是MR常规序列的重要补充,值得临床推广应用。



























