
研究进展期胃癌新辅助化疗后病理完全缓解病例的生存情况。
回顾性分析2011年1月至2013年12月的解放军总医院普通外科收治的接受胃癌新辅助化疗并行手术病例的临床资料,对其中术后病理完全缓解病例进行分析。
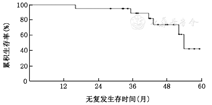
23例(16.0%,23/144)患者达到术后病理完全缓解。中位随访时间为42.8(16.0~58.7)个月。所有患者接受胃癌D2根治术。3年总生存率和3年无复发生存率分别为95.7%和90.3%。
进展期胃癌新辅助化疗后病理完全缓解患者预后良好,可通过改良化疗方案进一步提高病理完全缓解率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前,多项大规模随机临床试验结果证明胃癌新辅助化疗(NAC)的疗效优于单纯手术,新辅助化疗联合手术已成为进展期胃癌的治疗模式之一[1,2,3]。胃癌新辅助化疗可以使原发肿瘤缩小降期,达到更高切除率,甚至能达到病理完全缓解(pCR)[4]。进展期胃癌病理完全缓解是与预后相关的重要因素[5]。目前进展期胃癌病理完全缓解率仍比较低,本研究通过对胃癌新辅助化疗后pCR病例的临床病理资料分析,探讨其特征,现将结果报道如下。
1.入组标准:(1)经胃镜病理检查确诊为胃癌;(2)通过超声胃镜、腹部CT、锁骨上淋巴结超声、腹腔镜探查、正电子发射断层成像术(PET-CT)等检查行肿瘤评估分期,按第7版美国癌症联合会(AJCC)分期为Ⅱ或Ⅲ期的患者,其中腹腔镜探查和PET-CT检查,首先建议患者行腹腔镜探查,如患者拒绝则行PET-CT检查;(3)美国东部肿瘤协作组(ECOG)评分:0~2分;(4)年龄18~80岁;(5)血液检测和身体一般状况能够耐受化疗及手术;(6)签署知情同意书。
2.解放军总医院普通外科于2011年1月至2013年12月供纳入Ⅱ或Ⅲ期进展期胃癌183例行新辅助化疗,其中39例因患者不能耐受或改变治疗方案,最终144例完成新辅助治疗,其中23例患者术后病理检查提示病理完全缓解。144例患者中接受腹腔镜探查者122例,行PET-CT检查者22例。
奥沙利铂和卡培他滨(CapeOX)方案:卡培他滨1 000 mg/m2,d1~14,口服,奥沙利铂130 mg/m2, d1,静脉滴注,每3周1个周期。奥沙利铂和替吉奥(SOX)方案:替吉奥(S-1)80 mg/m2,d1~14,口服;奥沙利铂130 mg/m2, d1,静脉滴注,每3周1个周期。根据患者化疗反应调整药物剂量。至少完成2周期化疗后再行手术治疗。其中奥沙利铂生产厂家为法国赛诺菲制药有限公司,卡培他滨为上海罗氏制药有限公司,替吉奥为日本大鹏制药有限公司。
在患者完成最后一次化疗后至少4周才可行手术治疗。手术按照日本胃癌协会《胃癌治疗指南》(第3版)的手术范围规定行D2淋巴结清扫[6]。
肿瘤大小、肿瘤位置、化疗前的T分期及N分期根据胃镜、超声胃镜及腹部CT平扫加增强进行评估。
病理学评价根据Becker等[7]提出的评分系统进行半定量评定,根据镜下在瘤床上残留的肿瘤细胞比例来具体分级。pCR定义为胃癌新辅助化疗后手术切除标本显微镜下肿瘤细胞完全消失,即Becker分级的1a级。其余病例定义为非pCR,即Becker分级的1b级(残留肿瘤<10%),2级(10%<残留肿瘤<50%),3级(残留肿瘤>50%)。
术后所有患者均按术前方案接受化疗,至少完成2周期化疗。23例患者均按照日本胃癌协会《胃癌治疗指南》(第3版)中的随访表行门诊随访,无失访患者。
应用SPSS 17.0软件进行统计学分析。总生存时间被定义为从NAC启动到死亡的时间,无复发生时间定义为从NAC启动到复发的时间。Kaplan-Meier法和log-rank检验被用来估计总生存率和无复发生存率。
23例患者其中男19例,女4例,男女之比4.75∶1,年龄30~73岁,中位年龄60岁。肉眼分型蕈伞型2例,溃疡型4例,溃疡浸润型14例,弥漫浸润型3例。组织学分型:分化型6例,未分化型17例。临床TNM分期中,T分期T1期2例,T2期8例,T3期3例,T4a/4b期10例;N分期中N0/N1期7例,N2/N3期16例,均无远处转移。术前临床分期Ⅱ期7例,Ⅲ期16例。
23例患者均接受胃癌D2根治术,其中根治性远端胃大部切除8例,根治性近端胃大部切除2例,根治性全胃切除13例,均为R0切除。pCR率为16.0%,术后淋巴结检出中位数为32(10~74)枚,阳性淋巴结中位数0 (0~2)枚;其中5例患者术后病理证实原发灶完全缓解但清除淋巴结中可见癌转移,其中1例患者1枚,4例患者2枚。手术住院时间10~28 d,平均住院时间为17.7 d。没有患者行非预期二次手术,没有患者住院期间死亡。
20例患者使用SOX方案,3例患者使用CapeOX方案。术前新辅助化疗周期中位数为4(2~5)周期,术后辅助化疗周期术前新辅助化疗周期中位数为4(3~7)周期。
中位随访时间为42.8(16.0~58.7)个月。2例患者死于胃癌,1例患者死于脑出血;死于胃癌的2例患者均为术后病理有淋巴结转移患者。3例患者复发但仍带瘤生存,2例为肝转移,1例为腹主动脉旁淋巴结旁转移,其中1例患者为术后病理有淋巴结转移者。3年总生存率为95.7% (95%CI:100~91.4),(图1)。3年无复发生存率90.3% (95%CI:96.8~83.8)(图2)。
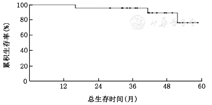


目前,多项随机临床试验结果证明胃癌新辅助化疗(NAC)的疗效优于单纯手术,新辅助化疗联合手术已成为进展期胃癌的治疗模式之一[1,2,3]。而接受NAC治疗后达到pCR的进展期胃癌患者,其总生存率和无复发生存率极高,能够达到早期胃癌患者的相同预后[8]。本研究中,达到pCR患者其3年总生存率达到95%,达到与早期胃癌类似的预后。
NAC相对术后化疗有具有一定优势,能够使原发肿瘤缩小甚至消失达到pCR,更能使微小转移灶可能在早期得到治疗,从而提高了疗效[9]。我们的研究中,患者3年无复发生存率达到90%,表明NAC对复发及微转移的有一定效果。
本组pCR患者占所有同期行NAC患者的16.0%,较以往报道的pCR率高。Fields等回顾性分析714例行NAC治疗病例,其中pCR病例为60例,占8.4%;Yoshikawa等[10]报道了83例行NAC治疗病例,其中pCR病例为4例,占4.8%。影响pCR率的因素很多,首先本组pCR率较高与本组患者的临床分期比既往研究病例早有关。行NAC治疗的患者分期均为临床分期,各种术前评估检查方式均不能做到完全准确,常用的CT等检查对胃癌TNM分期的准确性有限,更有一部分腹膜转移患者难以通过CT等影像检查发现[11]。同既往研究不同,本组患者NAC治疗前均排除远处转移。其次新辅助化疗方案对也可能影响pCR率,既往NAC治疗所用药物一般以5-FU为主,加上阿霉素、丝裂霉素、顺铂中两种组成,其中以FLEP、EAP多见,其pCR率在5%左右,近来报道以多烯紫杉醇为主的TCF方案有11.7%的pCR率[12]。本组使用奥沙利铂加卡培他滨或替吉奥胶囊的方案,较原有方案有一定优势。当然也有可能存在选择偏差,因本组患者未能行随机分组,医生在选择行NAC治疗病例时作为新的治疗方式,往往期待好的疗效,会不自觉选择分期相对较早患者。
本组pCR患者中存在5例患者原发灶已经无肿瘤存在,但淋巴结仍转移,另外本组中5例pCR患者伴有淋巴结转移者,其预后较差,同以往报道类似[13]。这说明胃癌新辅助化疗后原发灶和转移淋巴结的对化疗的反应程度并非都是一致的,如仍存在转移淋巴结其预后不良,具体机制值得进一步研究,但目前此种病例罕见需进一步积累。
我们的研究表明,接受NAC治疗的进展期胃癌患者,如果其达到pCR,其生存率和无复发生存率明显提高。但目前进展期胃癌NAC治疗后pCR率仍较低,本组中仅达到16.0%。进一步研究方向可考虑影响pCR率的各种因素,通过改变NAC方案或周期进一步提高pCR率。



























