
探讨影响儿童急性淋巴细胞白血病(ALL)复发的因素及治疗策略。
回顾性分析2007年1月至2015年1月在首都医科大学附属北京儿童医院血液肿瘤中心收治的60例ALL复发患儿的临床资料,分析不同复发时间、复发部位及复发后治疗方法与预后之间的关系。
60例复发患儿中位年龄70.5个月,初诊时B淋巴细胞表型51例,中位复发时间30.5个月,骨髓复发45例,单独髓外复发15例。共56例患儿进行复发后治疗,32例无病生存,中位随访时间19个月(3~78个月);以包含环磷酰胺、泼尼松、多柔比星、左旋门冬酰胺酶、长春地辛(CODLP)方案及包含地塞米松、多柔比星、培门冬酶、长春地辛(VDLD)的方案进行诱导的复发后缓解率分别为85.7%(12/14例)及92.9%(39/42例);骨髓复发及单独髓外复发的总生存率分别为57.14%(24/42例)及78.57%(11/14例),以上结果差异均无统计学意义(χ2=0.073,P=0.787;χ2=2.979,P=0.084)。早期复发、中间复发及晚期复发患儿的总生存率分别为43.75%(7/16例)、46.67%(7/15例)及80.00%(20/25例),早期及中间复发的生存率分别与晚期复发生存率比较差异均有统计学意义(χ2=10.122,P=0.001; χ2=6.179,P=0.013);患儿骨髓复发后进行化疗及造血干细胞移植治疗的总生存率分别为26.92%(7/26例)及100.00%(16/16例),差异有统计学意义(χ2=18.481,P<0.001)。
初诊时的准确分层治疗可以有效减少ALL的复发,VDLD方案仍可作为有效的缓解方案,异基因造血干细胞移植是高危复发患儿的有效治疗方法,单独睾丸白血病复发患儿可以通过化疗及放疗获得长期生存。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在目前的临床治疗中,由于对抗白血病制剂的优化应用及支持治疗的改进,发达国家儿童急性淋巴细胞白血病(ALL)的5年生存率已经超过85%[1]。而最常见的治疗失败就是复发,在欧洲ALL的复发率为15%~20%[2],复发可能与宿主及癌症的基因组同时相关[3],而复发后10年的无事件生存率仅有30%[4]。目前国内对儿童复发ALL的临床研究较少,现将首都医科大学附属北京儿童医院近8年来收治的60例儿童复发ALL的临床特征及生存情况进行回顾性分析,探讨与儿童ALL复发相关的因素、预后指标及治疗策略。
对2007年1月至2015年1月首都医科大学附属北京儿童医院血液肿瘤中心收治的所有ALL复发患儿进行分析。临床病例资料收集前均经患儿监护人签署知情同意书,并经医院医学伦理委员会批准。
[5] 初诊为ALL患儿经诱导缓解后出现下述情形之一:(1)骨髓(BM)复发:BM原始和幼稚淋巴细胞>0.25;(2)髓外复发:①中枢神经系统白血病(CNSL)复发,包括头颅MRI /CT(平扫+增强)浸润或块状病变,能除外其他原因的颅神经瘫痪或视网膜浸润,脑脊液有幼稚淋巴细胞,白细胞>5×106/L,并且能除外腰穿损伤;②睾丸白血病(TL)复发:无痛性睾丸肿大,触之较硬,形状不规则,活检病理见白血病细胞浸润。
[6] (1)早期复发:复发距离初次缓解<18个月;(2)中间复发:复发距离初次缓解≥18个月,且<36个月;(3)晚期复发:复发距离初次缓解≥36个月。
2011年1月1日前患儿予CODLP(环磷酰胺、泼尼松、多柔比星、左旋门冬酰胺酶、长春地辛)方案,2011年1月1日后患儿予VDLD(地塞米松、多柔比星、培门冬酶、长春地辛)方案诱导化疗,缓解后按BCH–2003 ALL(2008年1月1日前)或CCLG–2008 ALL(2008年1月1日后)高危方案化疗;如具备条件(BM完全缓解、适当供者)建议于巩固3个疗程后行异基因造血干细胞移植(HSCT);如同时伴有髓外复发在进入维持治疗或移植前进行放疗。
CNSL复发患儿采用化疗+鞘内注射+放疗,TL复发患儿采用化疗+放疗方案。化疗方案同BM复发,完成高危化疗方案直至停药,维持治疗前完成颅脑或睾丸局部放疗。
BM缓解标准参见《血液病诊断及疗效标准》[5];中枢神经系统白血病缓解定义为脑脊液细胞学检查未见幼稚细胞或影像学缓解;睾丸复发缓解标准定义为肿大睾丸较前回缩,影像学检查未提示异常血流及回声。
随访期定义为自复发至死亡或随访结束,以住院、门诊及电话回访,终止时间为2015年3月。
应用SPSS 17.0软件完成。计数资料采用χ2检验或Fisher's精确概率检验比较组间差异;总生存期(OS)定义为自复发诊断起至死亡或末次随访时间,OS采用Kaplan–Meier生存曲线,各组之间生存率的比较采用Log–rank检验;统计检验均采用双侧检验,P<0.05为差异有统计学意义。
2007年1月至2015年1月共收治复发ALL患儿60例。男44例,女16例;中位发病年龄为70.5个月(13~171个月);初诊在首都医科大学附属北京儿童医院28例,32例初诊于当地医院,复发后来院治疗。
患儿初诊时间最早为2007年,初诊时部分实验室资料及治疗情况无法获得。51例(85.0%)初诊为前体B淋巴细胞表型,11例初诊时归为高危。染色体异常24例,包括t(9;22) 4例、t(12;21) 3例、t(1;19) 2例、t(11;19) 1例、t(4;11)1例、t(17;19) 1例,其他数量或核型异常改变12例;融合基因阳性22例,包括BCR/ABL 4例、TEL/AML1 3例、E2A/PBX1 2例、MLL/ENL 1例、MLL/AF4 1例、E2A/HLF 1例、SIL/TAL1及HOX活化等其他异常改变10例。患儿均予VDLD或VDLP方案进行初次诱导治疗,56例(93.3%)在33 d内获得完全缓解;22例进行过第33天微小残留病(minimal residual disease,MRD)监测,仅18.2%(4/22例)的患儿在第33天转为阴性,17例进行了第12周MRD监测,仍有23.5%(4/17例)的患儿在第12周MRD为阳性。复发前所有患儿未进行过HSCT。
早期复发19例(31.7%),中间复发16例(26.7%),晚期复发25例(41.7%);中位复发时间为30.5个月(3~108个月)。
BM复发45例(75.0%),其中1例为BM合并CNSL复发;IEM复发15例(25.0%),其中TL复发9例,CNSL复发5例,TL合并CNSL复发1例。
60例复发患儿中,4例(3例BM复发,1例单独TL复发)诊断后未再治疗,故对余56例治疗患儿进行复发后治疗情况评估。56例复发患儿应用CODLP方案[14例(25.0%)]或VDLD方案[42例(75.0%)]进行复发后的诱导治疗(表1)。
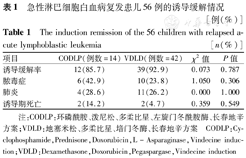
急性淋巴细胞白血病复发患儿56例的诱导缓解情况[例(%)]
The induction remission of the 56 children with relapsed acute lymphoblastic leukemia[n(%)]
急性淋巴细胞白血病复发患儿56例的诱导缓解情况[例(%)]
The induction remission of the 56 children with relapsed acute lymphoblastic leukemia[n(%)]
| 项目 | CODLP(例数=14) | VDLD(例数=42) | χ2值 | P值 |
|---|---|---|---|---|
| 诱导缓解率 | 12(85.7) | 39(92.9) | 0.073 | 0.787 |
| 脓毒症 | 6(42.9) | 10(23.8) | 1.050 | 0.306 |
| 肺炎 | 4(28.6) | 11(26.2) | 0.000 | 1.000 |
| 诱导期死亡 | 2(14.2) | 2(4.7) | 0.359 | 0.549 |
注:CODLP:环磷酰胺、泼尼松、多柔比星、左旋门冬酰胺酶、长春地辛方案;VDLD:地塞米松、多柔比星、培门冬酶、长春地辛方案 CODLP:Cyclophosphamide,Prednisone,Doxorubicin,L–Asparaginase,Vindecine induction;VDLD:Dexamethasone,Doxorubicin,Pegaspargase,Vindecine induction
56例患儿中无病存活32例,无病存活率为57.14%,中位随访时间15个月(2~78个月);死亡22例,其中因原发病死亡15例,因化疗并发症死亡7例,中位随访时间7个月(2~39个月);带病存活2例,至2015年1月随访时间3个月。
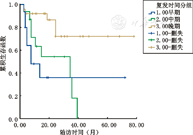
56例患儿根据复发时间不同分为3组:早期复发16例,中间复发15例,晚期复发25例。3组中位随访时间分别是5.5个月(2~19个月)、14.0个月(2~39个月)及20.0个月(2~78个月),至随访结束3组生存率分别为43.75%(7/16例)、46.67%(7/15例)、80.00%(20/25例)(图1)。早期复发与晚期复发生存率比较差异有统计学意义(χ2=10.122,P=0.001),中间复发与晚期复发生存率比较差异有统计学意义(χ2=6.179,P=0.013),早期复发与中间复发生存率比较差异无统计学意义(χ2=0.719,P=0.397)。

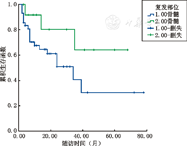
56例患儿根据复发部位不同分为2组:BM复发42例,IEM复发14例。中位随访时间分别为14.5个月(2~78个月)及16.5个月(3~68个月),至随访结束2组生存率分别为57.14%(24/42例)、78.57%(11/14例),差异无统计学意义(χ2=2.979,P=0.084)(图2)。

42例BM复发患儿根据是否行异基因HSCT分为2组,其中化疗组26例,移植组16例,中位随访时间分别为8.5个月(2~39个月),21.0个月(3~78个月),至随访结束2组生存率分别为26.92%(7/26例)、100.00%(16/16例),差异有统计学意义(χ2=18.481,P<0.001)(图3)。化疗组中位复发时间为30个月(7~84个月),患儿家属因经济等原因不选择移植。14例(53.85%)为早期或中间复发,全部死亡,其中11例为原发病无法控制死亡;12例患儿为晚期复发,至随访结束7例生存。
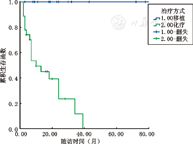

移植组中位复发时间为43个月(3~108个月),7例(43.75%)为早期及中间复发,9例为晚期复发,至随访结束所有患儿生存。
治疗的56例患儿中14例为IEM复发,均未进行异基因HSCT,生存率为78.57%(11/14例)。共死亡3例,均为单独CNSL复发患儿因原发病无法控制死亡,其中1例合并严重脑白质脱髓鞘病变。
本研究中共7例患儿出现CNSL复发,其中5例为单独CNSL复发,复发时间为9、13、15、24及30个月,均属于早期或中间复发;2例分别伴有BM及睾丸复发,复发时间为108个月及36个月,为晚期复发。7例患儿中3例(42.9%)初诊时为T淋巴细胞表型,6例(85.7%)患儿初诊时白细胞>50×109/L,1例患儿在初次治疗鞘内注射时有明确出血史,1例患儿在初次治疗时未静脉使用过甲氨蝶呤。5例单独CNSL复发患儿仅1例无病生存,1例为带病存活。
尽管儿童ALL的治疗效果有明显改善,但是即使采用了危险度分级指导下的治疗策略,治愈率仍然有较大差别,约20%的患儿还会经历复发。国际上关于儿童复发ALL的基础研究及临床研究较多,但我国相关临床研究相对较少,本研究收集首都医科大学附属北京儿童医院血液肿瘤中心2007年1月至2015年1月收治的儿童复发ALL 60例资料进行回顾性研究,探讨与复发相关的因素以及可行的治疗方法。
一项关于成人ALL的研究提示影响复发的因素包括前体T–ALL型,白细胞总数>100×109/L,巩固化疗疗程数<3个以及合并CNSL[7]。儿童ALL除了传统的判断预后的因素外,还有研究表明某些基因表达或突变对预后有不良影响,如伴IKZF1缺失或CRLF2重排的Ph样的ALL就有很高的复发风险[8]。由此可见儿童ALL良好的治疗效果来自于更精准的危险度分级及规范化治疗[9]。但进行完整的遗传学检查及分子生物学监测患儿很少,尤其是8年前,我国大部分医院仅能对ALL开展形态学和免疫学检查,而对遗传学及分子生物学的监测受到很大限制。初诊时实验室检查的局限性影响了危险度的准确评估及治疗方案的选择,因而也可能增加了复发及治疗相关死亡的风险。
在许多关于MRD的研究中显示诱导缓解时的MRD水平是预测复发的独立因素[2,6]。对诱导缓解结束时MRD≥0.01%的患者,2年二次复发累积发病率为70%[2]。对高MRD水平的患者治疗策略均建议缓解后化疗联合HSCT治疗[10]。本研究结果显示,在初诊时进行MRD监测的患儿中仅18.2%在第33天转为阴性(<1×10–4),至第12周仍有26.5%的患儿为阳性,说明大部分复发患儿在初诊时对化疗的反应相对较差,复发风险较高,也提示MRD监测对判断患儿预后的作用。然而这60例患儿均未进行HSCT,化疗后患儿出现复发,因此提高血液实验室水平对患儿进行有效监测,可准确划分危险程度,而对高危患儿及早进行强烈治疗,可减少复发的发生。
有研究显示,复发ALL标准的挽救性治疗依然主要是以一线药物的不同剂型、剂量和方案为基础而进行的。早期复发的化疗缓解率可>70%,而晚期BM复发的患儿缓解率可高达96%[6];Children's Oncology Group(COG)一项研究表明,通过标准4药联合再诱导治疗(泼尼松、多柔比星、硫酸长春新碱、培门冬酶),可以使入组的124例患儿达到81%形态学缓解[2]。本研究中复发患儿予以CODLP或VDLD方案诱导,也得到与文献[2,6]报道相似的缓解结果。而VDLD方案不仅可以使患儿获得缓解,而且诱导期间化疗相关病死率较CODLP方案降低,更强烈的CODLP方案无论在缓解率还是化疗相关病死率方面均无优势。患儿在复发前已经历了强烈化疗,骨髓及机体耐受化疗能力减低,过强的化疗方案更易增加化疗相关并发症的发生率,导致诱导期间病死率增高。
复发时间以及复发部位被认为是主要影响预后的因素,但仍有争议。COG将复发时间以18个月和36个月分为早期复发(<18个月),晚期复发(≥36个月)及中间复发(18~35个月)[11]。对于早期复发的患者,不足1/3的患儿能长期存活。然而,对于晚期复发的患者,有近50%可以长期存活[2]。Gandemer等[11]的临床研究显示,只有复发时间对预后有明显影响。本研究将接受治疗的56例患儿根据18个月及36个月2个复发时间点分为3组,早期及中间生存率与晚期复发生存率比较差异有统计学意义,说明复发时间确实对预后影响明显,而复发时间在初诊36个月之后是提示患儿复发后预后较好的时间点。
COG的一项研究结果显示单独BM复发、BM联合髓外复发以及IEM复发3种情况的5年无事件生存率分别是24%、39%及59%[2]。本研究结果也提示IEM复发的总生存率高于BM复发,但是生存率与文献[2]比较均较高,可能与病例数相对较少,随访时间较短有关。
治疗方案的长足进步和以预防CNSL为方向的治疗策略使儿童ALL中CNSL的发生率下降至5%~10%[12],但仍有2%~10%的患儿会出现CNSL复发,初诊时T淋巴细胞表型,高白细胞,高危的异常融合基因,脑脊液中可见白血病细胞(即使由于鞘内注射损伤导致)都是CNSL复发的高危因素[13,14]。本研究显示CNSL复发患儿有近一半为T淋巴细胞表型,85.7%在初诊时白细胞>50×109/L,具有CNSL复发的高危因素,均与文献[13,14]报道相符。有研究显示高CNSL复发率与全身化疗不足有关[13]。本研究中1例单独CNSL复发的病例,初诊时为B淋巴细胞表型,白细胞<50×109/L,但初诊医院在化疗方案中未使用静脉甲氨蝶呤,也提示对CNSL预防不足可能是导致复发的高危因素之一。初次鞘内注射时损伤可因初诊时外周血中大量的幼稚细胞成为CNSL复发的高危因素之一[13]。本研究中1例患儿初诊时白细胞为200×109/L,而首次鞘内注射时出血,更增加了CNSL复发的风险。因此患儿首次鞘内注射时应保证血小板达到安全水平,请有经验的医师进行操作,并尽可能使患儿在麻醉状态下进行操作可以有效减少创伤发生。
COG的临床试验显示早期(<18个月)、中间及晚期(≥36个月)单独CNSL复发患儿的5年生存率分别为(43.5±4.5)%、(68.0±4.6)%及(78.2±8.8)%[15];Pui[13]报道复发时间>18个月,且初诊时为B淋巴细胞表型的单独CNSL复发患儿4年无事件生存率可达77.7%。由此可以看出复发时间对于单独CNSL复发患儿也是较为重要的预后因素,本研究中5例单独CNSL复发的患儿仅1例无病存活,也与这5例患儿均为早期复发有关。
与初治ALL相似,复发的ALL在很多协作组也按危险度分层治疗,现有的复发危险度分级是基于BFM复发协作组的系统进行的,按照复发时间、复发部位、免疫表型等,将复发分为4级S1~S4[6]。再次缓解后是否进行HSCT应根据危险度不同而变化。对于高危(如早期BM复发、T细胞ALL复发)的患者采用HSCT可使患者获益,但对低危患者(如晚期BM复发或IEM复发),HSCT的效果并不比化疗好[2]。而对初次挽救化疗反应差或再诱导高MRD水平的患者在缓解后必须尽早进行HSCT。有研究指出,即使强调减低移植前肿瘤负荷、MRD水平,但并未提高存活率[16]。在病例收集期间,本中心对所有BM复发患儿的治疗方法均为化疗缓解后进行HSCT,部分家长因为经济等原因拒绝HSCT,所以BM复发患儿自然分成化疗组和移植组。化疗组26例患儿中复发时间<36个月的患儿全部死亡,而移植组早期及中间期复发的患儿全部存活,提示HSCT是高危复发患儿挽救治疗中重要的环节,但是仍需增加样本量及随访时间观察生存率情况。化疗组有7例晚期复发患儿存活,但是否可以达到长期生存仍需随访,但也提示对于低危BM复发患儿可以考虑通过化疗获得生存。本研究显示IEM复发患儿的总生存率达到78.57%,且睾丸复发患儿均存活,也提示通过全身系统化疗结合局部放疗方法是IEM复发患儿有效的治疗方法,不需进行HSCT。随着对复发病例的研究逐渐加深,在今后的临床工作中,也应对复发患儿进行个体化评估,分层治疗。
综上所述,初诊时精确的细胞形态学、免疫学、细胞遗传学和分子生物学诊断分型及以MRD为基础的规范分层治疗,能有效减少儿童ALL复发;VDLD方案可作为儿童复发ALL挽救性再诱导方案,更强烈化疗并无优势;HSCT是高危复发ALL患儿有效的治疗方法,单独TL复发患者可以通过化疗及放疗获得长期生存。



























