
探讨不同功能化修饰的多壁碳纳米管(F-MWCNTs)对人外周血单个核细胞(PBMC)的细胞毒性的影响。
利用透射电镜表征5种直径和长度均相同的MWCNTs(羟基、羧基、氨基、镀镍修饰和未修饰的MWCNTs(P-MWCNTs))在生理盐水溶液中的分散性。体外实验中先通过Ficoll密度梯度离心从人外周血中分离出PBMC,再将5种MWCNTs分别超声分散于含血清的培养基中,与PBMC共培养12、24、48、72 h,通过CCK-8试剂盒检测5种MWCNTs对PBMC的细胞毒性。
5种MWCNTs的分散性相对良好,尤其是各F-MWCNTs。细胞毒性实验结果表明,MWCNTs的细胞毒性呈剂量-效应关系和一定的时间-效应关系。F-MWCNTs与P-MWCNTs相比,细胞毒性发生显著变化,其中羟基、羧基和氨基修饰的MWCNTs的细胞毒性减小,尤以氨基修饰的细胞毒性减小最为显著(P<0.05);而镀镍修饰的MWCNTs的细胞毒性反而明显增大,其处理细胞24 h和48 h时的细胞存活率较同剂量(25 μg/ml)的P-MWCNTs均有所降低,差异均有统计学意义(P<0.01,P<0.05)。
功能化修饰不仅影响MWCNTs在水溶液中的分散性,还影响MWCNTs对人外周血淋巴细胞的细胞毒性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
碳纳米管(carbon nanotubes,CNTs)因其独特的空间结构和优良的电热理化性能,广泛应用于电子器件、复合材料及生物医药等众多领域[1,2]。CNTs根据其管壁层数,分为单壁碳纳米管(single-walled carbon nanotubes, SWCNTs)和多壁碳纳米管(multi-walled carbon nanotubes, MWCNTs);根据其表面是否被修饰,分为未修饰的碳纳米管(pristine CNTs,P-CNTs)和功能化修饰的碳纳米管(functionalized CNTs,F-CNTs)。P-CNTs呈疏水性,在生理溶液下容易聚集成束,进入机体后易被吞噬细胞吞噬导致细胞坏死或凋亡,从而限制了其在生物医学方面的应用。通过对CNTs表面进行功能化修饰,不仅可改善其表面特性,提高其生物相容性,还可作为药物递送载体靶向输运药物[3]。对CNTs的功能化修饰通常有以下几种方式:通过侧壁吸附生物活性分子;将生物分子共价连接于CNTs表面;将分子包裹于CNTs腔内[4]。近年来,研究人员对纳米材料作为药物载体产生了浓厚兴趣[5]。其中CNTs作为药物载体用于各种癌症的治疗受到诸多学者的青睐,通过将紫杉醇、阿霉素等治疗药物结合于CNTs表面,凭借CNTs高负载率、靶向性和控制释放的优势从而达到良好的抗癌效果[6,7]。
鉴于CNTs的广泛应用,关于其生物安全方面的研究显得极其重要。近年来,关于CNTs的生物毒性评价的研究逐渐增多,如对血液循环、淋巴回流、肺部及心脏等的影响[8,9]。由于CNTs很轻,易分散于空气中被人吸入,因此关于CNTs对人肺部毒性的研究是最早被关注的。大量实验证实:将一定量的CNTs灌注入小鼠体内,会引起肺部炎症、氧化损伤和纤维化[10]。近几年关于CNTs的免疫毒性研究也逐渐增多,大多是研究CNTs对单个免疫细胞的影响,包括巨噬细胞、T淋巴细胞、单核细胞和树突状细胞等[11]。由于免疫细胞之间是通过相互作用来发挥作用的,本研究以人外周血单个核细胞(human peripheral blood mononuclear cell, PBMC)为研究对象,研究了未修饰的MWCNTs (P-MWCNTs)和4种不同功能化修饰的MWCNTs (F-MWCNTs)对PBMC的毒性影响。
5种MWCNTs(羟基、羧基、氨基、镀镍修饰的MWCNTs及P-MWCNTs )(北京德科岛金科技有限公司),淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司),RPMI 1640培养基(美国HyClone公司),胎牛血清(美国Gibco公司),微栅(北京新兴百瑞技术有限公司),细胞增殖-毒性试剂盒(CCK-8 kit)(日本同仁化学研究所)。SpectraMax Plus 384酶标仪(美国Molecular Devices公司),Tecnai GZ F20透射电镜(荷兰FEI公司),Sigma 2-16K离心机(德国Sigma公司)。
分别称取5种MWCNTs各10 mg,置于20 ml的玻璃瓶中,加入10 ml含体积分数为10%胎牛血清的RPMI 1640培养基,使MWCNTs的最终质量浓度为1 mg/ml,室温下以70%功率超声30 min,然后12 000×g离心5 min,收集悬液备用。
将MWCNTs悬液稀释至肉眼可见黑色,用移液枪吸取10 μl稀释后的悬液,滴于微栅的支持膜面,再将微栅置于干净滤纸上晾干,即可用透射电镜观察并测量MWCNTs的直径。
在10 ml离心管中加入4 ml Ficoll淋巴细胞分离液,取肝素抗凝静脉血与等量Hank's液充分混匀,用吸管沿管壁将其缓慢叠加于分层液面上,注意保持界面清晰;然后于室温下450×g离心20 min,离心后管内细胞分为3层,上层为血浆和Hank's液,中层为淋巴细胞分离液,下层主要为红细胞和粒细胞,在上、中层界面处有一以PBMC为主的白色云雾层狭窄带(图1)。将移液器小心插入云雾层,吸取PBMC。置入10 ml玻璃离心管中,加入5倍体积的Hank's液,300×g离心10 min,按该法洗涤细胞两次;末次离心后,弃上清,加入含体积分数为10%胎牛血清的RPMI 1640培养基,重悬细胞;取一滴细胞悬液与一滴0.2%台盼兰染液混合,于血球计数板上,计数4个大方格内的细胞总数,再按以下公式计算PBMC的浓度


PBMC—人外周血单个核细胞
PBMC浓度(细胞数/1 ml细胞悬液)=4个大方格内细胞总数/4×104×稀释倍数
细胞计数后向PBMC中加入含体积分数为10%胎牛血清的RPMI 1640培养基;然后以2×106个细胞/孔铺板,每孔200μl;随后向实验组中分别加入MWCNTs悬液,使得MWCNTs的最终质量浓度分别为25或50 μg/ml,阳性对照组中加入终质量浓度为50 μg/ml的脂多糖(lipopolysaccharide, LPS ),阴性对照组则只有含体积分数为10%胎牛血清的RPMI 1640培养基,置于5% CO2的37℃培养箱中分别培养12、24、48、72 h;再向每孔中加入20μl CCK-8溶液,于37 ℃培养箱中避光孵育2 h;分别取各孔上清液100 μl,加至一新96孔板的相应孔中,用酶标仪测定450 nm处的吸光度(OD)值,再以≥600 nm的任一波长为参考波长进行双波长测定,计算细胞存活率


采用SPSS19.0统计学软件处理数据,数据以均值±标准差( ±s)表示,采用单因素方差分析法进行统计学处理。以P<0.05为差异有统计学意义。
±s)表示,采用单因素方差分析法进行统计学处理。以P<0.05为差异有统计学意义。
MWCNTs在水中的分散性可能会影响其毒性及免疫安全性评价结果。本研究采用透射电镜对5种MWCNTs的形态及分散性进行了表征,结果如图2所示,5种MWCNTs的分散性良好,其中F-MWCNTs的分散性优于P-MWCNTs。材料购买时提供的和通过透射电镜表征得到的部分参数见表1,其中直径1和长度是样品说明书标注的,直径2是将MWCNTs分散于水溶液中,经透射电镜测得。
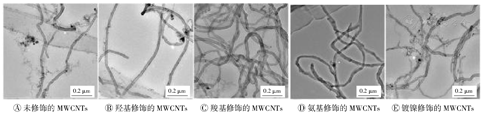

MWCNTs—多壁碳钠米管
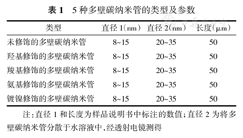
5种多壁碳纳米管的类型及参数
5种多壁碳纳米管的类型及参数
| 类型 | 直径1(nm) | 直径2(nm) | 长度(μm) |
|---|---|---|---|
| 未修饰的多壁碳纳米管 | 8~15 | 20~35 | 50 |
| 羟基修饰的多壁碳纳米管 | 8~15 | 20~35 | 50 |
| 羧基修饰的多壁碳纳米管 | 8~15 | 20~35 | 50 |
| 氨基修饰的多壁碳纳米管 | 8~15 | 20~35 | 50 |
| 镀镍修饰的多壁碳纳米管 | 8~15 | 20~35 | 50 |
注:直径1和长度为样品说明书中标注的数值;直径2为将多壁碳纳米管分散于水溶液中,经透射电镜测得
细胞毒结果如图3显示,在12、24、48和72 h的各时间点,5种MWCNTs处理PBMC的存活率均随浓度升高而下降,其中50μg/ml氨基修饰的MWCNTs处理PBMC 12 h时的细胞存活率较25 μg/ml处理下的存活率低(P<0.05);类似的,50 μg/ml羧基、氨基及镀镍修饰的MWCNTs处理PBMC 72 h时的细胞存活率也分别较25 μg/ml处理下的存活率低,差异均具有统计学意义(P<0.05),表现出一定的剂量-效应关系。在48 h内MWCNTs处理PBMC的存活率随处理时间的延长而逐渐降低,其中与12 h时相比,25 μg/ml的羧基修饰的MWCNTs(P<0.01)、镀镍修饰的MWCNTs (P<0.05)和50 μg/ml的羟基修饰的MWCNTs (P<0.05)处理PBMC 24 h时的细胞存活率均有所降低;与24 h时相比,除镀镍修饰外的其他4种MWCNTs分别以2种质量浓度处理PBMC 48 h时的细胞存活率均降低,差异均具有统计学意义(P<0.05),表现出一定的时间-效应关系。然而,低质量浓度25 μg/ml的4种F-MWCNTs处理PBMC 72 h时的细胞存活率反而较48 h时增加,差异具有统计学意义(P<0.05 ),说明PBMC对MWCNTs有一定的应激反应。
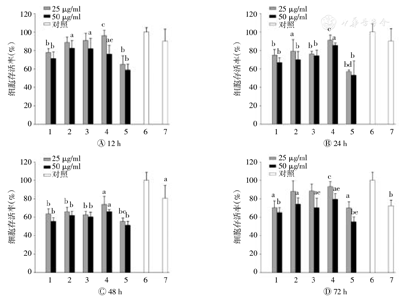

MWCNTs—多壁碳纳米管;PBMC—人外周血单个核细胞;1—未修饰的MWCNTs; 2—羟基修饰的MWCNTs;3—羧基修饰的MWCNTs;4—氨基修饰的MWCNTs; 5—镀镍修饰的MWCNTs; 6—阴性对照组;7—阳性对照组。与阴性对照组比较,aP<0.05 ,bP<0.01;与相同直径和长度的未修饰的MWCNTs比较,cP<0.05 ,dP<0.01;与相同时间下质量浓度为25μg/ml的同种MWCNTs比较,eP<0.05
与P-MWCNTs相比,F-MWCNTs的细胞毒性发生了变化,其中羟基、羧基和氨基修饰的MWCNTs的细胞毒性减小,尤以氨基修饰的细胞毒性减小最为显著(P<0.05);而镀镍修饰的MWCNTs的细胞毒性则明显增大,其处理PBMC 24 h和48 h的细胞存活率较同剂量(25μg/ml)的P-MWCNTs均有所降低,差异均有统计学意义(P<0.01,P<0.05)。各时间点相同质量浓度的羟基、羧基和氨基修饰的MWCNTs细胞毒性间差异并无统计学意义(P>0.05)。
PBMC包括多种免疫细胞类型,CNTs作为药物载体常以静脉注射的方式给药[12],因此,研究CNTs对PBMC的细胞毒性对评价其毒性具有重要意义。本研究结果显示,与P-MWCNTs相比,羟基、羧基和氨基化修饰不仅改善了MWCNTs在水溶液中的分散性,而且减弱了其对PBMC的细胞毒性,尤以氨基修饰的细胞毒性减弱最为显著(P<0.05 );而羟基、羧基和氨基修饰的MWCNTs之间的细胞毒性比较,差异则无统计学意义(P>0.05 )。由此推断P-MWCNTs的细胞毒性较大,可能主要是由于其在水溶液中易于聚集所致。有研究表明修饰可降低CNTs引起的细胞线粒体凋亡,也有研究表明功能化修饰可降低CNTs对DNA的损伤、减少NLRP3炎性体的活性,从而提高其生物相容性[13,14]。
镀镍修饰的MWCNTs广泛应用于葡萄糖传感器的电极,因其具有稳定性好、可重复性强和快速准确等优点,已成为此专业的研究焦点[15]。细胞毒性研究结果表明,镀镍修饰的MWCNTs显著增强了对PBMC的细胞毒性。已有研究表明,金属镍可通过引起损伤DNA、抑制DNA损伤修复酶的活性、产生活性氧导致氧化损伤或阻断细胞周期于G2/M期等引起细胞凋亡或坏死[16]。
综上所述,功能化修饰MWCNTs不仅影响其表面特性,也影响其对PBMC的细胞毒性。因此在对CNTs进行功能化修饰时,除了注重其应用方面的研究,还要考察其相关的毒性问题。
无



























