
观察BGC-823人胃癌细胞株中性别决定相关基因簇2(SOX2)启动子的甲基化状态,探讨SOX2基因去甲基化后对BGC-823细胞的生长和侵袭能力的影响。
通过甲基化特异性PCR法(MSP)检测DNA甲基转移酶抑制剂5-氮杂-2'-脱氧胞嘧啶(5-Aza-CdR)对BGC-823细胞SOX2启动子甲基化状态的影响,实时荧光定量PCR及蛋白印迹法检测经不同浓度5-Aza-CdR作用前后BGC-823细胞中SOX2的表达情况,四甲基偶氮唑盐(MTT)法检测存活率,Transwell小室法和划痕实验检测侵袭及转移能力变化。建立裸鼠BGC-823胃癌移植瘤模型,40只移植瘤小鼠平均分为2组,腹腔分别注射磷酸缓冲液(PBS)、5-Aza-CdR,通过免疫组化、蛋白质印迹法检测5-Aza-CdR的抑瘤效果。
5-Aza-CdR逆转了BGC-823细胞SOX2的甲基化状态,SOX2 mRNA表达恢复,且恢复表达程度与5-Aza-CdR药物浓度呈正比。BGC-823细胞SOX2 mRNA和蛋白的相对表达量低于正常胃黏膜GES-1细胞[(22.80±0.36)和(0.49±0.01)比(20.36±0.45)和(0.91±0.28),均P<0.05],经系列浓度(0、1、10 μmol/L)5-Aza-CdR处理后BGC-823细胞SOX2 mRNA和蛋白的相对表达量相比差异均有统计学意义[(22.99±0.42)和(0.65±0.19)比(21.78±0.41)和(0.73±0.13)比(20.51±0.47)和(0.83±0.14),均P<0.05]。经不同浓度(1、10、20 μmol/L)处理后,BGC-823细胞的增殖速度明显减慢,与浓度为0 μmol/L的对照组比较,各处理组细胞存活率差异有统计学意义(P<0.05),且迁移、侵袭能力减弱(均P<0.05)。裸鼠移植瘤结果显示:5-Aza-CdR组的最终肿瘤体积、最终瘤重较小[(286.6±37.5)mm3和(325.2±32.2)mg比(540.7±42.6)mm3和(694.7±36.1)mg,P<0.05],生存期较长[(22.5±1.0)比(18.7±1.6)d,P<0.05],SOX2蛋白表达量高[(0.96±0.25)比(0.73±0.15),P<0.05],免疫组化评分高[(6.23±0.45)比(3.76±0.43),P<0.05]。
人胃癌BGC-823细胞株SOX2基因启动子处于甲基化状态,通过去甲基化作用能够恢复SOX2基因的表达,降低胃癌细胞的增殖和侵袭能力,抑制裸鼠BGC-823胃癌移植瘤的生长,为胃癌的治疗提供一种新思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是常见的消化道恶性肿瘤之一,目前的常规治疗方法仍然无法达到长期无瘤生存的理想目标。性别决定相关基因簇2(SOX2)是决定胃黏膜上皮分化的重要干细胞转录因子,在胃炎、肠化生至胃癌的变化过程中可见到其异常表达[1,2]。有研究表明,SOX2基因启动子区5'二核苷酸胞嘧啶(5'CpG)岛的甲基化可导致基因启动子功能异常,抑制基因转录,最终导致功能蛋白的下调或缺失,导致胃上皮细胞分化调节紊乱,细胞无限扩增向癌变发展[3,4,5]。5-氮杂-2'-脱氧胞嘧啶(5-Aza-CdR)是一种DNA甲基转移酶(DNMT)抑制剂,具有去甲基化功能,可通过去甲基化作用激活凋亡相关的抑癌基因[6]。本研究检测了人胃癌BGC-823细胞株SOX2基因的甲基化状态和表达水平,利用DNMT抑制剂5-Aza-CdR处理BGC-823细胞,研究去甲基化后SOX2基因表达水平的变化对BGC-823细胞的生长、侵袭能力的影响,从而为胃癌的治疗提供一种新的思路。
Eastep Super Total RNA Extraction Kit、DNA纯化试剂盒(DNA Clean-up System)(Promega,美国);First Strand cDNA Synthesis Kit(GeneCopoeia,美国);SOX2多克隆抗体(Abcam,美国,编号:ab97959)、羊抗兔IgG二抗、抗兔免疫组化染色超敏试剂盒(Cell Signaling,美国),5-Aza-CdR(Sigma,美国),逆转录试剂盒、Taq酶、SYBR Green PCR kit(Fermentas,美国);侵袭性小室(Corning,美国)。
GES-1细胞和胃癌BGC-823细胞株由厦门大学附属第一医院肿瘤中心保存,BALB/C裸鼠40只,4~6周龄,雌性,体重18~20 g,由厦门大学实验动物中心提供。
GES-1和BGC-823细胞株用含10%胎牛血清(FBS)的RPMI1640培养。细胞密度达70%~80%时,实验组BGC-823细胞换含1 μmol/L、10 μmol/L 5-Aza-CdR的培养基,对照组仅加磷酸盐缓冲液(PBS)(0 μmol/L 5-Aza-CdR),培养48 h后用于后续实验。
收集GES-1细胞和5-Aza-CdR处理后的BGC-823细胞,抽提基因组DNA。取2 ng DNA经过重亚硫酸盐、氢醌处理16 h,再经DNA纯化试剂盒回收处理,已纯化的DNA中加入终浓度为0.3 mol/L的NaOH,室温15 min。加入1/10体积3 mol/L乙酸钠及3倍体积无水乙醇沉淀DNA,用20 μl双蒸水溶解,-20 ℃保存备用。以纯化的DNA为模板,分别扩增SOX2启动子区5'CpG岛甲基化和非甲基化的等位基因,SOX2基因DNA启动子甲基化特异性引物设计根据参考文献[5],由广州英竣生物工程有限公司合成。甲基化特异性PCR扩增中甲基化引物(M)序列上游引物:5'AGTCGTCGGGTTCGTAGTAAATTTC 3',下游引物:5' AGT CGTCGGGTTCGTAGTAAATTTC 3',下游引物:5' AAAACATTCATAAACCGCTTAACGCG 3',扩增的目的片段长度为114 bp;非甲基化引物(U)序列上游引物:5' TGAAGTTGTTGGGTTTGTAGTAAATTTTC 3',下游引物:5' ATAAAAACATTCATAAACCAC TTAACACA 3',扩增的目的片段长度为112 bp。结果判断标准:MSP产物电泳时只有非甲基化特异性PCR引物扩增出目的条带,同时甲基化特异性PCR引物未扩增出目的条带,则判断该样品SOX2基因启动子区CpG岛甲基化阴性;MSP产物电泳时甲基化特异性PCR引物扩增出目的条带,无论非甲基化特异性PCR引物是否扩增出目的条带均计为甲基化阳性。以灰度值大小比较目的基因表达的强弱。实验重复3次。
总RNA提取方法同前,加Oligo(dT)引物将抽提的细胞总RNA逆转录成cDNA。qPCR引物设计根据参考文献[5],由广州英竣生物工程有限公司合成。上游引物为5' CTCCGGGACATGATC AGC 3',下游引物5' CTGGGACATGTGAAGTCTGC 3',扩增产物为85 bp。以磷酸甘油醛脱氢酶(GAPDH)作为内部参照,上游引物5' GTGGACCTG ACCTGCCGTCT 3',下游引物5' GGAGGAGTGGGT GTCGCTGT 3',扩增产物为153 bp。
取5-Aza-CdR处理后的细胞,收集样品蛋白,进行浓度测定,按照总蛋白30 μg的量制取蛋白样品,将目的蛋白及内参蛋白β肌动蛋白(β-actin)转至硝酸纤维素膜上,封闭90 min后,一抗4 ℃孵育过夜,用TBS-T洗涤3次,二抗室温孵育90 min,再次洗涤3次,暗室显影后进行灰度值计算。实验重复3次,取均值。
BGC-823细胞制成单细胞悬液,以5×103个细胞/孔接种于96孔板,共接种4板,24 h后实验组分别加入系列浓度5-Aza-CdR(1、10、20 μmol/L),每孔200 μl,对照组加PBS缓冲液,每组设3个复孔,并设空白调零孔(不加细胞,仅含培养液、相同浓度的药物溶解介质、MTT、DMSO)。置于37 ℃、5%CO2的培养箱中培养,分别孵育12、24、48、96 h后在各时间点分别取一板,每孔加MTT液20 μl(5 mg/ml),继续培养4 h后终止培养,弃上清加入150 μl的DMSO,震荡15 min混匀,测定波长490 nm下的吸光度(A490 nm)值,实验重复3次。
6孔板接种约2×105个细胞/孔,细胞覆盖孔底80%以上时,用枪头在孔中划一直线,PBS漂洗3次以去除划下的细胞,加入系列浓度(0、1、10 μmol/L)5-Aza-CdR的培养基,培养48 h后,于倒置光学显微镜下。重复3次,取均值。
经系列浓度(0、1、10 μmol/L)5-Aza-CdR处理后的BGC-823细胞在无血清培养基中饥饿培养24 h后,再用含有1%FBS的RPMI1640培养基重悬细胞,调整密度为2×105个细胞/ml。Transwell小室的下室内加入含10%FBS的RPMI1640培养基,在预先铺好100 μl ECM基质胶的上室中加入BGC-823细胞悬液,每组细胞用3个Transwell小室,培养24 h,刮除上室细胞,0.1%的结晶紫染色,在倒置显微镜下随机选取5个视野计算穿过基底膜的细胞数,照相,取均值。
(1)移植瘤动物模型的建立:制备BGC-823单细胞悬液(1×107个细胞/ml),用一次性注射器在裸鼠右侧背部皮下,每点约注射0.2 ml,待移植瘤长至约100 mm3后开始实验。(2)5-Aza-CdR的治疗效果观察:BGC-823胃癌移植瘤裸鼠40只随机分为2组,每组20只,分别经腹腔注射PBS、5-Aza-CdR(10 μmol/L),给药频率为1次/d,连续注射15 d,给药剂量为2 ml/只。各组分别取10只裸鼠于给药后每天测定1次肿瘤的长和宽,计算肿瘤体积。15 d后用颈椎脱臼法处死,测定肿瘤的长和宽,计算肿瘤体积;完整剥离皮下肿瘤并称重,按以下公式计算抑瘤率:抑瘤率=(1-治疗组瘤重/对照组瘤重)×100%。称完后切除一半新鲜肿瘤组织置于-80 ℃冰箱冻存,用于Western印迹检测SOX2蛋白的表达;另一半肿瘤组织用于免疫组织化学检测。每组剩余的10只裸鼠于给药后记录生存时间。
称取移植瘤组织100 mg,制取蛋白样品,-80 ℃保存备用,余下步骤同前所述,以上实验重复3次,取平均值。
用SOX2阳性的胃组织切片作为阳性对照,用0.01%mol/L的PBS作为阴性对照。结果判定:每张切片至少观察3个以上的高倍视野。抗原染色表达评分方法为综合染色强度和染色细胞数两项指标。染色强度分级评分标准参照之前论文。
应用SPSS 21软件包进行统计分析。符合正态分布的计量资料用 ±s表示。采用独立样本t检验、单因素方差分析和重复测量设计方差分析进行组间比较,组间多重比较采用LSD检验法,以P<0.05为差异有统计学意义。
±s表示。采用独立样本t检验、单因素方差分析和重复测量设计方差分析进行组间比较,组间多重比较采用LSD检验法,以P<0.05为差异有统计学意义。
MSP检测结果显示:BGC-823细胞在甲基化引物反应体系中扩增出目的条带,SOX2基因启动子处于甲基化状态(图1A)。MSP方法仅检测到BGC-823细胞的未甲基化扩增,5-Aza-CdR使BGC-823细胞SOX2基因启动子变成去甲基化状态(图1B)。
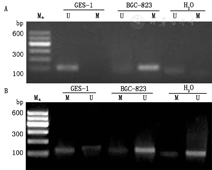

Ma:标准参照物;U:非甲基化;M:甲基化
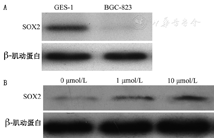
结果显示BGC-823细胞SOX2 mRNA表达量(ΔCt=22.80±0.36)低于GES-1的SOX2 mRNA表达量(ΔCt=20.36±0.45)(t=-7.315,P=0.002);同时SOX2蛋白相对表达量(0.49±0.01)明显少于GES-1细胞(0.91±0.28)(t=24.8,P<0.001,图2A)。经5-Aza-CdR处理后的BGC-823细胞中,10 μmol/L组的SOX2 mRNA表达量(ΔCt=20.51±0.47)高于1 μmol/L组(ΔCt=21.78±0.41)和对照组0 μmol/L组(ΔCt=22.99±0.42)(F=24.60,P<0.001);10 μmol/L组的SOX2蛋白表达量(0.83±0.14)高于1 μmol/L组(0.73±0.13)和对照组0 μmol/L组(0.65±0.19)(F=104.72,P<0.01,图2B)。

在一定浓度下,随着时间的延长,BGC-823细胞的抑制率越高;在时间不变的情况下,不同浓度的5-Aza-CdR对BGC-823细胞生长均有抑制作用,随着5-Aza-CdR浓度的升高,BGC-823细胞的抑制率越高,差异有统计学意义(表1)。

不同浓度5-Aza-CdR和时间对BGC-823细胞的增殖抑制率(%, ±s,n=3)
±s,n=3)
不同浓度5-Aza-CdR和时间对BGC-823细胞的增殖抑制率(%, ±s,n=3)
±s,n=3)
| 药物浓度(μmol/L) | 12 h | 24 h | 48 h | 96 h |
|---|---|---|---|---|
| 0 | 0 | 0 | 0 | 0 |
| 1 | 6.11±1.09 | 11.59±1.15b | 17.52±1.22b | 19.35±0.61b |
| 10 | 47.38±2.67a | 61.71±4.11ab | 68.35±3.61ab | 75.57±3.44ab |
| 20 | 50.23±3.25a | 63.93±2.89ab | 73.03±4.05ab | 79.74±2.88ab |
注:与1 μmol/L组比较,aP<0.05;与12 h组比较,bP<0.05
细胞划痕实验结果如图3所示0、1、10 μmol/L 5-Aza-CdR组相对迁移距离(RMD)分别为:(0.268±0.019)、(0.020±0.008)、(0.010±0.001)mm,与0 μmol/L组比较,1、10 μmol/L组细胞迁移能力显著减弱,差异有统计学意义(F=453.4,P<0.05)。


Transwell细胞侵袭实验结果如图4所示,1 μmol/L组(75.20±6.18)、10 μmol/L组(85.4±8.47)穿过基底膜的BGC-823细胞平均数明显少于对照组0 μmol/L组(188.60±10.90)(F=258.01,P<0.05),表明BGC-823细胞侵袭能力减弱。

待裸鼠移植瘤长至约125 mm3后开始治疗,各组裸鼠给药后15 d内均无死亡。5-Aza-CdR处理组的肿瘤体积小于PBS组(t=10.978,P<0.001)、最终瘤重轻于PBS组(t=18.459,P<0.001),而生存时间长于PBS组(t=4.838,P<0.001),5-Aza-CdR处理组的肿瘤生长抑制率为53.2%(表2)。

5-Aza-CdR治疗裸鼠移植瘤的效果( ±s,n=6)
±s,n=6)
5-Aza-CdR治疗裸鼠移植瘤的效果( ±s,n=6)
±s,n=6)
| 组别 | 肿瘤体积(mm3) | 最终瘤重(mg) | 抑瘤率(%) | 生存期(d) | 中位生存期(d) | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 给药前 | 3 d | 6 d | 9 d | 12 d | 15 d | |||||
| PBS | 126.4±6.3 | 188.4±13.8 | 253.7±29.8 | 328.1±39.3 | 415.3±47.1 | 540.7±42.6 | 694.7±36.1 | 0.0 | 18.7±1.6 | 18.5 |
| 5-Aza-CdR | 128.6±4.6 | 167.0±16.8a | 189.3±20.0a | 214.9±25.2a | 244.5±29.7a | 286.6±37.5a | 325.2±32.2a | 53.2 | 22.5±1.0a | 22.5 |
注:与磷酸盐缓冲液(PBS)组比较,均aP<0.05;肿瘤生长抑制率=(1-处理组瘤重/空白对照组瘤重)×100%,以PBS组为空白对照组,PBS组抑瘤率为0
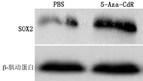

5-Aza-CdR处理组的SOX2蛋白相对表达量(0.96±0.25)大于PBS处理组(0.73±0.15)(t=16.052,P<0.000 1)。
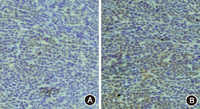
SOX2主要表达于细胞质和细胞膜。PBS处理组移植瘤组织中,SOX2呈弱阳性表达,癌细胞多而密集,5-Aza-CdR处理组移植瘤组织中,SOX2呈强阳性表达,癌细胞少而比较稀疏(图6),5-Aza-CdR处理组移植瘤组织中SOX2表达评分(6.23±0.45)明显高于PBS处理组(3.76±0.43),差异有统计学意义(P<0.05)。

胃癌是一种严重威胁人类健康的恶性肿瘤,其全球死亡率居第2位[7],因此,积极探索胃癌的治疗新方法具有重要意义。有研究发现,干细胞因子SOX2的表达在胃黏膜细胞中的下调或丢失可能是胃癌发生、发展的重要机制之一[8],在分化程度低、浸润程度深、合并淋巴结转移的人胃癌组织标本中,SOX2呈现低表达[9],上述研究结果提示SOX2是一种抑癌基因。
肿瘤的形成是致癌因素通过不同机制和途径激活原癌基因或抑制抑癌基因引起的,抑癌基因的失活机制主要有基因的缺失、突变和基因的甲基化等[10,11,12],DNA甲基化是调控基因表达的表观遗传学的重要机制之一[13],DNA甲基转移酶(DNMT)抑制剂可通过去甲基化作用激活凋亡相关的抑制基因,从而抑制肿瘤细胞增殖,促进肿瘤细胞凋亡[14]。
本实验发现胃癌BGC-823细胞SOX2基因启动子处于甲基化状态并抑制SOX2的表达。通过DNMT抑制剂5-Aza-CdR处理后,BGC-823细胞的SOX2基因未甲基化扩增,同时,BGC-823细胞SOX2表达量相应增加,表明SOX2在胃癌细胞中的低表达与SOX2基因处于甲基化状态有关,与Tomita等[15]的报道结果一致,除了无限增殖外,侵袭是恶性肿瘤另外一个重要的生物学特征,划痕实验和Transwell细胞侵袭实验结果证明,经过5-Aza-CdR处理后,BGC-823细胞的迁移能力显著减弱、细胞穿膜数量明显降低。提示:可以通过改变SOX2基因的甲基化状态使SOX2 mRNA和蛋白得以重新表达,恢复其抑癌基因功能,抑制肿瘤细胞的增殖和侵袭,从而达到治疗肿瘤的目的。进一步的体内试验结果表明DNMT抑制剂5-Aza-CdR通过去甲基化作用使SOX2基因恢复表达,可以抑制BGC-823裸鼠胃癌移植瘤的生长。
本研究结果表明,SOX2基因的甲基化状态是决定胃癌BGC-823细胞增殖和侵袭等生物学特性的重要因素之一,BGC-823细胞SOX2基因启动子处于甲基化状态,抑制了SOX2基因的表达,通过甲基转移酶抑制剂能够激活SOX2基因的重新表达而发挥抑癌功能,抑制肿瘤的生长,为胃癌的治疗提供一种新的方法和思路,但甲基转移酶抑制剂抑制BGC-823裸鼠胃癌移植瘤生长的机制是否存在其他抑癌基因的协同作用,以及SOX2的上游激活途径、下游靶细胞等详细的机制需要进一步探索研究。



























