
初步探讨肺部恶性肿瘤氩氦刀术后多个时间点消融区磁共振成像(MRI)表现及变化趋势,提高对消融区MRI影像学特点及其变化的认识。
2014年7月至2016年1月在河南省肿瘤医院住院并接受氩氦刀治疗共23例(26个病灶)的肺部恶性肿瘤患者纳入本研究。所有患者分别于治疗前、术后1 d,1周,1、3、6和12个月进行胸部MR平扫和动态增强扫描,两名阅片者独立双盲法对图像进行分析,采用5分制评价消融区T1WI和T2WI上信号强度,并采用Kappa检验比较结果的一致性。测量消融区最大径,并分析消融区最大径和信号强度随时间的变化趋势。同时绘制消融区动态增强时间-信号曲线并分类。
术后1 d,26个消融区呈高低混杂信号;术后1周表现为T1WI高(22/26,84.6%)、T2WI高信号(17/26,65.4%)并边缘低信号环(22/26,84.6%);术后1个月17个(65.4%)为T1WI高信号,两名阅片者分别评价22(84.6%)和21(80.8%)为T2WI高信号;术后3个月,大多呈T1WI(18/26,69.2%)及T2WI(19/26,73.1%)等信号,19个消融区(73.1%)呈楔形影;术后6和12个月,消融区大小和信号强度变化不大。术后1 d消融区最大径最大并逐渐缩小,信号强度术后1周最大并逐渐下降至等信号。术后1 d至1个月消融区时间-信号曲线为无明确强化的直线型,术后3~12个月呈轻度延迟强化的流入型。随访周期内22个病灶(84.6%)未见复发,4例复发病灶均发生在术后3个月,且术后1周消融区边缘低信号环不完整。
肺部肿瘤氩氦刀术后MRI表现具有一定的特征性,术后1周消融区边缘低信号环是否完整有助于判断复发,术后1周至3个月是观察消融区发生较大改变的重要时间窗,MRI在识别消融区及动态反映其变化方面具有重要价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺癌是全世界最常见的恶性肿瘤[1],是我国男性患者第1位、女性患者中第2位常见肿瘤[2]。晚期和不具有手术指征(肺功能差、合并其他脏器疾病等)患者常失去手术机会[3]。肺转移瘤属于肿瘤晚期表现,临床治疗手段有限,总体效果不甚理想[4,5]。氩氦刀冷冻消融是新兴的微创治疗,最早应用于治疗前列腺肿瘤和肝癌结节[6,7],2005年开始应用于治疗胸部肿瘤[8],目前氩氦刀已经是治疗无法手术的早期非小细胞肺癌(NSCLC)和单发肺转移瘤安全、有效、可行的治疗方法[9,10,11,12]。不同于手术切除,氩氦刀治疗后肿瘤呈消融后改变,而其疗效需通过长期随访观察,因此术后影像学随访很重要。磁共振(MR)具有多方位、多参数成像和无辐射等优势,而双门控等技术克服了以往的胸部伪影大(呼吸、心脏大血管搏动)的问题,极大地提高了MR在胸部的应用。目前仅有3D-MR引导下肺癌氩氦刀手术的报道[13],但利用MR长期观察消融区变化尚未见到,临床上术后消融区MRI特点和变化认识不足甚至缺失。本研究旨在对肺部肿瘤氩氦刀治疗前、术后1 d、1周、1、3、6和12个月行MR扫描,来判断并动态观察消融区表现及变化趋势,总结有用征象并为临床制定复查计划提供依据。
肺一侧叶单发病灶,患者能耐受氩氦刀治疗,能顺利完成MR扫描计划,图像清晰能满足阅片需要。
患者不配合,无法完成MR扫描计划;图像质量较差;肝肾等重要脏器功能衰竭,术后随访期间肿瘤复发,覆盖消融区大部分(>50%)或全部导致无法继续评价。本院医学伦理委员会讨论同意本研究的进行(81372370),并获得患者知情同意书。
前瞻性收集2014年7月至2016年1月在河南省肿瘤医院介入科住院并接受氩氦刀治疗肺部肿瘤患者的MRI资料。符合入组标准共23例患者、26个病灶,均经病理证实。肺癌11例,包括4例鳞癌和7例腺癌;12例不同来源转移瘤共15个病灶,肝细胞癌4例(6个),肺癌2例,贲门癌3例,乳腺癌2例(3个),直肠癌1例。病灶左肺12个,右肺14个;上叶14个,下叶12个。男14例、女9例,年龄范围25~78岁,中位数年龄57岁。病灶最大径8~51 mm,平均(24±10) mm。所有患者均成功实施氩氦刀治疗,术后3个月4个病灶复发(<50%消融区),术后6个月病灶增大(>50%消融区)而剔除,22例未见复发,未发生针道种植转移。
氩氦刀冷冻治疗(Ar-He cryosurgery)设备为以色列GML公司的CryoHit型,探针直径1.47 mm,GE公司大孔径CT机。依据影像资料明确靶区并设计三维治疗计划,要求冰球>病灶边缘1 cm,单次治疗冷冻范围达病灶80%以上为显效。采用17 G冷冻针,布针时两针间隔2 cm,进针数目依据肿瘤大小而定。单次治疗需2个冻融循环,包括10 min氩气冷冻和2 min氦气复温过程。如肿瘤较大时可采用退刀冷冻或分次冷冻。治疗全过程监测患者生命体征。
患者分别于术前及术后1 d、1周、1、3、6和12个月分别行胸部MR平扫和动态增强扫描。采用3.0 T MR扫描仪(Signa HDx,GE Healthcare,Waukesha,WI,美国),使用TORSO线圈。患者仰卧位,足先进。轴位序列扫描范围从肺尖到膈顶。检查序列包括:(1)屏气三维扰相梯度回波(breath-hold three-dimensional spoiled gradient recalled,BH 3D-SPGR)轴位T1WI序列:TR 195 ms,TE 3 ms,层厚4 mm,层间隔0.4 mm,激励次数(NEX)=0.75,视野(FOV)40 cm×40 cm,矩阵280×192;(2)快速自旋回波(fast spin-echo,FSE)的WATER Oax T2 Ideal脂肪抑制T2WI序列:TR 8 600 ms,TE 86 ms,层厚4 mm,层间隔0.4 mm,NEX=2,FOV 40 cm×40 cm,矩阵288×224;(3)轴位动态增强扫描(DCE):屏气T1WI肝脏容积快速采集(liver acquisition with volume acceleration,LAVA)扫描序列,TR 2.6 ms,TE 1.2 ms,反转角12°,矩阵170×272,实际层厚4 mm,层间隔2mm,FOV 40 cm×40 cm;采用高压注射器经肘静脉以2.5 ml/s流率注射对比剂Gd-DTPA(德国拜尔,马根维显,规格469.01 mg/ml×15 ml)共0.1 mmol/kg,之后以同样流率注射20 ml生理盐水,注入对比剂前先扫描一次获得蒙片,注入对比剂后12和50 s分别连续无间隔扫描2期,90和150 s分别再扫描1期,加上蒙片共获得8期动态增强图像,每次扫描时间为7~8 s,因患者体型不同,单次扫描可获得44或48层图像。
采用SPSS 21.0软件,通过Kappa值检验阅片者一致性,Kappa值0.20~0.40为一致性差,0.41~0.60为一致性中等,0.61~0.80为一致性好,>0.80为一致性非常好。绘制时间-参数曲线图来显示消融区大小和信号强度的变化趋势。
两名阅片者T1WI和T2WI评分一致性检验的Kappa值为0.872、0.856,一致性非常好。根据评分情况(表1),术后1 d,16个消融区(61.5%)呈T1WI等信号、19或20个(73.1%,76.9%)呈T2WI稍高信号(图1A,图1B)。术后1周,22个(84.6%)呈T1WI高信号,17个(65.4%)呈T2WI高信号,22个(84.6%)边缘有完整低信号环(图1D,图1E)。术后1个月,17个(65.4%)为T1WI高信号(图1G),两名阅片者分别评价22(84.6%)和21(80.8%)个为T2WI高信号(图1H)。术后3~12个月,消融区呈T1WI及T2WI等信号改变。术后1 d,26个消融区均混杂信号,随时间延长信号逐渐变均匀。术后1周信号强度最高,而后逐渐下降,术后3~12个月呈等信号(表2)。
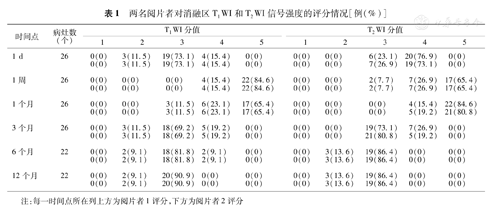
两名阅片者对消融区T1WI和T2WI信号强度的评分情况[例(%)]
两名阅片者对消融区T1WI和T2WI信号强度的评分情况[例(%)]
| 时间点 | 病灶数(个) | T1WI分值 | T2WI分值 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 1 | 2 | 3 | 4 | 5 | ||
| 1 d | 26 | 0(0) 0(0) | 3(11.5) 3(11.5) | 19(73.1) 19(73.1) | 4(15.4) 4(15.4) | 0(0) 0(0) | 0(0) 0(0) | 0(0) 0(0) | 6(23.1) 7(26.9) | 20(76.9) 19(73.1) | 0(0) 0(0) |
| 1周 | 26 | 0(0) 0(0) | 0(0) 0(0) | 0(0) 0(0) | 4(15.4) 4(15.4) | 22(84.6) 22(84.6) | 0(0) 0(0) | 0(0) 0(0) | 2(7.7) 2(7.7) | 7(26.9) 7(26.9) | 17(65.4) 17(65.4) |
| 1个月 | 26 | 0(0) 0(0) | 0(0) 0(0) | 3(11.5) 3(11.5) | 6(23.1) 6(23.1) | 17(65.4) 17(65.4) | 0(0) 0(0) | 0(0) 0(0) | 0(0) 0(0) | 4(15.4) 5(19.2) | 22(84.6) 21(80.8) |
| 3个月 | 26 | 0(0) 0(0) | 3(11.5) 3(11.5) | 18(69.2) 18(69.2) | 5(19.2) 5(19.2) | 0(0) 0(0) | 0(0) 0(0) | 0(0) 0(0) | 19(73.1) 21(80.8) | 7(26.9) 5(19.2) | 0(0) 0(0) |
| 6个月 | 22 | 0(0) 0(0) | 2(9.1) 2(9.1) | 18(81.8) 18(81.8) | 2(9.1) 2(9.1) | 0(0) 0(0) | 0(0) 0(0) | 3(13.6) 3(13.6) | 19(86.4) 19(86.4) | 0(0) 0(0) | 0(0) 0(0) |
| 12个月 | 22 | 0(0) 0(0) | 2(9.1) 2(9.1) | 20(90.9) 20(90.9) | 0(0) 0(0) | 0(0) 0(0) | 0(0) 0(0) | 3(13.6) 3(13.6) | 19(86.4) 19(86.4) | 0(0) 0(0) | 0(0) 0(0) |
注:每一时间点所在列上方为阅片者1评分,下方为阅片者2评分3.图像分析及评价:由两名5年以上MR诊断工作经验的医师独立盲法分别对术后MR图像进行分析,观察术后消融区大小、信号强度和时间-信号曲线变化趋势。采用5分制对信号强度进行评分,评分标准:T1WI上,肺实质为1分,肌肉为3分,脂肪为5分,低于肌肉为2分,介于肌肉和脂肪间为4分。压脂T2WI上,肺实质为1分,肌肉为3分,水为5分,介于肺和肌肉间为2分,介于肌肉和水间为4分。如消融区信号混杂,以较多范围的信号进行评价。第3名医师独立测量消融区最大径,绘制时间-信号曲线图并进行分类。所有征象以两名阅片者同时认定为准,如果两人意见不一致,由一名高资历医师进一步确定。
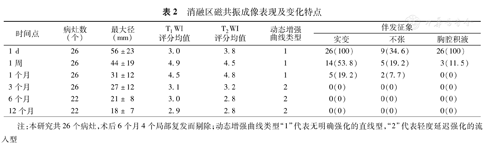
消融区磁共振成像表现及变化特点
消融区磁共振成像表现及变化特点
| 时间点 | 病灶数(个) | 最大径(mm) | T1WI评分均值 | T2WI评分均值 | 动态增强曲线类型 | 伴发征象 | ||
|---|---|---|---|---|---|---|---|---|
| 实变 | 不张 | 胸腔积液 | ||||||
| 1 d | 26 | 56±23 | 3.0 | 3.8 | 1 | 26(100) | 9(34.6) | 26(100) |
| 1周 | 26 | 44±19 | 4.9 | 4.5 | 1 | 14(53.8) | 5(19.2) | 3(11.5) |
| 1个月 | 26 | 31±12 | 4.5 | 4.8 | 1 | 5(19.2) | 2(7.7) | 0(0) |
| 3个月 | 26 | 27±12 | 3.1 | 3.2 | 2 | 0(0) | 0(0) | 0(0) |
| 6个月 | 22 | 21± 8 | 3.0 | 2.8 | 2 | 0(0) | 0(0) | 0(0) |
| 12个月 | 22 | 18± 7 | 2.9 | 2.8 | 2 | 0(0) | 0(0) | 0(0) |
注:本研究共26个病灶,术后6个月4个局部复发而剔除;动态增强曲线类型"1"代表无明确强化的直线型,"2"代表轻度延迟强化的流入型
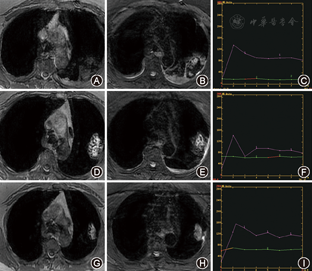

术后1 d消融区最大径为(56±23) mm,而后逐渐缩小。术后1 d~1个月,消融区未见明确强化,时间-信号曲线呈直线型(图1,表2),术后3~12个月,呈轻度延迟强化的"流入型"(图2,表2)。术后3个月,19个(73.1%)呈楔形,7个(26.9%)呈类圆形(图2A,图2B)。
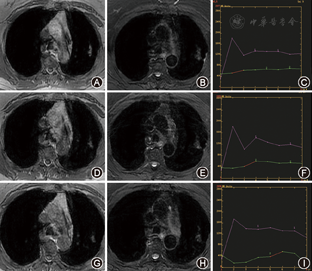

术后1年随访,复发者共4个,均在术后3个月,且术后1周边缘低信号环不完整,复发部位不在进针路径,位于环缺失处。
氩氦刀术后消融区信号改变和病理生理改变密切相关。氩氦刀术后1 d消融区冰球形成并肺组织损伤、出血,本研究术后1 d MRI消融区信号混杂,并周围实变和炎症,提示局部肺组织损伤[14,15]。术后1周消融区发生凝固性坏死[16,17],消融区周围炎症减少,提示周围轻度冻伤肺组织修复[18]。术后1个月,消融区T2WI上信号增高,代表了消融区修复[14],肝脏射频消融的动物实验研究[7,17]也有相同发现。术后1周22个消融区边缘出现完整的低信号环,可能是消融区边缘损伤肺组织肺泡气体潴留所致,也有文献[14,15]认为与冰球内部温度有差别有关。术后1周低信号环完整的22个病灶均未复发,而4个复发病灶环均不完整,位置就发生在环缺口处。因此,术后1周消融区边缘是否存在完整的低信号环有助于判断复发。
本研究大部分消融区(22/26)在术后3个月内逐渐缩小,术后3个月以后变化不明显。术后3~12个月,消融区轻度延迟强化,而Chaudhry等[18]的研究显示术后1个月CT增强上边缘轻度强化,与本研究不一致,CT扫描依据CT值测量,而本研究MR扫描采用时间-信号曲线直观表达。也与ROI位置的选择有关系,CT上病灶边缘强化也可能是周围炎症的强化。
本组共4个(15.4%)复发病灶,低于文献报道[12,13,19],可能与本研究样本量少和病灶体积较小有关,本组19个结节(82.6%)最大径<30 mm,还可能与所含病灶病理类型及随访周期有关。
本研究为初步性研究,存在不足之处:样本量少,所含病理类型较多,未能按照病理类型进一步分类、分析。因患者接受度和伦理限制,缺乏直接的活体消融区病理证据。另外,在患者同意并耐受情况下,利用MR随访的时间可以适当延长。
总之,利用MR随访能直观、动态观察肺部肿瘤氩氦刀术后消融区表现和变化趋势,术后1 d消融区最大并逐渐缩小,T1WI及T2WI信号在术后1周最高并逐渐下降,信号由混杂变得均匀。术后1周边缘有完整低信号环者均未复发,复发均发生在术后3个月,术后1周至3个月是观察消融区变化的重要时期,可作为复查时间窗。



























