
研究儿童急性淋巴细胞白血病(ALL)细胞遗传学改变和预后的关系。
采用反转录聚合酶链反应(RT-PCR)法检测103例儿童ALL患者常见的融合基因、染色体数和结构,分析染色体和融合基因的变化对治疗反应及生存时间的影响。
103例患儿中,52例染色体数正常,未检出融合基因。51例检出融合基因,其中TEL-AML1阳性22例,bcr-abl阳性10例,E2A-PBX1阳性11例,MLL-AF4阳性2例,HOX11阳性3例,SIL-TAL1 1例,dupMLL 1例,TLS-ERG 1例。bcr-abl组平均生存时间短于未检出异常基因组、TEL-AML1组、E2A-PBX1组,差异均有统计学意义[(16.5±3.8)个月比(34.6±1.7)个月、(31.6±1.4)个月、(34.5±3.3)个月,均P<0.05],与其他异常基因组[(12.8±1.5)个月]差异无统计学意义(P>0.05)。未检出异常基因组平均生存时间与TEL-AML1组及E2A-PBX1组比较,差异均无统计学意义(均P>0.05),与其他异常基因组间差异有统计学意义(P<0.05)。染色体数异常18例,其中亚二倍体4例,超二倍体14例。亚二倍体患儿平均生存时间短于超二倍体患儿[(19.8±4.8)个月比(37.5±2.2)个月,χ2=7.375,P=0.007],易复发。初诊时不同白细胞计数和乳酸脱氢酶水平的患儿平均生存时间差异有统计学意义(均P<0.05)。
融合基因及染色体数等细胞遗传学指标的检测可用于判断儿童ALL的预后和转归,对实现个体化治疗有重要指导意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性白血病是世界范围内儿童和青少年常见的具有高度异质性的恶性肿瘤,在儿童中的发病率高达5/10万,其中75%以上是急性淋巴细胞白血病(ALL)。临床研究发现儿童白血病伴有再现性遗传学异常,在提示白血病生物学特征和预后方面比形态学异常更可靠,在儿童ALL的发生和发展中发挥重要作用。常见的细胞遗传学异常有染色体数目改变、染色体易位及融合基因异常表达。这些异常的细胞遗传学表达能为儿童白血病的临床治疗提供一些新靶点,研究这些表达的规律也对评价临床治疗效果和预后有重要意义。
收集2012年1月至2015年6月我院住院的ALL患儿103例,其中男性57例,女性46例,中位年龄6岁。小于1岁1例,1~10岁96例,大于10岁6例。T-ALL 4例,B-ALL 99例。所有诊断符合中华医学会儿童ALL诊断标准,患者危险度分组标准采用儿童ALL诊疗建议(第三次修订草案)[1],并按照此方案进行治疗,化疗前均征得患儿家属知情同意并签署化疗知情同意书。
骨髓和外周血涂片采用瑞特染色法分类计数,并通过化学染色进行诊断。
采用流式细胞仪,用特异性CD抗原标记肿瘤细胞,用CD45/ssc设门分析细胞,在化疗前、缓解后定点进行微小残留病变(MRD)的检测。单抗及流式细胞仪(型号:CANTO Ⅱ)均为美国BD公司产品。
对初治ALL患儿骨髓标本采用反转录聚合酶链反应(RT-PCR)定量检测融合基因,并在化疗不同阶段和停药后定点观察、随访融合基因变化。染色体核型分析采用直接法,用24 h培养法和同步法制备染色体,采用R或G显带技术,根据《人类细胞遗传学国际命名体制(1995)》描述核型。
参照美国Invitrogen公司TRIzol说明书提取细胞总RNA。严格防止RNA酶降解RNA,冻存细胞不需解冻,先加1 ml TRIzol于1×107细胞中,吹打裂解后室温静置5~10 min。加入0.2 ml氯仿,剧烈振荡15 s,室温静置2~3 min。4 ℃ 12 000×g离心15 min。小心吸出上清水相约500 μl,移入另一离心管,加入500 μl异丙醇,颠倒混匀,室温静置10 min(RNA沉到底部)。4 ℃ 12 000×g离心10 min,倒去上清液,底部可见针尖大小白色物质(RNA)。加入1 ml 70%乙醇旋转洗涤,清洗异丙醇。4 ℃ 7 500×g离心5 min,去除乙醇,尽量用枪头吸干净,室温干燥沉淀2~5 min(不可以离心或加热干燥,否则RNA会很难溶解),加入适量的RNase-free H2O溶解沉淀,必要时可以用移液枪轻轻吹打沉淀。提取的RNA立即进行反转录,确保RNA不降解,剩余的RNA标记好放入-80 ℃冰箱保存。
在Microtube管中加入dNTP Mixture(各自浓度均为10 mmol/L) 1 μl、特异cDNA引物(2.5 μmol/L)1 μl、总RNA 5 μl,加RNase-free dH2O至10 μl。在PCR仪上进行变性、退火反应:65 ℃ 5 min,4 ℃保持。离心数秒使模板RNA、引物等的混合液聚集于Microtube管底。在上述Microtube管中配制反转录反应液:上述变性、退火后的反应液10 μl,5×Prime Buffer 4 μl,TaKaRa RNA酶抑制剂0.5 μl,PrimeScript Rtase(for 2 Step)0.5 μl,RNase-free dH2O 5 μl,总体积20 μl。在PCR仪上按下列条件进行反转录反应:40 ℃ 30 min,95 ℃ 5 min,4 ℃保持。若不立即进行试验,则将cDNA于-20 ℃保存。
采用多重巢式PCR扩增基因。第一轮PCR扩增,根据美国国家生物技术信息中心(NCBI)公布的相应基因序列进行引物设计,在Microtube管中配制PCR反应液,在PCR仪上按下列条件进行反应:95 ℃ 10 min;95℃ 30 s,58 ℃ 45 s,72℃ 60 s,25个循环;72 ℃ 10 min,4 ℃保温。根据NCBI公布的相应基因序列进行引物设计,与第一轮条件相同进行第二轮PCR扩增。
PCR产物电泳检测:取PCR产物8 μl,加2 μl上样缓冲液,用2%的琼脂糖凝胶电泳,内参条带清晰,位置正确。儿童ALL融合基因系列检测项目包括MLL-AFX、MLL-AF4、MLL-AF1P、MLL-AF6、MLL-ENL、dupMLL、E2A-PBX1、E2A-HLF、SIL-TAL1、TL-ERG、HOX11、bcr-abl(p210)、bcr-abl(p190)、TEL-AML1、TEL-AB。本试验设内参照及阴性对照。
取48 h内采集的新鲜骨髓进行白细胞计数,按200×109/L进行接种,轻摇均匀,置37 ℃恒温箱培养24 h。在培养液中加入10 μg/L秋水仙碱80 μl,轻摇均匀后置37 ℃恒温箱继续培养30 min。
染色体制备:将培养物完全转入清洁的离心管中,离心半径17 cm,1 500 r/min离心5 min,弃上清液。在离心管中加入预温的37 ℃低渗液8 ml,用滴管混匀,置37 ℃恒温水浴中低渗处理30 min;加入1 ml固定液,轻轻混匀,离心半径17 cm,1 500 r/min离心5 min;弃上清,加入8 ml固定液,轻轻混匀,在室温下静置30 min,离心半径17 cm,1 500 r/min离心5 min,弃上清。第二次固定完成后,每个离心管中加入1 ml固定液,混匀,细胞悬液保存在4 ℃冰箱。将细胞悬液再固定一次,离心半径17 cm,1 500 r/min离心5 min,弃上清液。使用自动滴片仪滴片,滴片完成后将玻片放于70 ℃烤箱内烘烤4 h。每张玻片胰酶消化6~8 s,然后将涮洗后的玻片染色2.5 min,在低倍显微镜下观察颜色,紫红色为标准,颜色合适后在水龙头下冲洗玻片,显微镜下分析。
患者按序化疗至停药,随访时间为2012年1月至2015年6月。
采用SPSS 13.0软件对数据进行统计学分析,计量资料以均数±标准差( ±s)表示,生存分析采用Kalpan-Meier法,进行Log-rank检验。以P<0.05为差异有统计学意义。
±s)表示,生存分析采用Kalpan-Meier法,进行Log-rank检验。以P<0.05为差异有统计学意义。
103例ALL患儿中,染色体数正常及未检出融合基因52例,融合基因阳性51例。其中TEL-AML1阳性22例(男性14例,女性8例),bcr-abl阳性10例(男性7例,女性3例),E2A-PBX1阳性11例(男性7例,女性4例),MLL-AF4阳性2例(均为女性),HOX11阳性3例(男性2例,女性1例),SIL-TAL1 1例(女性),dupMLL 1例(男性),TLS-ERG 1例(男性)。bcr-abl组平均生存时间短于未检出异常基因组、TEL-AML1组、E2A-PBX1组,差异均有统计学意义(均P<0.05),与其他基因异常组差异无统计学意义(P>0.05)。未检出异常基因组平均生存时间与TEL-AML1组及E2A-PBX1组比较,差异均无统计学意义(均P>0.05),与其他异常基因组差异有统计学意义(P<0.05)(表1)。
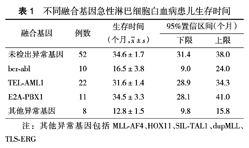
不同融合基因急性淋巴细胞白血病患儿生存时间
不同融合基因急性淋巴细胞白血病患儿生存时间
| 融合基因 | 例数 | 生存时间(个月, ±s) ±s) | 95%置信区间(个月) | |
|---|---|---|---|---|
| 下限 | 上限 | |||
| 未检出异常基因 | 52 | 34.6±1.7 | 31.4 | 38.0 |
| bcr-abl | 10 | 16.5±3.8 | 9.0 | 24.0 |
| TEL-AML1 | 22 | 31.6±1.4 | 28.9 | 34.3 |
| E2A-PBX1 | 11 | 34.5±3.3 | 28.1 | 41.0 |
| 其他异常基因 | 8 | 12.8±1.5 | 9.8 | 15.8 |
注:其他异常基因包括MLL-AF4、HOX11、SIL-TAL1、dupMLL、TLS-ERG
染色体数异常18例,其中亚二倍体4例(男性3例,女性1例),超二倍体14例(男性9例,女性5例)。两者比较,亚二倍体患儿平均生存时间短[(19.8±4.8)个月(95% CI 10.3~29.2个月)比(37.5±2.2)个月(95% CI 33.3~41.7个月),χ2=7.375,P=0.007],易复发。
初诊时白细胞计数≥50×109/L的患儿(19例)平均生存时间短于白细胞计数<50×109/L的患儿(84例),差异有统计学意义[(25.4±3.4)个月(95% CI 18.7~32.1个月)比(36.6±1.7)个月(95% CI 33.3~39.8个月),χ2=4.022,P=0.045]。初诊时LDH≥1 000 U/L患儿的平均生存时间短于LDH<1 000 U/L的患儿,差异有统计学意义[(23.7±1.9)个月(95%CI 19.8~27.5个月)比(34.3±5.6)个月(95% CI 23.2~45.3个月),χ2=7.188,P=0.006]。
当前对儿童ALL的研究不断深入,染色体核型异常和相关融合基因表达已经成为其重要的独立预后因素,其不同分子生物学、遗传学特征也成为监测复发、评价预后、观察病情变化的标志物[2,3]。我们通过对ALL诊治和随访观察,发现这些重要的细胞遗传学特征对临床有重要的指导意义。
t(12;21)及TEL-AML1阳性在ALL中发生率较高,是儿童ALL中最常见的染色体易位,目前针对ALL t(12;21)、TEL-AML1实际的含义仍然存在争议[4]。大多数研究认为t(12;21)、TEL-AML1阳性儿童预后较好。Loh等[5]研究指出TEL-AML1阳性儿童ALL的5年无事件生存率和总生存率分别为89%和97%,高于TEL-AML阴性儿童ALL(80%和89%)。但也有研究发现t(12;21)及TEL-AML1阳性儿童ALL的预后并不比其他儿童ALL好[6]。这可能与儿童ALL存在多种分子学、细胞遗传学异常及治疗方案、治疗强度的不同有关[7]。因此以TEL-AML1融合基因为标志物,在特定的治疗时间点进行定量检测,对评估这些阳性患儿的治疗反应和预后、预防复发有重要意义[8]。
儿童ALL中有不足10%的患儿存在t(1;19)(q23;p13),该易位形成E2A-PBX1融合基因[9]。该易位也是儿童ALL中较为常见的基因重排,是排在TEL-AML1阳性之后的发生率第二高的融合基因。本研究中E2A-PBX1阳性患儿11例。
HOX11位于10q24,是homeobox家族成员之一,在T-ALL、B-ALL及急性髓系白血病(AML)中均有表达[10]。其突变和异常表达都将引起机体分化发育缺陷。研究显示HOX11可能通过甲基化修饰的方式影响白血病基因的表达[11],而这些基因表达的改变可能影响肿瘤细胞对化疗药物的敏感性,进而影响白血病的预后。甚至有研究认为其易导致中枢神经系统白血病(CNSL)的发生。本研究中HOX11阳性2例,按照危险度评分均为中危,均接受了个体化大剂量甲氨蝶呤庇护所治疗以预防CNSL。
MLL基因涉及11q23重排,主要见于婴幼儿白血病。分子水平的研究揭示此异常导致位于11q23的混合谱系白血病基因发生重排,现已发现11q23基因重排所涉及的伙伴基因已达60种以上,按危险度分组为高危[12]。由于病例有限,本研究把HOX11和MLL等基因归为其他异常基因组,2例MLL-AF4阳性患儿分别于化疗1.5年和8个月复发,放弃治疗。
bcr-abl基因阳性率在儿童ALL中为5%~15%,在危险度评分中列为单项指标高危,提示预后极差。此融合基因最早在慢性粒细胞白血病(CML)中被发现,由位于9q34的c-abl原癌基因与位于22q11的bcr基因发生融合形成[13]。本组10例bcr-abl阳性患儿生存时间比其余各组均短,与此类患者具有易复发、生存率低的特点一致[14]。对于bcr-abl基因阳性患者应尽早行异基因造血干细胞移植治疗。
本组病例中部分患儿出现染色体数目的异常,比较发现,亚二倍体患儿生存时间短、易复发,与文献[15]结论相符。另外本研究还发现初诊时白细胞计数和LDH对预后有影响。LDH作为反映肿瘤负荷的指标已被广泛接受,而确诊时肿瘤细胞负荷对生存和复发的影响值得关注。初诊时白细胞计数和LDH对预后的影响还有待长期观察。
总之,不同类型的ALL患儿染色体畸变形成的融合基因不同,导致临床表现、免疫分型、对治疗的反应及预后均不尽相同,体现了白血病的异质性。检测融合基因的变化并根据其特点对患者进行个体化治疗越来越重要,也表明遗传学异常在ALL的发病机制中起着重要的作用。
无



























