
分析44例急性播散性脑脊髓炎(ADEM)患者的临床特征。
收集2009年8月至2014年7月在中山大学附属第三医院诊断为ADEM患者的临床资料,并进行回顾性分析。
44例ADEM纳入分析:男23例,女21例;儿童期发病9例,少年期11例,成人期24例。临床病程分为单相型(23/44,52%)或多时相型(21/44,48%)。14例(31.8%)发病前2周内有明确诱因;最常见临床症状包括发热(20/44,45%)、精神症状(18/44,41%)、意识障碍(17/44,39%)、抽搐(12/44,27%);首次发病EDSS评分(4.3±1.3)分,mRS评分(2.7±0.9)分。10例出现单一或多种自身免疫抗体指标异常。44例中血清NMO-IgG阳性2例,脑脊液寡克隆区带阳性3例。头颅MRI最常见表现为散在型(18/44,41%)、基底节型(12/44,27%)、巨块型(10/44,23%),满天星型(3/44,7%)及出血型(1/44,2%)相对少见。糖皮质激素(40/44,90.9%)和丙种球蛋白(13/44,29.5%)是首次发病的常用治疗药物。29例(65.9%)完成了规律随访,随访时间(4.2±2.3)年,其中单时相型10例,多时相型19例;多时相型患者首次复发时间(2.5±2.3)年,总复发次数(3.3±1.4)次;最后一次复发平均EDSS评分(3.9±2.2)分,mRS评分(2.2±1.3)分。MRI随访时间(5.3±1.9)年,其中18例(62.1%)部分缓解,6例(20.7%)病灶持续存在,5例(17.2%)出现新发病灶。19例多时相型患者中13例规律治疗,激素(13/13,100.0%)和丙种球蛋白(7/13,53.8%)仍是复发急性期的主要药物。缓解期,多时相型患者多选择小剂量激素口服治疗预防复发(12/13,92.3%),并联合使用免疫抑制剂如硫唑嘌呤、他克莫司、环孢素、利妥昔单抗。
ADEM成人起病并非少见,可以为多时相病程,全脑症状明显,MRI表现常见为散在型及基底节型,随访后部分缓解。由于ADEM临床表现多样,并可转化为MS及NMO,因此ADEM可能作为一组"临床综合征"而非独立疾病实体。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性播散性脑脊髓炎(acute disseminated ence-phalomyelitis,ADEM)是一种急性起病、临床表现多样的中枢神经系统炎性脱髓鞘疾病。以往国外文献报道,ADEM通常发生在感染或疫苗接种后,儿童期起病多见。因ADEM患病率及发病率低(年发病率<0.31/10万)[1],国内外临床研究报道少,因此大样本中国人ADEM的临床特征研究有重要意义。
回顾性分析2009年8月至2014年7月在中山大学附属第三医院明确诊断为ADEM的患者。因文献报道儿童和成人ADEM临床表现相似[2],本研究中儿童及成人患者均参考2012年儿童ADEM诊断标准[3]。ADEM分为单时相ADEM和多时相ADEM(mADEM)两种病程,mADEM定义为间隔3个月的两次ADEM发作,第二次发作可以为新事件或既往相同神经系统症状和MRI表现[3]。
纳入患者均已排除继发性脱髓鞘(如感染、中毒、血管疾病等)和肿瘤等。患者在我院脱髓鞘疾病专科门诊随访,评估患者临床特点、实验室及影像学检查、治疗及转归等。
通过本院PACS(picture archiving and communication systems)系统收集患者急性期头颅MRI资料,分析病灶解剖学分布、形态以及强化特征等。此外,对大脑深部灰质核团(丘脑及基底节区)病灶进行重点评估;并对脊髓MRI特征以及部分患者头颅MRI随访资料进行对比。
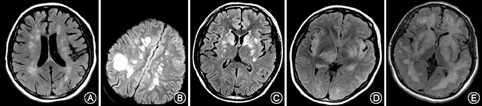
国内外ADEM颅内病灶没有统一分类标准,综合国外文献报道[4,5],主要存在五种表现(图1):(1)散在型:小病灶(<5 mm)散在分布于大脑半球;(2)巨大型:大病灶、融合或瘤样病灶,伴病灶周围水肿和占位效应;(3)基底节型:仅累及双侧基底节区、对称性分布;(4)出血型:在急性脱髓鞘病灶中有出血表现;(5)满天星型:病灶广泛分布,主要局限于白质,呈环状强化。

应用SPSS 13.0进行统计学分析。数据符合正态分布采用 ±s描述,非正态分布数据用中位数(最小值,最大值)描述。ANOVA方差分析用于多组间比较。以P<0.05为差异有统计学意义。
±s描述,非正态分布数据用中位数(最小值,最大值)描述。ANOVA方差分析用于多组间比较。以P<0.05为差异有统计学意义。
44例患者纳入统计分析,男23例(52%),女21例(48%);首次发病年龄(25±16)岁:其中儿童期(≤10岁)9例(20%),少年期(11~18岁)11例(25%),成人期(≥19岁)24例(55%)。患者病程(5.4±1.7)年。
所有患者进行随访,单时相型23例(52%),多时相型21例(48%)。4例多时相型患者(9%)表现为原有临床症状复发,17例(39%)出现新发临床症状和MRI病灶。
对发病诱因进行分析,14例(36%)发病前2周内有明确诱因,包括感染(9/44, 20%)、药物(1/44, 2%)和其他诱因(4/44,9%)。另有2例确诊NMO患者(5%),在病程中诊断ADEM。
44例患者中,20例(45%)首次病程出现发热,18例(41%)精神症状,17例(39%)意识障碍,13例(30%)头痛伴呕吐,12例(27%)抽搐发作;38例(86%)存在局灶性体征,5例(11%)出现共济失调。首次发病EDSS评分(4.3±1.3)分,mRS评分(2.7±0.9)分。
患者常规行自身免疫抗体[包括甲状腺抗体、抗核抗体、抗可溶性抗原(ENA)、抗中性粒细胞胞质抗体(ANCA)]筛查。10例患者出现单一或多种自身免疫抗体指标异常:4例出现甲状腺抗体异常(aTPO/aTG升高),4例抗核抗体阳性,另外抗RA3、SSB、Aβ2GP阳性各1例。
脑脊液检查提示白细胞总数升高(>10×106/L)21例(47.7%),平均白细胞数量(21±5)×106/L,淋巴细胞升高为主;蛋白升高(>0.45 g/L)11例(25%),平均浓度(0.34±0.30) g/L;糖(3.5±0.8) mmol/L;氯化物(124±5) mmol/L。
44例患者均进行NMO-IgG和脑脊液寡克隆区带检测,其中NMO-IgG阳性2例,阴性42例;寡克隆区带阳性3例,阴性41例。
44例患者中,头颅MRI表现为散在型18例(41%),巨大型10例(23%),基底节型12例(27%),出血型1例(2%),满天星型3例(7%)。33例(75%)出现丘脑及基底节区病灶。22例(50%)存在增强病灶,其中片状强化3例(7%),结节状强化14例(32%),线样强化5例(11%)。29例行脊髓MRI检查,其中14例(48%)存在脊髓病灶。
各亚组患者头颅MRI分型见表1。对不同性别(P=0.772)、年龄(P=0.257)和病程(P=0.300)患者分为亚组比较,各亚组患者头颅MRI分型情况差异无统计学意义。
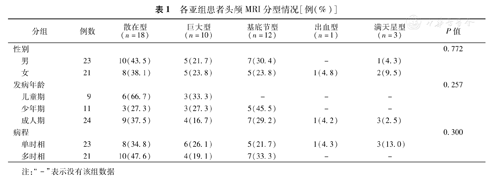
各亚组患者头颅MRI分型情况[例(%)]
各亚组患者头颅MRI分型情况[例(%)]
| 分组 | 例数 | 散在型(n=18) | 巨大型(n=10) | 基底节型(n=12) | 出血型(n=1) | 满天星型(n=3) | P值 | |
|---|---|---|---|---|---|---|---|---|
| 性别 | 0.772 | |||||||
| 男 | 23 | 10(43.5) | 5(21.7) | 7(30.4) | - | 1(4.3) | ||
| 女 | 21 | 8(38.1) | 5(23.8) | 5(23.8) | 1(4.8) | 2(9.5) | ||
| 发病年龄 | 0.257 | |||||||
| 儿童期 | 9 | 6(66.7) | 3(33.3) | - | - | - | ||
| 少年期 | 11 | 3(27.3) | 3(27.3) | 5(45.5) | - | - | ||
| 成人期 | 24 | 9(37.5) | 4(16.7) | 7(29.2) | 1(4.2) | 3(2.5) | ||
| 病程 | 0.300 | |||||||
| 单时相 | 23 | 8(34.8) | 6(26.1) | 5(21.7) | 1(4.3) | 3(13.0) | ||
| 多时相 | 21 | 10(47.6) | 4(19.1) | 7(33.3) | - | - | ||
注:"-"表示没有该组数据
糖皮质激素是本组ADEM患者急性期最常用药物。多数患者使用甲泼尼龙治疗(40/44,90.9%),成年患者剂量为1.0 g/d,3~5 d为1疗程,连续使用1~2疗程;儿童患者视体重酌减;少数患者在当地医院使用地塞米松(4/44,9.1%)治疗。13例患者曾联用丙种球蛋白(13/44,29.5%)。3例患者在首次发病早期曾考虑病毒性脑炎,给予抗病毒治疗(3/44,6.8%)。
29例(65.9%)患者在本院脱髓鞘专科门诊进行了规律随访,随访时间(4.2±2.3)年。其中单时相型患者10例,多时相型患者19例。多时相型患者首次复发时间(2.5±2.3)年,总复发次数(3.3±1.4)次;多时相型患者最后一次复发平均EDSS评分(3.9±2.2)分,mRS评分(2.2±1.3)分。
29例患者最后一次MRI检查与第一次MRI检查时间间隔(5.3±1. 9)年。其中18例(62.1%)病灶部分缓解,6例(20.7%)病灶持续存在,5例(17.2%)出现新病灶。单时相与多时相患者比较,两者头颅MRI临床转归差异无统计学意义(P=0.587)(表2)。在不同MRI分型中,病灶部分消退最多见,各种分型在随访中转归的差异无统计学意义(P=0.131)(表3)。
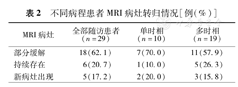
不同病程患者MRI病灶转归情况[例(%)]
不同病程患者MRI病灶转归情况[例(%)]
| MRI病灶 | 全部随访患者(n=29) | 单时相(n=10) | 多时相(n=19) |
|---|---|---|---|
| 部分缓解 | 18(62.1) | 7(70.0) | 11(57.9) |
| 持续存在 | 6(20.7) | 1(10.0) | 5(26.3) |
| 新病灶出现 | 5(17.2) | 2(20.0) | 3(15.8) |
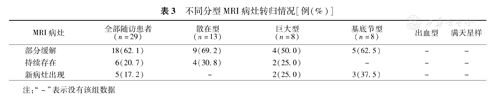
不同分型MRI病灶转归情况[例(%)]
不同分型MRI病灶转归情况[例(%)]
| MRI病灶 | 全部随访患者(n=29) | 散在型(n=13) | 巨大型(n=8) | 基底节型(n=8) | 出血型 | 满天星样 |
|---|---|---|---|---|---|---|
| 部分缓解 | 18(62.1) | 9(69.2) | 4(50.0) | 5(62.5) | - | - |
| 持续存在 | 6(20.7) | 4(30.8) | 2(25.0) | - | - | - |
| 新病灶出现 | 5(17.2) | - | 2(25.0) | 3(37.5) | - | - |
注:"-"表示没有该组数据
在规律治疗的13例多时相ADEM患者中,糖皮质激素(13/13,100.0%)和丙种球蛋白(7/13,53.8%)是复发急性期的主要治疗药物。缓解期,单时相患者没有进行长期疾病修饰治疗;多时相患者多选择小剂量激素口服治疗预防复发(12/13,92.3%),其中1例患者(7.7%)因股骨头坏死停用激素;9例患者曾联合硫唑嘌呤(69.2%)治疗,2例在硫唑嘌呤治疗无效后改用他克莫司(15.4%),1例联合环孢素A(7.7%),2例反复发作后使用利妥昔单抗(15.4%)治疗。1例患者曾使用β-干扰素1b(7.7%)。
本研究为较大样本的单中心、回顾性国人ADEM临床研究。传统认为ADEM以儿童多见,但近年成人ADEM报道逐渐增多。Koelman等[6]于2016年进行了美国目前最大样本量ADEM多中心研究,228例患者中儿童122例,成年106例。国内一项研究纳入了12例ADEM患者,仅1例儿童[7]。与上述国内外研究一致,本组单中心研究中,成人患者比例高(55%),提示ADEM在国人成人起病并非少见。
通常认为ADEM多发生在疫苗接种后。但本研究中,疫苗接种后ADEM比例较低,但前驱感染比例高。值得一提的是,本研究中有2例确诊视神经脊髓炎(NMO)患者在病程中诊断ADEM。近年,Eichel等[8]报道2例NMO患者出现ADEM临床表现,因此推测ADEM可以发生在NMO病程中。之后国内学者也报道了国人ADEM合并NMO[9]。另有报道,儿童ADEM可能转化为NMO[10]。因此临床诊断ADEM患者,尤其儿童,必须检测NMO-IgG以协助鉴别。
ADEM与其他炎性脱髓鞘疾病,如多发性硬化(MS)和NMO难以鉴别。ADEM多为单时相疾病,2007年诊断标准[11]提出"复发性ADEM"和"多时相ADEM"。但在2012诊断标准中[3],专家组普遍认为再发ADEM事件发病率低,建议取消"复发性ADEM",将复发ADEM统称为"多时相ADEM"。本研究发现,多时相型患者比例较高(48%),提示可能需要重新评估国人"多时相ADEM"发病比例,以明确ADEM临床分型是否存在种族差异等。ADEM典型症状为迅速出现的全脑症状,表现为意识及精神状态改变、行为异常等。本研究中患者出现意识障碍(39%)和精神症状(41%)等脑病表现比例高,与国内外报道一致[6,7]。
此外,本研究中有4例患者出现了甲状腺抗体升高,需要与桥本脑病相鉴别。我国学者曾探讨桥本氏脑病临床特点[12],发现患者也可出现认知障碍和精神障碍等脑病表现,但血清抗甲状腺过氧化物酶抗体(aTPO)多升高达数倍至数十倍,脑脊液细胞数多接近正常,头颅MRI无病灶或表现为非特异性改变。但本组ADEM患者的aTPO/aTG仅为临界升高水平,脑脊液细胞数有较明显上升,头颅MRI显示符合AEDM典型病灶改变,以上特点可与典型的桥本氏脑病相鉴别。事实上,多种中枢神经系统脱髓鞘疾病可以合并甲状腺抗体异常,而aTPO升高也可见于部分正常人群。但ADEM和桥本氏脑病均为免疫性疾病,而且临床表现多样,是否存在一定的重叠值得进一步研究探讨。
MRI对ADEM诊断及鉴别诊断至关重要。有报道ADEM病灶在T2或FLAIR上表现为多发性、斑片状、边界不清、较大病灶(>1~2 cm),而在MS常见的T1低信号(T1黑洞)在ADEM罕见,可作为MS与ADEM的影像鉴别依据[13]。我们在既往研究中探讨过ADEM脑深部灰质病灶的特点,并发现豆状核壳受累在ADEM较MS及NMO常见[14]。本研究再次证实,ADEM较易累及丘脑及基底节区(75%)。此外,ADEM的MRI增强表现与病程阶段有关。既往研究证实30%~100%患者出现MRI病灶强化,增强模式也可为环状或开环状、线样、结节样、斑点样强化[3]。本研究发现,近50%患者存在MRI急性期强化,表现为片状、结节状和线样等多种强化类型。有报道11%~28%患者出现脊髓受累[3]。本研究中,ADEM脊髓受累略高于已往报道(32%)。
ADEM患者MRI上病灶数目、分布以及大小均可出现较大变化。Tenembaum等[4]将ADEM病灶分为四种类型,对84例患者随访发现,62%患者表现为散在型,24%为巨大型,12%为基底节型,2%出现出血型病灶。本研究得出类似结论,发现MS样散在型病灶最常见(41%),以丘脑受累为主的基底节型其次(27%),巨大型占一定比例(23%)。此外,Otten等[5]报道了满天星样病灶,该类病灶特点为多发T2病灶,伴环状强化,广泛分布但主要局限于白质,少数有脑干受累。本研究中,满天星型病灶占7%,提示该类型并不罕见。
本研究发现,ADEM病灶中MS样散在型病灶最为常见(41%),与MS病灶难以鉴别。有报道ADEM可以转化为MS,转化率2%~18%不等,且80%患者复发均发生在首次发病后2年内。由于ADEM可以转化为MS及NMO等炎性脱髓鞘病,现在多数学者认为ADEM是一种"综合征"而非单一疾病。2010年MS诊断标准建议判断ADEM第二次发作可能转化为MS的特点包括:(1)临床表现为非脑病症状;(2)间隔3个月后发生;(3)新发病灶在MRI符合MS空间多发特性[15]。
本研究初步表明,国人ADEM成人起病并非少见,可以为多时相病程,全脑症状明显,MRI表现常见为散在型及基底节型,随访后部分缓解。由于ADEM临床表现多样,并可转化为MS及NMO,因此ADEM可能作为一组"临床综合征"而非独立疾病实体。



























