
探讨肌肉破坏对局部腰椎椎体骨质量的影响。
将30只20周龄、雌性SD大鼠,随机分为3组:对照组(伪手术组、双侧背部侧正中切口,CNT)、双侧竖脊肌组(切除双侧腰椎旁竖脊肌,RESM)以及去势组(切除双侧卵巢,OVX)。术后第3个月取材腰椎椎体(L4~6)依次进行骨密度、显微CT、椎体压缩实验等检测。
在术后第3个月RESM组骨密度明显地低于对照组CNT[(0.211±0.028) g/cm2比(0.253±0.021) g/cm2,P<0.01],然而,OVX和RESM两组之间骨密度差异不明显[(0.197±0.015) g/cm2比(0.211±0.028) g/cm2,P>0.05]。在显微CT三维重建及椎体显微形态计量学分析中,相比于对照组CNT,实验组OVX、RESM的骨小梁都更为稀疏,骨小梁数目和骨小梁之间相互连接较少,特别是OVX骨小梁网络的疏松趋势更为明显。在椎体压缩实验中,实验组OVX和RESM较之CNT组的最大载荷、能量吸收、最大应力以及弹性模量均显著的减低(P<0.01)。RESM上述4个生物力学参数均显著高于OVX(P<0.05)。
椎旁肌肉的完整性和活力对于维持邻近椎体骨质量具有重要意义,切除双侧竖脊肌可致局部椎体骨质量明显减低,椎旁肌肉萎缩或损伤可能会引起椎体骨质疏松。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
腰椎的力学稳定和平衡是所有腰椎疾病问题的起点和终点[1]。椎旁肌肉的衰老和损伤会使腰椎的动态稳定难以为继。腰椎不稳加剧腰椎退变,最终引起腰椎轴性疼痛甚至神经症状[2]。对于老年患者而言,椎旁肌肉的萎缩和损伤是与椎体的骨质疏松相伴的[3]。腰椎退变不单单是椎间盘退变,也包括椎旁肌肉损伤萎缩以及腰椎椎体骨质量的变化。对于老年性腰椎椎体骨量流失,人们往往会将其归因于雌激素缺乏或增龄,并期待从分子生物学和细胞生物学上获得完美地解答。经典的废用性骨质疏松模型已证实动物肢体处于不负重或者瘫痪状态可引起局部骨质疏松[4]。但目前尚未见关于椎旁肌肉损伤这个单一因素对于椎体骨量变化的实验动物研究报道。本研究假设切断腰椎椎旁肌肉,引起力学刺激不足会引起局部腰椎骨量丢失,并利用成熟年龄的大鼠分组进行实验以排除激素和衰老两个因素的干扰,旨在指导老年患者重视和加强腰背肌功能锻炼以预防椎体骨质疏松和退变。
30只20周龄、雌性SD大鼠,体重(280±20)g,SPF级,购于上海斯莱克实验动物有限责任公司,饲养于上海第一人民医院南院实验动物中心。
水合氯醛(上海实验试剂有限公司),双能X线骨密度仪(DXA)(HOLOGIC Discovery-A型,美国),显微CT(Micro-CT)(SCANCO microCT-μ80,瑞士),万能材料试验机(岛津G-A2000,日本)。
将实验动物随机分为3组:对照组(伪手术组、双侧背部侧正中切口,CNT)、双侧竖脊肌组(切除双侧腰椎竖脊肌,erector spinal muscle,RESM)以及去势组(切除双侧卵巢,OVX)。经1周适应性喂养后行相应手术,术后第3个月取材腰椎椎体(L4~6)和椎旁肌肉进行后续实验内容。
在适应性喂养1周后,准确地称量大鼠体重,按体重以4 ml/kg腹腔注射10%水合氯醛。待麻醉生效后,在无菌条件下对所有大鼠背部行侧正中纵行切口,切口上至胸椎下缘,下至腰骶交接处,充分地暴露出腰椎及部分胸腰段椎体,继续切开部分筋膜组织,对RESM组切除腰椎旁双侧竖脊肌,对CNT组直接关闭切口。对OVX组,剪去双侧季肋区毛,乙醇消毒表皮,在左侧肋下1 cm处取1 cm横向切口,逐层分离腹壁肌肉,进入腹腔后,可在腹腔脂肪组织内找到输卵管和卵巢,结扎输卵管伞部,切除卵巢,逐层缝合切口,并以相同方法处理对侧卵巢。
术后第3个月以过量麻药处死实验动物,剥离腰椎L4~6节段,剥离过程注意保护腰椎骨质,取各组L6腰椎椎体共计10个备用。将双能X线骨密度仪(DXA)(HOLOGIC Discovery-A型,美国)设定为小动物模式,划定各组大鼠腰椎L6离体标本感兴趣区(ROI),检测其骨密度值(BMD)。
术后第3个月,选取每组L5椎体,去除椎旁肌肉及软组织,以减少micro-CT扫描时软组织对腰椎骨质成像的干扰。0.9%生理盐水保持标本湿润,使用micro-CT对标本进行扫描和重建(SCANCO microCT-μ80,瑞士),扫描条件设为80 kV、100 μA。以15 μm像素分辨率,即扫描精度为15 μm×15 μm×15 μm,以椎体内松质骨为中心的、约500断层内区域进行扫描。利用制造商提供的软件包进行三维图像处理和数据分析。在3D影像学数据基础上,对椎体松质骨显微形态学参数进行测量,输出的骨组织结构参数包括:骨小梁体积BV/TV(%)、骨小梁数目Tb.N(1个/mm)、骨小梁厚度Tb.Th(μm)、骨小梁分离度Tb.Sp(mm)、骨小梁模式因子Tb.Pf(1/mm)以及骨表面积体积比BS/BV(1/μm)等。
每组选取10个腰椎L4标本,用纱布包裹浸泡在0.9%生理盐水中,放置于-20 ℃冰箱内保存,测试前逐级解冻。进行椎体压缩实验前,先将椎体附件修剪除去,并在细砂纸上将其两端终板轻轻磨平,使之成为高5 mm左右的圆柱形松质骨体。利用万能材料试验机(岛津G-A2000,日本),沿椎体纵轴单向压缩,设定加载速度为2 mm/min,载荷精度为0.01 kg·m·s-2,匀速加载至最大载荷值。记录测试椎体压缩的最大弯曲载荷(kg·m·s-2)和最大弯曲位移(mm),根据应力-应变曲线推算出弹性模量和弯曲能量吸收。
实验数据以 ±s表示,采用SPSS 17.0统计软件进行统计学分析。组内自身比较采用t检验。组间比较采用单因素方差分析,组间两两比较采用LSD法检验。以P<0.05为差异有统计学意义。
±s表示,采用SPSS 17.0统计软件进行统计学分析。组内自身比较采用t检验。组间比较采用单因素方差分析,组间两两比较采用LSD法检验。以P<0.05为差异有统计学意义。
各组实验动物在术后第3个月处死取材之前,并无因手术引起的局部出血和感染而死亡,至取材之时大鼠均可正常进食和活动。
术后第3个月取材测定腰椎L6的BMD,OVX组与CNT组BMD相比差异有统计学意义[(0.197±0.015) g/cm2比(0.253±0.021) g/cm2,P<0.01],经典的绝经后骨质疏松实验动物模型成功的建立。RESM组BMD为(0.211±0.028) g/cm2,也明显地低于对照组CNT(P<0.01),初步地证明了椎旁肌肉损伤会引起椎体局部骨量流失。然而,OVX、RESM两组之间BMD差异无统计学意义(P>0.05)。
在术后第3个月,取得L5椎体进行显微CT扫描并经过3D重建获取图片以及3D显微形态计量学数据。此时,椎体内部呈圆柱体重建图片中(图1),相比于对照组CNT,实验组OVX和RESM两组的骨小梁都更为稀疏,总体数目和相互连接较少,特别是OVX骨小梁网络的疏松趋势更为明显。
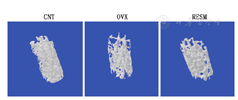

术后第3个月,实验组两组(OVX和RESM)较之对照组CNT,骨小梁体积分数(BV/TV)、骨小梁数目(Tb.N)以及骨小梁厚度(Tb.Th)明显减低,骨小梁分离度(Tb.Sp)、骨小梁模式因子(Tb.Pf)和骨表面积体积比(BS/BV)明显增高,差异均有统计学意义(均P<0.05)。肌肉损伤RESM与去卵巢OVX一样引起了椎体L5骨质疏松,数据上表现为骨小梁数目减少,骨小梁厚度减低以及连接减少且更为稀疏。除了骨小梁厚度(Tb.Th)之外,RESM的骨小梁特征均优于OVX,表现为BV/TV和Tb.N更高,而Tb.Sp、Tb.Pf以及BS/BV更低,差异有统计学意义(P<0.05)(表1)。
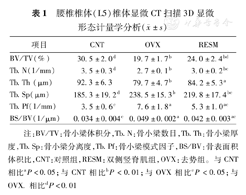
腰椎椎体(L5)椎体显微CT扫描3D显微形态计量学分析( ±s)
±s)
腰椎椎体(L5)椎体显微CT扫描3D显微形态计量学分析( ±s)
±s)
| 项目 | CNT | OVX | RESM |
|---|---|---|---|
| BV/TV(%) | 30.5±2.0d | 19.7±1.7b | 24.0±2.4bd |
| Tb.N(1/mm) | 3.5±0.3d | 2.7±0.1b | 3.0±0.2bc |
| Tb.Th (μm) | 92.3±6.3 | 79.7±4.7b | 84.2±5.3a |
| Tb.Sp(μm) | 185.3±19.2d | 238.5±15.3b | 219.8±17.4bc |
| Tb.Pf(1/mm) | 3.5±0.6c | 7.6±1.8a | 5.3±1.0ac |
| BS/BV(1/μm) | 0.034±0.004c | 0.049±0.002a | 0.042±0.003ac |
注:BV/TV:骨小梁体积分,Tb.N:骨小梁数目,Tb.Th:骨小梁厚度,Tb.Sp:骨小梁分离度,Tb.Pf:骨小梁模式因子,BS/BV:骨表面积体积比,CNT:对照组,RESM:双侧竖脊肌组,OVX:去势组。与CNT相比aP<0.05;与CNT相比bP<0.01;与OVX相比cP<0.05;与OVX.相比dP<0.01
术后第3个月,OVX和RESM两组较之对照组CNT组的最大载荷[(236.6±15.5) kg·m·s-2比( 261.5±18.6) kg·m·s-2比(357.2±16.9) kg·m·s-2]、能量吸收[(23.4±2.5) mJ比(39.3±2.6) mJ比49.29±2.85)]、最大应力(Mpa)[(23.6±2.0) Mpa比(28.9±2.5) Mpa比(36.3±2.6) Mpa]以及弹性模量[(66.2±2.9) Mpa比(71.2±3.1) Mpa比(99.7±4.0) Mpa]均显著的减低(P<0.01)。在比较RESM和OVX时,前者的上述4个生物力学参数均显著高于后组(P<0.01),切除双侧竖脊肌对腰椎椎体骨强度的负性作用远低于切除卵巢对椎体骨强度的影响。
骨质疏松症是一种以骨量减低、骨微结构破坏为特征,导致骨脆性增加和容易骨折的全身性疾病[5]。临床观察证实腰椎间盘突出症、腰椎管狭窄症以至腰椎退变性侧凸等患者都可能会伴有椎体骨质疏松[6,7]。骨质疏松症根据其病因被明确地分为原发性和继发性两大类[8]。前者主要包括绝经后骨质疏松症和老年性骨质疏松症。若谈及机械应力与骨质疏松症二者的关系,则不能不提到废用性骨质疏松症[9]。它的病理基础是全身或者局部骨骼失去应力刺激[10]。骨骼所受的力学刺激需要相伴的肌肉传导,所谓废用,究其根本是肌肉对其所连接骨骼的机械力学刺激不足。正如古老的Wolf定律中所阐述的,骨小梁总是沿着反复承受应力的方向排列[11]。
本研究假设腰椎椎旁肌肉萎缩或损伤会加剧腰椎骨质流失。为了排除激素水平变化以及衰老增龄对于骨骼本身的影响,单纯地研究椎旁肌肉局部应力以及腰椎骨质量的相关性,本研究尝试在通过切除实验动物椎旁肌肉来研究椎旁肌肉应力刺激对于椎体骨质量的影响。经典的废用性骨质疏松动物模型可分为全身性制动和局部性制动,前者如小笼喂养法;后者又可分为尾吊法、腿-尾固定法、腱切断法、神经切断法以及局部外固定法等[12,13,14]。目前尚未见关于椎旁肌肉损伤、衰老等病理变化对于椎体骨量影响的实验研究报道。
在本实验研究中,实验组RESM较之对照组CNT的L5椎体内,骨小梁体积分数(BV/TV)、骨小梁数目(Tb.N)以及骨小梁厚度(Tb.Th)明显减低,骨小梁分离度(Tb.Sp)、骨小梁模式因子(Tb.Pf)和骨表面积体积比(BS/BV)明显增高,初步地证明了椎旁肌肉损伤会引起椎体局部骨量流失。我们并没有逐一测量L1~6大鼠椎体的骨密度,因为已有相关研究证实雌性大鼠的整体BMD与在体和离体单一腰椎椎体的BMD具有较好的一致性[15,16]。除了骨小梁厚度(Tb.Th)之外,RESM的骨小梁特征均优于OVX,表现为BV/TV和Tb.N更高,而Tb.Sp、Tb.Pf以及BS/BV更低,差异也具有统计学意义,说明局部肌肉损伤所致的椎体骨量流失不如因雌激素剥夺而引起的全身性骨质疏松的损害大。这一观点也在此后的椎体生物力学实验中再次得到印证,OVX和RESM两组较之CNT最大载荷、能量吸收、最大应力以及弹性模量均显著的减低;在比较RESM和OVX时,前者的上述四个生物力学参数均显著高于后组。这些都说明了应力刺激对于椎体骨量和力学强度的维持非常重要,力学刺激不足会引起局部中轴骨的骨量丢失。在分析患者椎体骨质疏松的成因时也许激素水平改变和衰老退变是主要因素,但同样不能忽视椎旁肌肉的直接保护作用和应力刺激作用,宜将椎体和椎旁肌肉衰变视为一个疾病的整体表现。
关于肌肉和骨骼直接相关性的研究较少。在本研究中,我们证实了局部椎旁肌肉损伤可能会引起相近椎体的骨质疏松。本研究的意义在于强调保持腰椎椎旁肌肉力量对维持腰椎椎体骨质量的意义,加强中老年人腰背部功能锻炼不光有益于减缓腰椎退变也有益于预防椎体骨质疏松。



























