
探讨彩色多普勒超声在肾移植后肾动脉狭窄诊断中的临床应用价值。
对2015年9月至2016年7月间收治的216例肾移植后受者进行常规彩色多普勒随访监测,通过测肾动脉、肾段动脉及叶间动脉收缩期峰值流速、阻力指数,并进行对比分析,拟诊移植肾动脉狭窄。所有拟诊患者均行移植肾动脉造影确定诊断。
14例拟诊移植肾动脉狭窄的患者全部接受移植肾动脉造影检查,确诊12例,超声诊断准确率为85.7%。当肾动脉PSV/叶间动脉PSV>10,即峰值流速后比>10时,诊断TRAS的敏感度和特异度最高,分别为91%和95%。血管介入治疗后7 d肾段动脉及叶间动脉峰值流速明显增加,肾动脉血流速度降低。
彩色多普勒操作简便、无创、准确度高,可作为筛查移植肾动脉狭窄及血管介入治疗效果评价的首选方法。移植肾动脉PSV/叶间动脉PSV(峰值流速后比)用于诊断移植肾动脉狭窄敏感度及特异度较高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
移植肾动脉狭窄(transplanted renal artery stenosis,TRAS)是肾移植后较常见的严重血管并发症,发生率约为2.7%~23.0%[1],是导致受者顽固性高血压、尿量减少及移植肾功能不全的重要因素。TRAS可发生于术后任何时段,但常见于术后3个月至术后2年[2],多数患者除高血压外无明显临床表现,直至移植肾功能减退才发现,错过最佳治疗时机。因此,探讨一种准确、简便的筛选诊断TRAS的方法成为临床迫切需要。本研究旨在探讨彩色多普勒超声动态监测在TRAS早期诊断以及介入治疗效果评价中的应用价值,现报告如下。
对2015年9月至2016年7月间收治的216例肾移植受者进行彩色多普勒超声监测。通过超声检查拟诊为TRAS的患者为观察组。同时应用随机数表法抽取同期行彩色多普勒超声检查,且血流灌注无异常的50例受者作为对照。
采用日立HI VISION Preius彩色多普勒超声诊断仪,探头频率为2.5~7.5 MHz。常规经腹壁对移植肾区进行检查,应用二维超声测量移植肾大小,观察边缘轮廓、形态、内部回声;彩色多普勒超声显示移植肾动脉与髂动脉吻合口、肾内血流信号分布及充盈情况;脉冲多普勒超声逐级观察移植肾动脉主干、段动脉、叶间动脉,获取肾内上、中、下极肾段动脉及小叶间动脉的血流频谱,测量肾动脉峰值流速(peak systolic velocity,PSV)、峰值流速后比(肾动脉PSV/叶间动脉PSV)和叶间动脉阻力指数(resistant index)等,结果取3~4个心动周期的平均值。
对所有肾移植后受者常规进行彩色多普勒超声随访监测,检查时间为术后1 d、3 d、7 d、14 d,1个月后每3个月复查1次。接受血管介入治疗的TRAS患者检查时间为术后7 d,以后每月复查1次。
移植肾动脉PSV≥200 cm/s,叶间动脉阻力指数<0.55,峰值流速后比>6.0,拟诊TRAS。所有拟诊TRAS患者均行磁共振血管造影(MRA)或移植肾动脉数字减影血管造影(DSA)检查以确定诊断。
采用SPSS(17.0版)统计软件对研究数据进行分析,计量资料以均数±标准差( ±s)表示,行t检验。计数资料采用χ2检验进行比较分析。P<0.05为差异有统计学意义。
±s)表示,行t检验。计数资料采用χ2检验进行比较分析。P<0.05为差异有统计学意义。
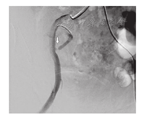
经彩色多普勒超声动态监测,拟诊移植肾动脉狭窄患者共14例,所有患者均行MRA或DSA检查,确诊TRAS12例,超声诊断的准确率为85.7%(12/14)。确诊患者中,男性11例,女性1例,患者年龄为(36.1±8.6)岁,发病时间为术后12 d至9个月。12例中,7例狭窄部位于吻合口附近(图1),4例发生在肾动脉主干,1例移植肾动脉闭塞。彩色多普勒超声显示,TRAS患者肾动脉狭窄处血流束较细窄,色彩亮度增加,狭窄口下游血流束增宽,呈五彩混叠状的花色血流,部分患者"树枝状"血流消失,肾内血流信号减少,动脉频谱形态低平,收缩期上升缓慢(图2)。

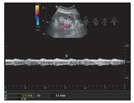

应用频谱多普勒测定各级肾动脉血流参数,TRAS组肾动脉PSV为(178.0±23.6) cm/s,对照组为(106.0±19.4) cm/s,差异有统计学意义(P<0.05);叶间动脉PSV为(23.9±8.6) cm/s,低于对照组的(39.0±11.7) cm/s(P<0.05),峰值流速后比为16.3±1.0,高于对照组的4.4±1.6(P<0.05)。肾段动脉PSV及叶间动脉阻力指数与对照组相比较,差异无统计学意义(P>0.05,表1)。应用受试者工作曲线(receiver operator characteristic curve)计算峰值流速后比诊断TRAS的敏感度和特异度,结果当肾动脉PSV/叶间动脉PSV>10时,即峰值流速后比>10,诊断TRAS的敏感度和特异度最高,分别为91%和95%。

移植肾动脉狭窄(TRAS)组与对照组彩色多普勒超声血流参数的比较( ±s)
±s)
移植肾动脉狭窄(TRAS)组与对照组彩色多普勒超声血流参数的比较( ±s)
±s)
| 组别 | 肾动脉PSV(cm/s) | 肾段动脉PSV(cm/s) | 叶间动脉PSV(cm/s) | 叶间动脉阻力指数 | 峰值流速后比 |
|---|---|---|---|---|---|
| TRAS组 | 178.0±23.6a | 43.1±7.2 | 23.9±8.6a | 0.45±0.06 | 16.3±5.8a |
| 对照组 | 106.0±19.4 | 58.4±8.6 | 39.0±11.7 | 0.62±0.18 | 4.4±1.6 |
注:PSV为肾动脉峰值流速;与对照组比较,aP<0.05
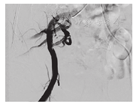
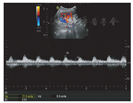
12例TRAS患者均行血管介入治疗,其中3例患者行单纯移植肾动脉球囊扩张术,9例患者动脉支架置入术(图3)。术后复查彩色多普勒超声,移植肾内血流信号均较治疗前改善(图4)。频谱多普勒测量结果显示肾主动脉PSV由(178.0±13.6) cm/s下降至(118.0±7.1) cm/s(P<0.05),峰值流速后比由16.3±1.0下降至3.6±1.7(P<0.05),叶间动脉PSV由23.9±8.6升高至44.8±6.7(P<0.05),叶间动脉阻力指数由0.45±0.06升高至0.61±0.23(P<0.05,表2)。

移植肾动脉狭窄(TRAS)患者介入治疗前后彩色多普勒超声血流参数的比较( ±s)
±s)
移植肾动脉狭窄(TRAS)患者介入治疗前后彩色多普勒超声血流参数的比较( ±s)
±s)
| 检查时间 | 肾动脉PSV(cm/s) | 肾段动脉PSV(cm/s) | 叶间动脉PSV(cm/s) | 叶间动脉阻力指数 | 峰值流速后比 |
|---|---|---|---|---|---|
| 治疗前 | 178.0±13.6 | 43.1±7.2 | 23.9±8.6 | 0.45±0.06 | 16.3±5.8 |
| 治疗后7 d | 118.0±7.1a | 51.3±4.7 | 44.8±6.7a | 0.61±0.23a | 3.6±1.7a |
注:PSV为肾动脉峰值流速;与治疗前比较,aP<0.05


TRAS是肾移植术后较为严重的血管并发症,是导致移植肾功能障碍的重要因素之一。常与供肾动脉粥样硬化、血管损伤、动脉吻合技术、血栓形成以及排斥反应等因素有关。其临床表现无特异性,主要表现为进行性的难治性高血压,有或无移植肾功能减退,部分患者可无任何临床症状,仅在例行复查中发现。该病进展迅速,如未及时治疗,最终可导致移植肾功能丧失。因此早期发现和治疗TRAS对于改善移植肾功能,提高移植肾存活率至关重要。目前,DSA仍是诊断TRAS的金标准。但是,由于其操作复杂、创伤大、风险高,且需应用大量造影剂,可加重移植肾功能损害,不适合用于移植后受者的常规监测。此外,随着CTA及MRA技术的飞速发展,其诊断血管疾病的准确性大幅提高,但CTA同样需要造影剂,且MRA假阳性较高。彩色多普勒超声检查价格低廉、无创伤、简单方便,可多次重复检查,便于动态观察移植肾血流情况,能够观察移植肾血管的解剖结构细节,不但可以作为肾动脉狭窄的重要筛查手段,而且可以为确定狭窄动脉具体节段及狭窄程度提供一定参考[3]。我中心对肾移植术后患者常规行彩色多普勒超声动态监测,对于TRAS的早期诊断取得了一定成效。
本研究应用彩色多普勒超声在216例肾移植受者中筛选出肾动脉狭窄14例,检出率为6.5%(14/216)。后经DSA检查证实12例,诊断准确率为85.7%。目前关于彩色多普勒超声诊断TRAS无明确标准,不同研究提出不同的测量指标和诊断阈值。一类为直接指标,包括肾动脉PSV、肾动脉与髂动脉峰值流速比值(RIR)。Siskind等[4]研究提示,肾动脉PSV>200 cm/s,肾动脉与髂动脉峰值流速比>2.0,诊断TRAS的敏感度为100%,但特异度仅67%。实际上,由于移植肾动脉与髂血管吻合方式的不同,肾动脉PSV及RIR变异较大,难以确定TRAS的具体诊断阈值[5,6]。另一类为间接指标,包括收缩早期加速时间(AT)、收缩早期加速度(AC)和阻力指数。AT只有在动脉狭窄程度>80%时,才具有较高敏感度[7],而阻力指数受多种因素影响,测量误差较大,不宜客观比较。本研究结果表明,叶间动脉PSV诊断TRAS的特异度和敏感度,高于肾动脉及肾段动脉PSV。我们发现,当肾动脉PSV/叶间动脉PSV>10,即峰值流速后比>10时,诊断TRAS的敏感度和特异度最高,分别为91%和95%。这可能由于肾内动脉缺乏侧枝循环,TRAS患者肾内血流灌注不足,导致皮质血流减少,直接影响叶间动脉血流速度。
近年来血管介入治疗技术发展迅速,经皮移植肾动脉球囊扩张术及动脉支架置入术目前已广泛应用于移植肾动脉狭窄的血管再通及血运重建[8]。但是有关TRAS介入治疗前后血流动力学的变化,国内外报道较少。本研究应用彩色多普勒超声对12例血管介入术后的患者进行随访监测,结果发现,介入治疗后7 d叶间动脉峰值流速明显增加,肾动脉血流速度降低,这表明介入治疗缓解了动脉狭窄,迅速改善了肾内血流灌注,一定程度上逆转了肾功能减退。但是,需要注意的是,部分病例直至术后3个月,叶间动脉峰值流速仍未恢复至狭窄发生前水平,这提示TRAS一旦发生,即对肾内血流灌注造成不利影响,即使血管再通,这种损伤仍然存在。因此,接受血管介入手术的TRAS患者,术后应加强随访。据文献报道,血管介入治疗后移植肾动脉再狭窄的发生率为6%[9]。本研究随访病例中,再发狭窄1例(8.3%),发生于移植肾动脉球囊扩张术后70 d,后行移植肾动脉支架植入术,术后恢复良好。目前,肾动脉再狭窄的原因不明,可能与动脉内膜增生、血栓形成、急性排斥反应等因素有关[10]。
综上所述,彩色多普勒检查无创、可重复,不仅能直接显示移植肾动脉血流动力学变化还可判定狭窄类型及程度,为血管介入治疗方案的选择及治疗效果评价提供重要参考依据,可作为TRAS筛查与鉴别诊断的首选检查方法。下一步我们将会进一步增加样本量,并结合DSA检查结果,分析不同狭窄程度的移植肾动脉彩色多普勒超声血流参数的诊断阈值,并结合目前超声造影等技术提高彩色多普勒超声在TRAS诊断中的应用价值。



























