
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
细胞遗传学异常是髓性恶性肿瘤最常见的分子事件,且在疾病的发病、诊断及预后分析等方面起着关键作用。在初诊成人原发性骨髓增生异常综合征(MDS)中染色体异常占50%~60%,在继发性MDS中高达80%[1]。del(5q)在MDS中最常见,占10%~15%。5q31-5q33为其主要缺失区域,该区域存在多种与疾病相关的基因,如核糖体基因RPS14、miR-145及miR-146a等,上述基因改变引起不同的临床表现[2]。按照2008年WHO诊断标准,del(5q)在MDS中有两种不同的表现形式:一种以单一形式存在,其预后好、转白率低;一种为del(5q)伴其他染色体异常,此类患者疾病进展快,预后差[3]。本研究中,我们回顾性分析2009年1月至2014年12月我院收治的50例伴del(5q)MDS患者的临床资料,观察其临床特征及预后影响因素,报道如下。
以2009年1月至2014年12月就诊于我院的50例伴del(5q)MDS患者为研究对象,男29例,女21例,男∶女为1.38∶1,中位年龄63.5(31~85)岁。诊断和分型均符合WHO 2008标准,其中难治性血细胞减少伴单系发育异常(RCUD)2例(4%),难治性血细胞减少伴有多系发育异常(RCMD)16例(30%),难治性贫血伴有原始细胞过多-1(REAB-1)11例(22%),REAB-2 12例(24%),MDS不能分类(MDS-U,均为外周血原始细胞占0.01、骨髓原始细胞<0.040)5例(12%),MDS伴有单纯del(5q)4例(8%)。参照国际预后积分系统(IPSS)[4],低危8例、中危-1 26例、中危-2 12例、高危4例。低危及中危-1定义为相对低危组,中危-2及高危为相对高危组。
分析患者初诊时的血常规、骨髓象、染色体核型及TP53基因突变情况。核型分析采用R显带技术,按《人类细胞遗传学国际命名体制(1995)》进行描述。所有患者均行FISH检查,FISH探针试剂盒购自美国Vysis公司,包括D20S108、CEP8、D7S486、EGR1(5q-)。del(5q)骨髓细胞≥0.500定义为大克隆,<0.500定义为小克隆[5]。利用Sanger测序检测TP53基因突变情况,引物设计参考NCBI序列,参考序列号:NC_000017.11、NM_000546.5[6],由广州金域检验公司完成操作。
根据IPSS预后分层,同时结合患者年龄、EOCG评分、依从性等进行综合评定,选择治疗方案。大部分的相对低危组患者以支持治疗为主,包括成分血输注、祛铁、EPO、GM-CSF、雄激素、环孢素A、沙利度胺等治疗;4例中危-1患者因全血细胞减少采用地西他滨治疗。相对高危组主要采用去甲基化治疗或化疗,包括地西他滨、亚砷酸、高三尖杉酯碱、柔红霉素、阿糖胞苷等。
随访至2016年1月1日,随访资料来自住院病历、门诊病历及电话记录。生存期按确诊日期至死亡日或随访结束日计算。
使用SPSS 20.0软件进行统计学分析。正态分布资料采用两独立样本t检验,非正态分布资料采用Wilcoxon秩和检验;生存分析采用Kaplan-Meier法;预后因素评估单因素分析采用Log-rank检验,多因素分析采用Cox回归模型。P<0.05为差异有统计学意义。
50例患者中位HGB 72(33~150)g/L,中位中性粒细胞绝对计数1.40(0.21~16.96)×109/L,中位PLT 88(14~425)× 109/L,中位红细胞平均体积(MCV)90.2(52.3~139.3)fl。所有患者均有血细胞减少,其中86%(43/50)表现为贫血,54%(27/50)、52%(26/50)分别表现为血小板减少、中性粒细胞减少。外周血一系减少16例,两系减少22例,三系减少12例。
中位骨髓原始细胞比例为0.040(0~0.170)。47例存在粒系病态造血,主要表现为Pelger-hüet畸形、分叶核分叶过多,巨幼样变;34例存在红系病态造血,主要表现为巨幼样变、双核、花瓣核、母子核;36例存在巨核系病态造血,表现为核形异常,包括多圆核、单圆核、双核、核分叶不能、变型小巨核。
FISH结果显示,本组21例为大克隆,29例为小克隆。综合R显带染色体核型分析资料,33例(66%)为单一del(5q),17例(34%)为del(5q)伴其他染色体异常,其中1例为复杂核型。其他染色体异常包括7q-(4例)、20q-(3例)、+8/-8(3例)和17p-(1例)。预后不良核型5例,其中4例伴7号染色体异常,1例为复杂核型。单一del(5q)及del(5q)伴其他染色体异常患者的临床特征见表1,del(5q)伴其他染色体异常患者相对高危组多见(P=0.003)。
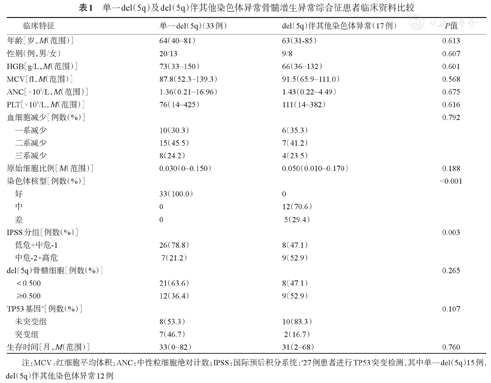
单一del(5q)及del(5q)伴其他染色体异常骨髓增生异常综合征患者临床资料比较
单一del(5q)及del(5q)伴其他染色体异常骨髓增生异常综合征患者临床资料比较
| 临床特征 | 单一del(5q)(33例) | del(5q)伴其他染色体异常(17例) | P值 | |
|---|---|---|---|---|
| 年龄[岁,M(范围)] | 64(40~81) | 63(31-85) | 0.613 | |
| 性别(例,男/女) | 20/13 | 9/8 | 0.607 | |
| HGB[g/L,M(范围)] | 73(33~150) | 66(36~132) | 0.601 | |
| MCV[ fl ,M(范围)] | 87.8(52.3~139.3) | 91.5(65.9~111.0) | 0.568 | |
| ANC[×109/L,M(范围)] | 1.36(0.21~16.96) | 1.43(0.22~4.49) | 0.675 | |
| PLT[×109/L,M(范围)] | 76(14~425) | 111(14~382) | 0.616 | |
| 血细胞减少[例数(%)] | 0.792 | |||
| 一系减少 | 10(30.3) | 6(35.3) | ||
| 二系减少 | 15(45.5) | 7(41.2) | ||
| 三系减少 | 8(24.2) | 4(23.5) | ||
| 原始细胞比例[M(范围)] | 0.030(0~0.150) | 0.050(0.010~0.170) | 0.188 | |
| 染色体核型[例数(%)] | <0.001 | |||
| 好 | 33(100.0) | 0 | ||
| 中 | 0 | 12(70.6) | ||
| 差 | 0 | 5(29.4) | ||
| IPSS分组[例数(%)] | 0.003 | |||
| 低危+中危-1 | 26(78.8) | 8(47.1) | ||
| 中危-2+高危 | 7(21.2) | 9(52.9) | ||
| del(5q)骨髓细胞[例数(%)] | 0.265 | |||
| <0.500 | 21(63.6) | 8(47.1) | ||
| ≥0.500 | 12(36.4) | 9(52.9) | ||
| TP53基因a[例数(%)] | 0.107 | |||
| 未突变组 | 8(53.3) | 10(83.3) | ||
| 突变组 | 7(46.7) | 2(16.7) | ||
| 生存时间[月,M(范围)] | 33(0~82) | 31(2~68) | 0.760 | |
注:MCV:红细胞平均体积;ANC:中性粒细胞绝对计数;IPSS:国际预后积分系统;a27例患者进行TP53突变检测,其中单一del(5q)15例,del(5q)伴其他染色体异常12例
27例患者进行TP53突变检测,9例(33%)存在TP53编码区突变,其中4例同时存在两个编码区突变。9例伴del(5q)及TP53突变患者临床及实验室特征见表2。
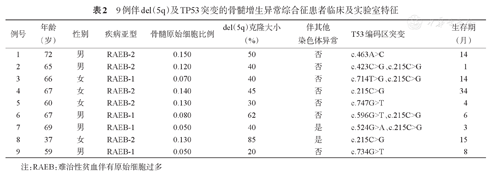
9例伴del(5q)及TP53突变的骨髓增生异常综合征患者临床及实验室特征
9例伴del(5q)及TP53突变的骨髓增生异常综合征患者临床及实验室特征
| 例号 | 年龄(岁) | 性别 | 疾病亚型 | 骨髓原始细胞比例 | del(5q)克隆大小(%) | 伴其他染色体异常 | T53编码区突变 | 生存期(月) |
|---|---|---|---|---|---|---|---|---|
| 1 | 72 | 男 | RAEB-2 | 0.150 | 50 | 否 | c.463A>C | 14 |
| 2 | 65 | 男 | RAEB-2 | 0.120 | 40 | 否 | c.423C>G、c.215C>G | 1 |
| 3 | 66 | 女 | RAEB-1 | 0.070 | 40 | 否 | c.714T>G、c.215C>G | 14 |
| 4 | 67 | 女 | RAEB-2 | 0.140 | 45 | 否 | c.215C>G | 34 |
| 5 | 60 | 女 | RAEB-2 | 0.130 | 30 | 否 | c.747G>T | 4 |
| 6 | 67 | 男 | RAEB-1 | 0.080 | 62 | 否 | c.596G>T、c.215C>G | 6 |
| 7 | 69 | 男 | RAEB-1 | 0.050 | 40 | 是 | c.524G>A、c.215C>G | 3 |
| 8 | 37 | 女 | RAEB-2 | 0.130 | 85 | 是 | c.215C>G | 15 |
| 9 | 59 | 男 | RAEB-1 | 0.050 | 20 | 否 | c.734G>T | 8 |
注:RAEB:难治性贫血伴有原始细胞过多
中位随访时间为28.5个月,50例del(5q)MDS患者平均生存期为31.0(95%CI 4.8~57.2)个月,2年生存率为53.3%。4例(7.7%)患者进展为急性髓系白血病(AML)。本组29例患者死亡,死亡原因包括:感染(9例)、出血(5例)、心脑血管事件(4例)、AML(4例)或其他肿瘤(1例),8例死亡原因不详。
分析影响生存的相关因素,单因素分析见表3,年龄≤60岁、HGB≥80 g/L、非复杂核型和骨髓原始细胞<0.050为del(5q)MDS的预后良好因素。将其纳入多因素分析,结果显示HGB≥80 g/L[(P=0.012,HR=0.28(95%CI 0.11~0.76)]和骨髓原始细胞<0.050[P=0.004,HR=3.32(95% CI 1.48~7.44]为del(5q)MDS良好预后的独立影响因素。
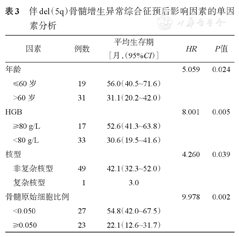
伴del(5q)骨髓增生异常综合征预后影响因素的单因素分析
伴del(5q)骨髓增生异常综合征预后影响因素的单因素分析
| 因素 | 例数 | 平均生存期[月,(95%CI)] | HR | P值 | |
|---|---|---|---|---|---|
| 年龄 | 5.059 | 0.024 | |||
| ≤60岁 | 19 | 56.0(40.5~71.6) | |||
| >60岁 | 31 | 31.1(20.2~42.0) | |||
| HGB | 8.001 | 0.005 | |||
| ≥80 g/L | 17 | 52.6(41.3~63.8) | |||
| <80 g/L | 33 | 30.6(19.5~41.6) | |||
| 核型 | 4.260 | 0.039 | |||
| 非复杂核型 | 49 | 42.1(32.3~52.0) | |||
| 复杂核型 | 1 | 3.0 | |||
| 骨髓原始细胞比例 | 9.978 | 0.002 | |||
| <0.050 | 27 | 54.8(42.0~67.5) | |||
| ≥0.050 | 23 | 22.1(12.6~31.7) | |||
1975年,van den Berghe等[7]首次提出MDS分型中的一个独立亚型,即5q-综合征。单纯5号染色体长臂部分缺失为其遗传学特征,好发于中年女性,伴有顽固性巨幼细胞性贫血、PLT正常或增加、分叶巨核细胞减少及骨髓原始细胞数<0.050等特点,预后好,转白率低(10%)。基于此标准,Haferlach等[3]报道5q-综合征仅占10%。本组患者MDS伴有单纯del(5q)占8%,与上述研究结果相近。Pedersen等[8]发现,伴del(5)(q13q31)的MDS患者生存期明显长于其他类型del(5q)MDS患者,提示单一del(5q)MDS缺失位点与预后有关。实验证明,del(5q)有两个共同缺失区:其中一个为近端5q31.1-q31.2,与高危组MDS及AML有关,但也有文献报道部分恶性髓系血液病未发现5q31区域缺失[9];另一个为末端5q32-5q33,与5q-综合征的发病机制有着密切关系;然而95%以上del(5q)MDS患者表现为大片段缺失,包含两个共同缺失区及该染色体的其他片段[10]。伴del(5q)MDS预后与我们前期报道的伴del(20q)MDS患者相近[11],表明细胞遗传学del(5q)与del(20q)对MDS预后影响相当。
在白血病前期,del(5q)大多以单一的形式出现,然而在白血病期时,则往往伴其他染色体异常[12]。据此,多数学者认为del(5q)可能是髓系祖细胞中一种早期和初步的细胞遗传学改变,导致基因不稳定性及易发生基因重排;后期随着受损基因增多,疾病进展加快[10]。本组del(5q)克隆大小与预后无关,但小克隆组伴其他染色体异常的发生率为27.6%,低于大克隆组(42.9%),且其生存时间相对较长。据此,我们推测del(5q)大克隆组大多伴其他染色体异常,代表基因不稳定性,预后相对较差。但del(5q)克隆大小与异常核型及del(5q)MDS预后的关系尚待进一步研究。
TP53基因一直以来都是生物学研究的热点,通过诱导DNA损伤修复、细胞周期抑制、细胞衰老和细胞凋亡等生物效应而发挥抑制肿瘤的作用,因而也被称为"基因守护者" 。当TP53发生突变后,失去野生型TP53具有的肿瘤抑制功能,将导致肿瘤的产生。众多的临床证据显示,50%以上的肿瘤患者存在TP53突变,且此类患者治疗效果极差,该结论同样适用del(5q)MDS患者[13,14]。TP53突变的形式多种多样,79%患者为核苷酸G∶C碱基对替代,且大部分为错义突变[15]。统计分析证实TP53突变的位点主要集中在4个突变热点的错义突变,分别是aa129-146、171-179、234-260、270-287(以175、245、248、249、273、282位点突变频率最高),正对应于TP53基因进化最保守区段[16]。本组9例TP53突变患者中,最常见的突变为c.215C>G(6/9,66.7%),与文献报道略有差异。TP53基因已被检测至超过200个单核苷酸多态性位点,其中研究最多且与肿瘤关系最为密切的位点即TP53基因4号外显子的第72位密码子。该位点处于编码多聚脯氨酸结构域的片段,具有CGT/CCT的单核苷酸多态性,其编码的氨基酸分别为脯氨酸(Pro72P)和精氨酸(Arg72R)。研究发现,该位点多态性可引起TP53通路中的p53蛋白肿瘤抑制功能改变,导致癌症的发生,且该多态性位点与多种癌症预后具有相关性,如宫颈癌、肝癌等[17,18]。但至今尚未有文献报道该多态性位点与MDS预后的关系,值得今后进一步观察。
贫血是MDS最常见的血细胞减少,其严重程度与患者预后密切相关[19]。本组病例中,HGB≥80 g/L是del(5q)MDS预后良好的独立影响因素。目前已知患者贫血与TP53基因突变相关,TP53表达升高促进其下游靶基因的表达,导致细胞周期停滞及细胞凋亡,引起早期无效造血,产生贫血。如果TP53表达正常,则患者达到输血依赖的时间相对延长,预后较好。同时发现对来那度胺有效的患者,其红系祖细胞中的P53水平下降[20]。
此外,关于IPSS积分与del(5q)MDS预后的关系,本研究结果与Giagounidis等[21]报道一致,IPSS积分不是影响del(5q)MDS预后的独立因素,提示IPSS并不能精确地评估del(5q)MDS预后。因而制订一个精准的MDS预后评分系统是有必要的。del(5q)MDS是一组异质性疾病,需深入了解del(5q)MDS预后的相关因素,以便对del(5q)MDS进行预后分层,指导临床医师制订合理的个体化治疗方案。


























