
调查高原地区阻塞性睡眠呼吸暂停综合征(OSAS)患者初次给予持续气道正压通气(CPAP)后治疗相关的中枢性睡眠呼吸暂停(TE-CSA)的发生率,并分析其人群特征和影响因素。
回顾分析2015年1—12月来自高原地区(海拔≥1 000 m)并在云南省第一人民医院睡眠医学中心诊断为OSAS的297例成年患者的临床资料,患者均进行了整夜CPAP治疗。根据治疗后是否发生TE-CSA将患者分为TE-CSA组和非TE-CSA组,比较两组的一般资料、居住地海拔、多导睡眠监测及压力滴定参数、肺功能、血气分析等临床数据并进行统计学分析。
高原地区OSAS患者初次压力滴定时TE-CSA的发生率为16.5%(49/297)。其中男性发生率高于女性(18.2%比6.8%,P=0.061);随着年龄、体质指数(BMI)增加和居住地海拔下降,发生率呈下降趋势。多因素Logistic回归分析显示,居住地海拔高度、混合性呼吸暂停指数(MAI)、第一秒用力呼气容积(FEV1)/用力肺活量(FVC)比值、肺残气量(RV)/肺总量(TLC)比值是影响TE-CSA发生的主要因素,其中居住地海拔高度、MAI增加是危险因素[OR=1.16(1.02,1.32)、1.05(1.01,1.09)];FEV1/FVC、RV/TLC升高则是保护因素[OR=0.94(0.89,0.98)、0.94(0.88,0.99)]。
高原地区TE-CSA的发生率较高,居住地海拔和MAI增高是其发生的危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
持续气道正压通气(CPAP)是治疗中重度阻塞性睡眠呼吸暂停综合征(OSAS)的首选方法[1]。但在临床治疗过程中,有一部分原先诊断为OSAS的患者,当阻塞性呼吸事件基本清除后会出现以中枢性睡眠呼吸暂停(CSA)或陈-施呼吸(CSR)为主的呼吸紊乱。在2014年更新的第三版国际睡眠疾病分类(ICSD-3)[2]中将此现象定义为治疗相关的CSA(TE-CSA),即在通过CPAP治疗基本消除阻塞性呼吸事件的同时,残余的CSA指数(CAI)≥5次/h或以CSR为主。其发生的机制目前认为主要与患者先天性或获得性的呼吸控制高环路增益以及动脉血二氧化碳平衡失调有关[3,4]。在高环路增益存在的情况下,当通气量变化引起动脉血二氧化碳含量波动时,可导致继发的通气反应过大且不稳定,从而引起CSA或渐增-渐减的CSR。
TE-CSA的存在使部分OSAS患者CPAP治疗的效果及依从性受到很大影响,但其发生率尚不确定,国外文献报道存在较大差异,从0.56%~19.8%不等[5,6]。我国在这一领域的报道很少,韦璇等[7]曾报道成都平原地区TE-CSA的发生率为7.9%,但高原地区的发生率是否有差异尚不清楚。高原通常是指海拔高度在1 000 m以上的广阔地区,海拔的增加可能会影响到TE-CSA的发生,此外还有哪些因素会影响其发生也有待研究。本研究回顾性分析云南高原地区OSAS患者在初次CPAP压力滴定时TE-CSA的发生率及人群分布特点,并探讨影响其发生的主要因素。
以2015年1—12月在云南省第一人民医院睡眠医学中心诊断为OSAS的患者为研究对象。纳入标准为:(1)成年人;(2)来自高原地区(海拔≥1 000 m);(3)符合OSAS的诊断标准并接受了整夜CPAP压力滴定治疗。排除标准为:(1)年龄<18岁;(2)合并脑血管意外、心衰、肾功能不全;(3)服用镇静安眠药或吗啡类制剂、吸毒;(4)总睡眠时间或压力滴定时间<4 h;(5)PSG数据不完整。共有297例符合条件的患者纳入研究,其中男253例、女44例;年龄19~77岁,平均(46.3±12.2)岁。
收集每位受试者的年龄、性别、身高、体质量、居住地海拔高度等一般资料,计算体质指数(BMI)。所有受试者均于压力滴定前进行肺功能和血气分析检查,并收集相应数据。
初始诊断时采用便携式多导睡眠监测仪(ApneaLink™ Plus,澳大利亚瑞思迈公司)监测受试者鼻气流、呼吸努力、鼾声、脉率、指端经皮血氧饱和度(SaO2)等指标,根据2012年美国睡眠医学会制定的《睡眠及其相关事件判读手册》[8]进行呼吸事件的判读,并计算出相应指数(各指数均为每小时出现相应呼吸事件的次数,单位为次/h)。
CPAP压力滴定采用多导睡眠图(PSG)监测仪(Alice5,美国飞利浦伟康公司)监测受试者脑电、眼电、下颌肌电、心电、SaO2、鼾声、口鼻气流、胸腹呼吸努力、胫骨前肌肌电等指标,并采用CPAP呼吸机(System one REMstar Auto CPAP,美国飞利浦伟康公司)进行压力滴定。具体方法:滴定前对患者进行健康教育,让患者试戴面罩,保持面罩舒适不漏气。滴定以4 cmH2O(1 cmH2O=0.098 kPa)的压力起始,随滴定进程压力逐渐升高,当阻塞性呼吸事件完全消除而出现了CSA或CSR,经增加压力后CSA不能消除或出现更多,即以此压力为滴定压力。滴定结束后根据2012年美国睡眠医学会制定的《睡眠及其相关事件判读手册》[8]进行睡眠分期和呼吸事件判读,记录相应参数。
初始诊断为OSAS的患者,在经CPAP滴定后,基本消除阻塞性睡眠呼吸暂停的同时,残余的CAI≥5次/h或以CSR为主,且CSA占所有呼吸事件的比例超过50%。
根据压力滴定的结果(治疗后是否发生TE-CSA),将患者分为TE-CSA组和非TE-CSA组。
采用SPSS 13.0软件包进行统计分析。正态分布的连续变量以 ±s表示,采用独立样本t检验;非正态分布者以M(Q1,Q3)表示,采用Mann-Whitney检验;频数以百分比(%)表示,采用χ2检验。多因素分析方法使用二分类Logistic回归,根据Wald统计量向后逐步剔除非统计学显著性自变量。以P<0.05为差异有统计学意义。
±s表示,采用独立样本t检验;非正态分布者以M(Q1,Q3)表示,采用Mann-Whitney检验;频数以百分比(%)表示,采用χ2检验。多因素分析方法使用二分类Logistic回归,根据Wald统计量向后逐步剔除非统计学显著性自变量。以P<0.05为差异有统计学意义。
297例患者中,TE-CSA组49例,TE-CSA发生率为16.5%(49/297)。两组患者在不同性别、年龄、BMI、呼吸暂停低通气指数(AHI)及居住地海拔高度上TE-CSA发生率的比较见表1。其中男性的发生率高于女性(18.2%比6.8%,P=0.061);随着患者年龄、BMI增加和居住地海拔降低,TE-CSA的发生率呈下降趋势,但差异均无统计学意义(均P>0.05);AHI值越高时OSAS的病情越严重,但并非OSAS病情越严重TE-CSA的发生率越高,AHI为40~<80次/h时发生率反而显著高于AHI<40次/h或AHI≥80次/h者(均P<0.01)。
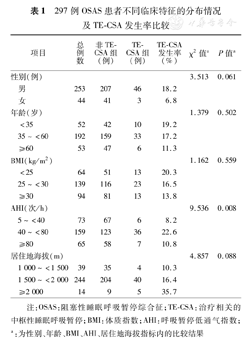
297例OSAS患者不同临床特征的分布情况及TE-CSA发生率比较
297例OSAS患者不同临床特征的分布情况及TE-CSA发生率比较
| 项目 | 总例数 | 非TE- CSA组(例) | TE- CSA组(例) | TE-CSA发生率(%) | χ2值a | P值a | |
|---|---|---|---|---|---|---|---|
| 性别(例) | 3.513 | 0.061 | |||||
| 男 | 253 | 207 | 46 | 18.2 | |||
| 女 | 44 | 41 | 3 | 6.8 | |||
| 年龄(岁) | 1.379 | 0.502 | |||||
| <35 | 52 | 42 | 10 | 19.2 | |||
| 35~<60 | 192 | 159 | 33 | 17.2 | |||
| ≥60 | 53 | 47 | 6 | 11.3 | |||
| BMI(kg/m2) | 1.162 | 0.559 | |||||
| <25 | 64 | 51 | 13 | 20.3 | |||
| 25~<30 | 139 | 116 | 23 | 16.5 | |||
| ≥30 | 94 | 81 | 13 | 13.8 | |||
| AHI(次/h) | 9.536 | 0.008 | |||||
| 5~<40 | 73 | 67 | 6 | 8.2 | |||
| 40~<80 | 159 | 123 | 36 | 22.6 | |||
| ≥80 | 65 | 58 | 7 | 10.8 | |||
| 居住地海拔(m) | 4.857 | 0.088 | |||||
| 1 000~<1 500 | 39 | 35 | 4 | 10.3 | |||
| 1 500~<2 000 | 244 | 204 | 40 | 16.4 | |||
| ≥2 000 | 14 | 9 | 5 | 35.7 | |||
注:OSAS:阻塞性睡眠呼吸暂停综合征;TE-CSA:治疗相关的中枢性睡眠呼吸暂停;BMI:体质指数;AHI:呼吸暂停低通气指数;a:为性别、年龄、BMI、AHI、居住地海拔指标内的比较结果
两组间年龄、BMI差异无统计学意义,但TE-CSA组患者居住地平均海拔、CAI和混合性呼吸暂停指数(MAI)高于非TE-CSA组,肺残气量/肺总量比值则低于非TE-CSA组,差异有统计学意义(P<0.005)。两组的血气分析指标差异均无统计学意义(均P>0.05)(表2)。
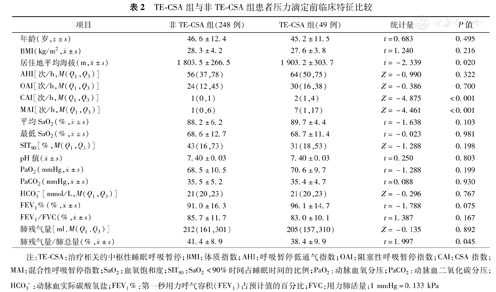
TE-CSA组与非TE-CSA组患者压力滴定前临床特征比较
TE-CSA组与非TE-CSA组患者压力滴定前临床特征比较
| 项目 | 非TE-CSA组(248例) | TE-CSA组(49例) | 统计量 | P值 |
|---|---|---|---|---|
年龄(岁, ±s) ±s) | 46.6±12.4 | 45.2±11.5 | t=0.683 | 0.495 |
BMI(kg/m2, ±s) ±s) | 28.3±4.2 | 27.6±3.8 | t=1.240 | 0.216 |
居住地平均海拔(m, ±s) ±s) | 1 803.5±266.5 | 1 903.2±303.7 | t=-2.339 | 0.020 |
| AHI[次/h,M(Q1,Q3)] | 56(37,78) | 64(50,75) | Z=-0.990 | 0.322 |
| OAI[次/h,M(Q1,Q3)] | 24(12,45) | 30(16,38) | Z=-0.386 | 0.700 |
| CAI[次/h,M(Q1,Q3)] | 1(0,1) | 2(1,4) | Z=-4.875 | <0.001 |
| MAI[次/h,M(Q1,Q3)] | 1(0,6) | 7(1,17) | Z=-4.461 | <0.001 |
平均SaO2(%, ±s) ±s) | 88.2±6.2 | 89.7±4.4 | t=-1.638 | 0.103 |
最低SaO2(%, ±s) ±s) | 68.6±12.7 | 68.7±11.4 | t=-0.023 | 0.981 |
| SIT90[%,M(Q1,Q3)] | 43(16,73) | 31(18,53) | Z=-1.288 | 0.198 |
pH值( ±s) ±s) | 7.40±0.03 | 7.40±0.03 | t=0.250 | 0.803 |
PaO2(mmHg, ±s) ±s) | 68.5±10.5 | 70.6±9.7 | t=-1.288 | 0.199 |
PaCO2(mmHg, ±s) ±s) | 35.5±5.2 | 35.4±4.7 | t=0.088 | 0.930 |
| HCO3-[mmol/L,M(Q1,Q3)] | 21(20,23) | 21(20,23) | Z=-0.296 | 0.767 |
FEV1%(%, ±s) ±s) | 91.0±16.3 | 96.1±14.7 | t=-1.788 | 0.075 |
FEV1/FVC(%, ±s) ±s) | 85.7±11.7 | 83.0±10.1 | t=1.387 | 0.167 |
| 肺残气量[ml,M(Q1,Q3)] | 212(161,301) | 205(157,310) | Z=-0.135 | 0.892 |
肺残气量/肺总量(%, ±s) ±s) | 41.4±8.9 | 38.4±9.9 | t=1.997 | 0.045 |
注:TE-CSA:治疗相关的中枢性睡眠呼吸暂停;BMI:体质指数;AHI:呼吸暂停低通气指数;OAI:阻塞性呼吸暂停指数;CAI:CSA指数;MAI:混合性呼吸暂停指数;SaO2:血氧饱和度;SIT90:SaO2<90%时间占睡眠时间的比例;PaO2:动脉血氧分压;PaCO2:动脉血二氧化碳分压;HCO3-:动脉血实际碳酸氢盐;FEV1%:第一秒用力呼气容积(FEV1)占预计值的百分比;FVC:用力肺活量;1 mmHg=0.133 kPa
进行压力滴定后,两组残留的阻塞性呼吸暂停指数(OAI)差异无统计学意义,但TE-CSA组残余的AHI和CAI显著高于非TE-CSA组(P<0.01),同时最低SaO2更低,SaO2<90%时间占睡眠时间的比例(SIT90)更长。在睡眠结构方面,TE-CSA组睡眠效率、快眼动(REM)期睡眠比例和非快眼动(NREM)3期睡眠比例降低(P<0.05),而NREM 1期睡眠比例和觉醒指数增加(P<0.01)。两组所用的CPAP滴定压力差异无统计学意义(P>0.05)(表3)。
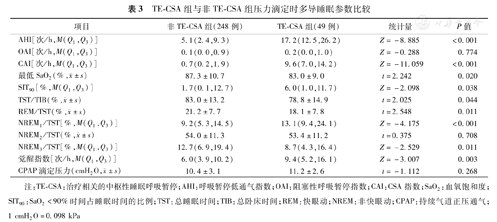
TE-CSA组与非TE-CSA组压力滴定时多导睡眠参数比较
TE-CSA组与非TE-CSA组压力滴定时多导睡眠参数比较
| 项目 | 非TE-CSA组(248例) | TE-CSA组(49例) | 统计量 | P值 |
|---|---|---|---|---|
| AHI[次/h,M(Q1,Q3)] | 5.1(2.4,9.3) | 17.2(12.5,26.2) | Z=-8.885 | <0.001 |
| OAI[次/h,M(Q1,Q3)] | 0.1(0.0,0.9) | 0.2(0.0,1.0) | Z=-0.288 | 0.774 |
| CAI[次/h,M(Q1,Q3)] | 0.7(0.2,1.9) | 9.6(7.0,14.2) | Z=-11.059 | <0.001 |
最低SaO2(%, ±s) ±s) | 87.3±10.7 | 83.0±9.0 | t=2.242 | 0.020 |
| SIT90[%,M(Q1,Q3)] | 1.7(0.1,12.7) | 6.0(1.0,11.7) | Z=-2.098 | 0.038 |
TST/TIB(%, ±s) ±s) | 83.0±13.2 | 78.8±14.9 | t=2.025 | 0.044 |
REM/TST(%, ±s) ±s) | 21.2±7.7 | 18.1±7.8 | t=2.548 | 0.011 |
| NREM1/TST[%,M(Q1,Q3)] | 9.2(5.3,14.5) | 13.1(9.4,24.1) | Z=-4.175 | <0.001 |
NREM2/TST(%, ±s) ±s) | 54.0±11.3 | 53.4±11.2 | t=0.375 | 0.708 |
| NREM3/TST[%,M(Q1,Q3)] | 12.7(6.9,19.4) | 8.7(4.3,16.4) | Z=-2.529 | 0.011 |
| 觉醒指数[次/h,M(Q1,Q3)] | 6.0(3.9,10.2) | 9.4(5.2,16.1) | Z=-3.007 | 0.003 |
CPAP滴定压力(cmH2O, ±s) ±s) | 10.4±3.1 | 11.2±2.6 | t=-1.112 | 0.268 |
注:TE-CSA:治疗相关的中枢性睡眠呼吸暂停;AHI:呼吸暂停低通气指数;OAI:阻塞性呼吸暂停指数;CAI:CSA指数;SaO2:血氧饱和度;SIT90:SaO2<90%时间占睡眠时间的比例;TST:总睡眠时间;TIB:总卧床时间;REM:快眼动;NREM:非快眼动;CPAP:持续气道正压通气;1 cmH2O=0.098 kPa
对高原地区影响TE-CSA发生的因素进行Logistic回归分析,包括患者性别、年龄、BMI、居住地海拔高度、诊断时睡眠呼吸监测参数、血气分析指标、肺功能检测指标等共31个变量被纳入到初始方程中,经方程精化后,居住地海拔高度、诊断时的MAI、第一秒用力呼气容积(FEV1)/用力肺活量(FVC)比值、肺残气量/肺总量构成了最终回归方程。其中海拔高度增加及诊断时MAI增加均为引起TE-CSA发生的危险因素,而FEV1/FVC及肺残气量/肺总量升高则是避免TE-CSA发生的保护因素(表4)。
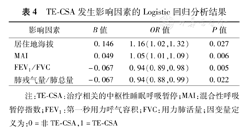
TE-CSA发生影响因素的Logistic回归分析结果
TE-CSA发生影响因素的Logistic回归分析结果
| 影响因素 | B值 | OR值 | P值 |
|---|---|---|---|
| 居住地海拔 | 0.146 | 1.16(1.02,1.32) | 0.027 |
| MAI | 0.049 | 1.05(1.01,1.09) | 0.006 |
| FEV1/FVC | -0.067 | 0.94(0.89,0.98) | 0.005 |
| 肺残气量/肺总量 | -0.067 | 0.94(0.88,0.99) | 0.022 |
注:TE-CSA:治疗相关的中枢性睡眠呼吸暂停;MAI:混合性呼吸暂停指数;FEV1:第一秒用力呼气容积;FVC:用力肺活量;因变量定义为:0=非TE-CSA,1=TE-CSA
尽管TE-CSA作为一种常见临床现象在ICSD-3[2]中已经被单独列出,但其发生率到底有多高、影响其发生的因素有哪些等问题尚未完全明了。本研究回顾性分析297例初次进行CPAP压力滴定的OSAS患者后发现,在高原地区(海拔≥1 000 m)TE-CSA的发生率为16.5%,高于平原地区(成都,海拔500 m)7.9%的发生率[7]。当发生TE-CSA时,会残余更多的呼吸事件(以CSA为主)和觉醒事件,导致睡眠中缺氧程度和缺氧时间增加、睡眠效率降低、睡眠质量下降(浅睡眠增多深睡眠减少、频繁觉醒与睡眠转换),这可能就是该类患者治疗后仍然有白天过度嗜睡和心血管疾病风险增加的原因[9]。
有学者认为发生TE-CSA的患者年龄和BMI比单纯OSAS患者要小[10],但此前的研究并未报道不同年龄和不同BMI值对发生TE-CSA的影响。本研究结果显示,年龄和BMI较小的OSAS患者具有更容易发生TE-CSA的趋势,尽管差异无统计学意义。同时男性比女性更容易发生TE-CSA,这与之前的研究结果类似[11],原因可能与男性浅睡眠比例较女性更高、男性OSAS发生率较女性高从而纳入研究样本男性更多等因素有关。本研究结果还显示,并非AHI越高越容易发生TE-CSA,AHI在40~<80次/h的OSAS患者TE-CSA的发生率最高。这可能是因为AHI<40次/h的OSAS患者病情相对较轻,其呼吸中枢调节功能损害和睡眠紊乱的程度也较轻,在CPAP压力滴定引起二氧化碳变化时能够进行有效调节而维持正常;而AHI≥80次/h的OSAS患者由于病情更严重,其呼吸中枢调节功能受损严重甚至合并有一定程度的二氧化碳升高,于是对CPAP压力滴定引起的二氧化碳变化不敏感或反应钝化,所以反而不容易发生TE-CSA。
对比TE-CSA组和非TE-CSA组患者初始诊断时的基线资料发现,两组在居住地海拔高度、CAI、MAI、肺残气量/肺总量方面差异显著。TE-CSA组患者更多来自于海拔≥1 500 m的地区(平均1 869.5 m),初始诊断时有更高的CAI和MAI以及更低的肺残气量/肺总量,FEV1/FVC也低于非TE-CSA组。进一步Logistic回归分析显示,居住地海拔高度、MAI、FEV1/FVC、肺残气量/肺总量是影响TE-CSA发生率的最主要因素,其中海拔高度和MAI增加是危险因素,而FEV1/FVC及肺残气量/肺总量升高则是保护因素。推测这可能与患者久居高海拔地区后呼吸驱动功能增强、上气道张力增加,在CPAP压力滴定时更易引起二氧化碳过低和呼吸控制不稳定,尤其对于原本MAI就较高的患者,更易诱发TE-CSA。这可能就是云南高原地区TE-CSA发生率高于成都地区的原因,因为前者来自于高海拔地区的患者更多。中国幅员辽阔,这一结果提示评估TE-CSA发生率时应当考虑到环境因素的影响。此外,FEV1/FVC较高意味着患者平时气道的开放程度较高,肺残气量/肺总量较高则意味着对二氧化碳的变化有更好的缓冲能力,因此对于CPAP压力滴定时通气量增加、二氧化碳降低具有更好的适应性,起到减少TE-CSA发生的保护作用。
综上所述,本研究显示,男性、年龄和BMI较低、AHI在40~<80次/h的患者更易发生TE-CSA;患者居住地区的海拔越高、诊断时MAI越高,则发生TE-CSA的危险性越高,而FEV1/FVC和肺残气量/肺总量越高则发生TE-CSA的危险性越低。TE-CSA的发生将会影响CPAP对OSAS患者的治疗效果,带来相应的临床症状和心血管疾病风险,因此,应重视和及早识别TE-CSA。
由于本研究只是回顾性分析,尚不能指导临床治疗方案的选择。应进一步开展前瞻性研究找寻有效易行的治疗方法,以减少TE-CSA的发生。



























