
探讨多重基因异常在弥漫大B细胞淋巴瘤(DLBCL)中的发生情况及其与蛋白高表达之间的关系。
收集2012年1月至2016年12月确诊的DLBCL非特指型患者50例,采用免疫组织化学法检测c-myc、bcl-2及bcl-6蛋白表达情况,采用间期荧光原位杂交(I-FISH)方法检测3个基因异常情况。
50例DLBCL患者中,男性27例,女性23例;年龄3~85岁,中位年龄50岁。发病部位:淋巴结23例(46.00%),结外27例(54.00%),以胃肠道最为多见(13例,48.15%)。免疫组织化学检测c-myc蛋白阳性率94.00%(47/50),阳性细胞超过40%者41例(82.00%);bcl-2蛋白阳性率84.00%(42/50),阳性细胞超过70%者38例(76.00%);18例(36.00%)同时高表达c-myc和bcl-2。FISH检测结果显示,7例(14.00%)c-myc断裂,2例(4.00%)扩增;6例(12.00%)bcl-2断裂,4例(8.00%)扩增;8例(16.00%)bcl-6断裂,3例(6.00%)扩增,1例(2.00%)同时断裂及扩增;4例(8.00%)检测到多重基因异常,其中1例(2.00%)c-myc合并bcl-2基因异常,2例(4.00%)c-myc合并bcl-6基因异常,为双重打击淋巴瘤(DHL),1例(2.00%)同时检测到c-myc、bcl-2及bcl-6基因异常,为三重打击淋巴瘤(THL)。4例多重基因异常病例中,3例起源于生发中心B细胞(GCB),1例起源于非GCB。18例c-myc和bcl-2蛋白双高表达组仅有3例(16.67%)检测到多重基因异常,包括2例DHL和1例THL。
多重基因异常在DLBCL中的检出率为8.00%。基因异常与蛋白高表达之间无明显相关性,DHL的检出依赖于分子遗传学检测。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是大的肿瘤性B淋巴细胞弥漫性生长,细胞不小于正常淋巴细胞的2倍,肿瘤细胞的核与正常组织细胞的核相近或大于组织细胞的核。DLBCL是发病最多的非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL),西方国家占30%~40%[1],在发展中国家更高,我国发病率达50%以上。DLBCL侵袭性高,预后较差,治疗多采用联合化疗或结合靶向药物的联合化疗。近年来大量基因及蛋白表达的研究证实多基因异常是DLBCL预后不良的因素,一些蛋白标记物在肿瘤的发展中起着关键作用,也可作为DLBCL独立的预后因素。双重打击淋巴瘤(DHL)、三重打击淋巴瘤(THL)是近年的研究热点。DHL是指myc基因断裂同时伴其他重现性染色体异常的淋巴瘤,以bcl-2和bcl-6基因最为常见。DHL约占B细胞恶性肿瘤的2%,占DLBCL的0~12%。DHL是一类侵袭性疾病,预后极差,平均生存期为0.5~1.5年[2,3,4,5,6]。在2016版世界卫生组织(WHO)淋巴肿瘤修订分类中DHL被作为一个独立的分类,即指伴myc及bcl-2和(或)bcl-6重排的高度侵袭性B细胞淋巴瘤。近年又有学者提出"双表达淋巴瘤(double-expression lymphoma,DEL)" ,即myc和bcl-2蛋白过表达,并提出双重打击指数(double-hit score,DHS)的概念[7,8],认为对DHL具有一定提示作用。但目前国内尚鲜见关于DHL的大宗报道。本研究初步探究双重打击DLBCL中DEL与DHL检测的相关性。
收集2012年1月至2016年12月大同市第三人民医院和北京大学医学部基础医学院病理学系血液病理研究室确诊的、有研究价值的DLBCL患者50例,所有病例均符合2008版WHO分类DLBCL非特指型的诊断标准。包括男性27例,女性23例,男女比例1.17∶1;患者年龄3~85岁,中位年龄50岁。发病部位:淋巴结内23例(46.00%),淋巴结外27例(54.00%),以胃肠道最为多见(13例,48.15%)。
鼠源抗bcl-2单抗和兔源抗c-myc多抗均为丹麦Dako公司产品;二抗采用Dako公司兔/鼠通用试剂。
对全部病例的病理组织石蜡切片进行免疫组织化学染色,采用EnVision二步法检测肿瘤细胞c-myc、bcl-2和bcl-6的表达情况,阳性率以阳性细胞占肿瘤细胞百分比表示,c-myc阳性率≥40%为高表达,bcl-2阳性率≥70%为高表达。
根据HE染色,选择肿瘤细胞丰富区域作为杂交区域;所用探针及DAPI对比染色剂均购自美国Vysis公司,包括bcl-2双色分离重排探针(QP-30-231029)、bcl-6双色分离重排探针(QP-32-191016)、c-myc双色分离重排探针(QP-30-191096)。
50例患者均经免疫组织化学法检测了c-myc、bcl-2及bcl-6蛋白。c-myc、bcl-2高表达病理图片见图1A、图1B,bcl-6阳性部位亦为细胞核(图1C)。c-myc蛋白阳性率94.00%(47/50),其中41例(82.00%)阳性细胞≥40%;bcl-2蛋白阳性率84.00%(42/50),其中38例(76.00%)阳性细胞≥70%;18例(36.00%)同时高表达c-myc和bcl-2蛋白。
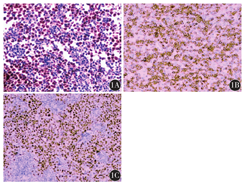

1A:c-myc细胞核阳性;1B:bcl-2细胞质阳性;1C:bcl-6细胞核阳性
50例DLBCL患者均进行了I-FISH检测。c-myc、bcl-2、bcl-6基因异常情况见表1,c-myc、bcl-2分离探针检测阳性见图2。4例(8.00%)检测到多重基因异常,其中1例(2.00%)c-myc合并bcl-2基因异常,2例(4.00%)c-myc合并bcl-6基因异常,为DHL;1例(2.00%)同时检测到c-myc、bcl-2及bcl-6基因异常,为THL。4例多重基因异常病例中3例起源于生发中心B细胞(GCB),只有1例起源于非GCB(non-GCB)。18例c-myc和bcl-2蛋白双高表达患者中仅有3例(16.67%)检测到多重基因异常,包括2例DHL和1例THL。
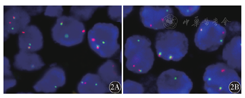

2A:分开的红、绿信号为c-myc基因异常,红、绿信号融合在一起为正常c-myc基因;2B:分开的红、绿信号为bcl-2基因异常,红、绿信号融合在一起为正常bcl-2基因
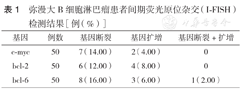
弥漫大B细胞淋巴瘤患者间期荧光原位杂交(I-FISH)检测结果[例(%)]
弥漫大B细胞淋巴瘤患者间期荧光原位杂交(I-FISH)检测结果[例(%)]
| 基因 | 例数 | 基因断裂 | 基因扩增 | 基因断裂+扩增 |
|---|---|---|---|---|
| c-myc | 50 | 7(14.00) | 2(4.00) | 0 |
| bcl-2 | 50 | 6(12.00) | 4(8.00) | 0 |
| bcl-6 | 50 | 8(16.00) | 3(6.00) | 1(2.00) |
随着细胞和分子遗传学研究的迅速发展,DLBCL多种相关的分子异常逐渐被发现,且发现了许多造血和淋巴组织肿瘤存在的特征性染色体易位,多数这些染色体易位引起融合基因或重排基因的形成,易位所涉及的基因大多表达为细胞内凋亡和(或)增殖信号通路的关键分子,而这些癌基因和抑癌基因的突变和表达的改变已成为肿瘤性疾病相关的重要分子生物学标志,用于预测肿瘤的进展、疗效以及预后[9,10]。具有"双重打击"遗传学特征的DLBCL近来成为关注的热点。虽然其相对罕见,但由于具有明显的侵袭性临床病程及对常规治疗反应不理想,故一直是需要加强研究的课题。
本研究结果显示DLBCL存在着多种分子异常,其中bcl-6基因异常率达24.00%,c-myc、bcl-2基因异常率亦分别达18.00%、20.00%。基因异常以断裂、重排最为常见,其次为基因扩增,偶见两者合并发生,提示DLBCL中存在着复杂的分子异常改变,从而导致DLBCL的异质性。本研究数据显示50例DLBCL患者中有4例检测到多重基因异常,其中1例c-myc合并bcl-2基因异常,2例c-myc合并bcl-6基因异常,为DHL,占6.00%;1例同时检测到c-myc、bcl-2及bcl-6基因异常,为THL,占2.00%。c-myc和bcl-2蛋白双高表达组仅有3例(16.67%)检测到多重基因异常,包括2例DHL和1例THL。
本研究50例DLBCL患者中多重基因异常病例共4例,阳性率为8.00%,与西方文献报道的0~12%基本一致。国内杨海燕等[11]检测了46例DLBCL患者中myc及bcl-2基因的改变,其中6例myc合并bcl-2基因异常,DHL检出率为13%,略高于本研究。因此DLBCL多重基因异常的发生率有待于扩大病例数或增加其他研究中心的数据加以综合评估,但可以确定的是基因异常是DLBCL的常见事件,但DHL或THL并不常见。本研究3例DHL中,仅有1例为c-myc合并bcl-2基因异常,2例为c-myc合并bcl-6基因异常。罗东兰等[12]报道了5例DHL,亦为c-myc合并bcl-6基因异常更为多见,与本研究结果类似。国内DLBCL多重基因异常与文献[13]报道有差异,有待于扩大检测病例数及整合其他研究中心的数据进一步验证。
由于DHL在DLBCL中的检出率较低,而FISH检测费用较高,许多医疗机构并不推荐对所有DLBCL患者行FISH常规检查,而使用免疫组织化学法检测myc和bcl-2蛋白表达。当myc阳性细胞比例≥40%时认为myc过表达,bcl-2阳性细胞比例≥70%时被认为bcl-2过表达,从而定义DHS。若此两个标记任意一个无过表达时为DHS-0,其中之一过表达时为DHS-1,两种标记都过表达时为DHS-2,后者大约占患者的29%。单因素分析显示,DHS-2患者的无进展生存(PFS)和总生存(OS)时间明显比DHS-0或DHS-1患者短。此结果独立于GCB或ABC亚型对预后的影响,也独立于国际预后指数(IPI)。因此目前国内大多数医疗中心常规检测c-myc和bcl-2蛋白的表达,当两者均高表达时,方进行FISH检测以除外DHL或THL。而本组数据显示DHS与DHL之间无明显相关性,18例DEL病例中以单基因异常为主,其中以bcl-6基因异常最常见,而其中仅有3例检测到多重基因异常,阳性率不足20%;而4例出现多重基因异常的病例中,也仅有1例存在c-myc和bcl-2蛋白的高表达。可见DHS评分不能代表基因异常改变,蛋白过表达可能存在除基因重排以外的异常,或者某些阴性重排可能不能被FISH和常规染色体检查发现。因此利用DHS难以对DHL进行筛选。但DHS对DLBCL预后评估是否存在意义需要进一步研究,以明确其常规检测的意义。因此DHL或者THL的诊断依然依赖于FISH检测,有条件的病例可进行FISH检测以排除DHL或THL。也有专家认为对于增殖指数较高、生发中心来源或复发难治的DLBCL患者,均应建议进行FISH检测,以筛选DHL或THL。
无



























