
回顾性分析胫骨近端骨巨细胞瘤(giant cell tumor,GCT)的临床特征、治疗方法及疗效,验证骨巨细胞瘤协作组(Giant Cell Tumor of China,GTOC)骨巨细胞瘤评分系统在手术方式选择中的应用价值,分析影响复发和术后功能的因素。
收集2000年3月至2014年7月全国7家骨肿瘤治疗中心的经病理确诊并接受手术治疗的250例胫骨近端GCT患者,男132例,女118例,平均年龄(34.59±12.86)岁。将有完整随访且时间>3年的140例纳入研究,男72例,女68例,平均年龄(34.46±11.96)岁。140例中CampanacciⅠ级11例、Ⅱ级58例、Ⅲ级71例,47例发生病理性骨折。收集患者影像资料、手术方式及预后等数据,按照GTOC评分系统进行评分,分析评分与手术方式选择的关系。分析流行病学、影像学等临床特征,探讨影响术后肿瘤复发、术后肢体功能的相关因素。
140例随访时间36~324个月,平均95.4个月,中位随访时间88个月。按手术方式分为假体组46例,结构性支撑组34例,颗粒性植骨组49例,其他组11例。GTOC评分与手术方式的选择差异有统计学意义。复发26例,复发率18.57%,复发时间3~79个月,平均(25.85±21.69)个月;2年内复发17例,占总复发例数的65.38%;5年无复发率77.60%。不同重建方式间复发率分别为:颗粒性植骨组18.37%,结构性支撑组20.59%,假体组15.22%,其他组27.27%。不同重建方式间复发率、生存率差别无统计学意义。对影响术后复发的多种相关因素进行分析,年龄、性别、首诊原复发、左右侧、是否偏心、骨折情况、骨皮质破坏情况、软组织肿块情况、手术方式、高速磨钻、辅助剂应用、重建方式等因素与复发均无明显相关。总体MSTS 93功能评分平均(25.26±4.31)分;首诊原发患者的功能好于复发患者(P=0.044);单纯刮除或刮除+内固定的功能好于大块切除(P=0.011);植骨、骨水泥填充的功能好于假体或复合重建(P=0.004)。MSTS功能评分与性别、左右侧、是否偏心、是否骨折、骨皮质破坏情况(Campanacci分级)、是否有软组织肿块、是否采用辅助灭活方式、是否采用磨钻、内固定方式均无明显相关。
GTOC骨巨细胞瘤评分系统是一个简单、实用的综合性评估系统,可为手术提供有效指导,各种手术方式对于胫骨近端GCT的复发无明显影响,未发现影响胫骨近端GCT复发情况的相关因素,是否原发、手术方式是影响术后功能的重要因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
1818年英国学者首次对骨巨细胞瘤(giant cell tumor,GCT)做出描述,此后近200年来,人们对GCT认识逐渐深入,但仍有一些问题尚未明确,如肿瘤的组织起源、病理学与临床预后的关系、治疗方法与复发的关系等[1]。GCT作为良性和恶性之间的交界性肿瘤,外科手术是其最主要的治疗措施,虽然术后发生远处转移的概率很小,但局部复发率却很高,约为10%~30%。骨肿瘤分类中将GCT定义为"一种良性、侵袭性骨肿瘤" ,医生易产生"良性肿瘤"所致的假安全感,轻视手术治疗彻底性,从而导致术后复发率增高[2,3]。
股骨远端和胫骨近端GCT发生率较高,占全身各部位GCT的60%~70%。胫骨近端的解剖结构特殊:①胫骨近端前方缺乏肌肉覆盖,皮肤易坏死、术后易感染;②上胫腓关节容易受肿瘤侵犯,如果处理不当,可能导致局部复发、神经损伤;③髌韧带如果切断,需要重建伸膝装置。而且胫骨近端GCT常侵及软骨下骨,手术残余骨量和重建方式均与术后功能关系密切,应尽可能保留关节功能以提高疗效[4]。目前,胫骨近端GCT的手术方法包括肿瘤刮除术及整块切除术。肿瘤囊内刮除能保留宿主骨、保留自身关节的功能,但存在局部复发的风险;整块切除复发率低,但需要应用人工关节或大段异体骨进行重建,而年轻患者还需面临假体使用寿命及翻修等问题。因此,在选择手术方案时需要权衡肿瘤清除的彻底性和肢体功能保留的关系。
手术方式的选择取决于多种因素:如病理性骨折、骨皮质破坏程度、软组织侵袭程度、肿瘤体积以及关节软骨下骨破坏程度等,并结合患者全身情况进行综合地评估。术前评估过程具有一定的主观性,骨巨细胞瘤协作组(Giant Cell Tumor of China,GTOC)对影响GCT手术治疗的各种因素进行综合分析,提出有临床实用价值的据GTOC综合临床评价系统,以标准化、客观化指导膝关节周围GCT手术治疗决策[5]。
目前GCT治疗原则多基于单中心、多部位病变的临床回顾性研究,样本量较小、易发生偏倚,且多数并未区分不同部位的GCT,降低了研究价值[6]。我们采用多中心回顾性研究,病例数量多、结果可靠性好,肿瘤部位限定于胫骨近端,减少了单中心研究的局限性所导致的统计学偏差,可更准确地评价该部位GCT的相关预后因素。
本研究回顾性分析收集自国内7个骨肿瘤治疗中心的250例大样本、单侧胫骨近端GCT患者资料,旨在:①通过GCT单部位、多中心、大样本资料的复习,回顾性分析胫骨近端GCT的临床特征、治疗方法及疗效;②验证GTOC骨巨细胞瘤评分系统在肢体GCT手术方式选择的应用价值;③分析影响胫骨近端GCT复发及术后功能的因素,为规范治疗方案及后继开展的前瞻性研究提供条件。
纳入标准:①首诊原发或复发的胫骨近端GCT患者并接受7家骨肿瘤治疗中心手术治疗;②经临床、影像学及病理组织学(活检或手术取材)诊断为GCT;③有完整随访者。
排除标准:①因发生并发症而非肿瘤复发的术后再次人院患者;②发生于非胫骨近端的GCT病变;③已确诊但最终未行手术治疗者。
依照纳入及排除标准,收集2000年3月至2014年7月在济南军区总医院、天津医院、西京医院、浙医二院、南京军区总医院、河北医科大学第三医院、内蒙古医科大学附属第二医院共7家骨肿瘤治疗中心的250例胫骨近端GCT的资料。
根据Campanacci等[1]提出的GCT影像学分级系统,肿瘤不论原发或复发,根据影像学特征分为3级:Ⅰ级,病灶周围有清晰的硬化带,骨皮质完整或轻微变薄,但无骨外形的改变;Ⅱ级,病灶周围有相对清晰的边界,但无骨影像学硬化带,骨皮质和反应骨边界很薄,有骨皮质膨胀性改变;Ⅲ级,病灶周围边界模糊,表明有快速穿凿性生长,肿瘤侵入软组织,无反应骨带。
按骨折程度进行分型,可分为较轻的简单骨折和较重的复杂骨折。
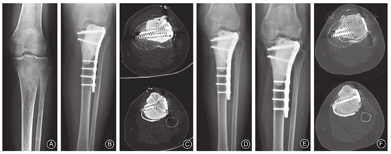
简单骨折:①位于关节外;②位于关节内,但关节面完整;③无移位或轻微移位;④肿瘤体积<200 cm3;⑤肿瘤至软骨下骨的距离>3 mm;⑥无软组织侵袭及肿块。满足上述6条中的①或②,且同时符合第③、④、⑤、⑥条时,应考虑为简单骨折(图1A,图1B)。
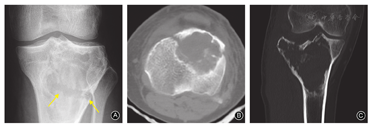

复杂骨折:①位于关节内且关节面受到破坏;②有明显移位;③肿瘤的体积>200 cm3;④肿瘤至软骨下骨的距离<3 mm;⑤软组织受到侵袭或出现肿块。当骨折符合上述任何一条或多条时,考虑为复杂骨折[7,8](图1C)。
随访资料主要通过门诊随访为主,随访内容包括临床检查、影像学检查及疗效评价。部分依从性较差患者采用电话随访,询问患者有无手术部位异常、有无继续治疗及肢体功能。术后患者每3个月随访一次,术后3年以后每6个月随访一次,术后5年以后每年复查一次。
采用骨肿瘤保肢MSTS 93功能评分[11]对患者术后功能进行评价。该评分系统共分6项:下肢包括疼痛、术后功能整体评价、接受程度、行走时支具使用情况、行走功能及步态,其中每项评分满分为5分,共30分。
应用SPSS 19.0(SPSS公司,美国)统计软件包进行数据分析,计数资料以百分数(%)表示,计量资料以( ±s)表示;不同性别、不同年龄组间计数资料的比较应用χ2检验,计量资料采用方差分析;组间的比较采用独立样本t检验,检验水准α值取双侧0.05。
±s)表示;不同性别、不同年龄组间计数资料的比较应用χ2检验,计量资料采用方差分析;组间的比较采用独立样本t检验,检验水准α值取双侧0.05。
本研究共收集7家研究中心、250例患者资料,其中男132例(52.80%),女118例(47.20%),年龄(34.59±12.86)岁。
本组140例获得3年以上的随访,随访率为56%,其中男72例(51.43%),女68例(48.57%),年龄(34.46±11.96)岁。随访时间36~324个月,平均95.4个月,中位随访时间88个月。
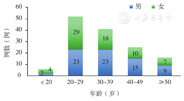
首诊原发115例(82.1%,115/140),首诊复发25例(17.9%,25/140)。按年龄分组:<20岁6例(4.3%,6/140),20~29岁52例(37.1%,52/140),30~39岁41例(29.3%,41/140),40~49岁25例(17.9%,25/140),≥50岁16例(11.4%,16/140,图2)。

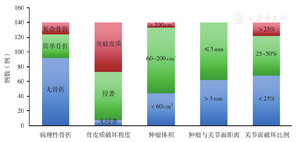
本组140例中有简单骨折者32例(22.9%,32/140),复杂骨折者16例(11.4%,16/140);未侵袭骨皮质者8例(5.7%,8/140),骨皮质被侵袭但完整者65例(46.4%,65/140),突破骨皮质生长者67例(47.9%,67/140);肿瘤体积<60 cm3者44例(31.4%,44/140),>200 cm3者7例(5.0%,7/1401);肿瘤与关节面的距离≤3 mm者78例(55.7%,78/140);关节面破坏面积的百分比<25%者68例(48.6%,68/140),>50%者18例(12.9%,18/140,表1,图3)。

140例胫骨近端GCT患者在GTOC评分系统中各因素的分布情况
140例胫骨近端GCT患者在GTOC评分系统中各因素的分布情况
| 评价因素 | 评分(分) | 例数[例,(%)] | |
|---|---|---|---|
| 病理性骨折 | |||
| 无病理骨折 | 0 | 92(65.7%) | |
| 简单骨折 | 1 | 32(22.9%) | |
| 复杂骨折 | 2 | 16(11.4%) | |
| 骨皮质破坏程度 | |||
| 骨皮质未侵袭 | 0 | 8(5.7%) | |
| 骨皮质受侵袭,但完整 | 1 | 65(46.4%) | |
| 突破骨皮质生长 | 2 | 67(47.9%) | |
| 肿瘤体积 | |||
| 较小体积GCT(<60 cm3) | 1 | 44(31.4%) | |
| 中等体积GCT(60~200 cm3) | 2 | 89(63.6%) | |
| 较大体积GCT(>200 cm3) | 3 | 7(5.0%) | |
| 肿瘤与关节面距离 | |||
| >3 mm | 1 | 62(44.3%) | |
| ≤3 mm | 2 | 78(55.7%) | |
| 关节面破坏面积百分比 | |||
| <25% | 1 | 68(48.6%) | |
| 25%~50% | 2 | 54(38.6%) | |
| >50% | 3 | 18(12.9%) | |

GTOC评分系统根据各个变量的评分相加得到总分,评分≥9分采用肿瘤广泛切除、肿瘤假体置换术;评分6~8分采用肿瘤刮除、结构性支撑重建(结构性植骨或骨水泥,应用或不应用内固定);评分<6分采用肿瘤刮除、异体或自体颗粒性植骨。
本组140例中,假体组46例(32.86%,46/140),结构性支撑组34例(24.28%,34/140),颗粒性植骨组49例(35%,49/140),其他组(植骨复合骨水泥、半关节假体、异体骨单髁关节置换)11例(7.86%,11/140)。
根据GTOC骨巨细胞瘤评分系统将假体组、结构性支撑组及颗粒性植骨组的129例回顾性评分(排除其他组的11例):GTOC评分≥9分者40例(35例假体置换、5例刮除),6~8分者46例(9例假体置换、37例刮除),<6分者43例(2例假体置换、41例刮除),3组GTOC评分的患者,不同手术方式的例数差异有统计学意义(χ2=70.067,P=0.000)。
GTOC评分≥9分的40例中,5例行刮除术,其中的4例行结构性支撑,1例行颗粒植骨;6~8分的46例患者中,37例行刮除术,其中26例行结构性支撑,11例行颗粒植骨;<6分的43例中,41例行刮除术,其中4例行结构性支撑,3组GTOC评分的患者,刮除患者不同重建方式的例数差异有统计学意义(χ2=32.803,P=0.000)。
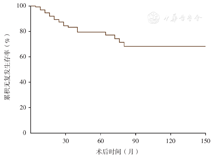
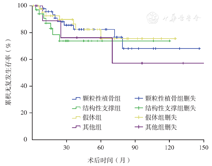
本组140例中,26例复发,复发率为18.57%;复发时间为3~79个月,平均为(25.85±21.69)个月;2年内复发17例,占总复发病例的65.38%,5年无复发率为77.60%(图4)。

假体组复发率为15.22%,结构性支撑组20.59%,颗粒性植骨组18.37%,其他组27.27%。不同重建方式间复发率差别无统计学意义(χ2=0.986,P=0.805),各种手术方式对于胫骨近端GCT的复发无明显影响。
四组的10年无复发生存率分别为:假体组75.5%,结构性支撑组73.9%,颗粒性植骨组68.1%,其他组57.1%。经log-rank检验,各组间无复发生存率的差异无统计学意义(χ2=2.072,P=0.558,图5)。

对影响术后复发的多种相关因素进行分析,是否复发与如下因素均无明显相关(P >0.05):年龄、性别、首诊原复发、左右侧、是否偏心、骨折情况、骨皮质破坏情况、软组织肿块情况、手术方式、高速磨钻、辅助剂应用、重建方式。本研究未能发现可能相关因素影响胫骨近端GCT复发情况。
140例MSTS功能评分平均为(25.26±4.31)分,总体良好(图6)。

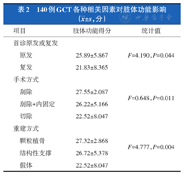
功能评分与首诊原复发相关(F=4.190,P=0.044),即首诊原发患者的功能好于复发患者;功能评分与手术方式相关(F=0.648,P=0.011),即单纯刮除或刮除+内固定的功能好于大块切除;功能评分与重建方式相关(F=4.777,P=0.004),即结构性支撑、颗粒性植骨的功能好于假体或复合重建(表2)。
140例GCT各种相关因素对肢体功能影响( ±s,分)
±s,分)
140例GCT各种相关因素对肢体功能影响( ±s,分)
±s,分)
| 项目 | 肢体功能得分 | 统计值 | |
|---|---|---|---|
| 首诊原发或复发 | |||
| 原发 | 25.89±5.867 | F=4.190,P=0.044 | |
| 复发 | 21.83±8.365 | ||
| 手术方式 | |||
| 刮除 | 27.55±2.087 | F=0.648,P=0.011 | |
| 刮除+内固定 | 26.22±5.166 | ||
| 切除 | 22.52±8.047 | ||
| 重建方式 | |||
| 颗粒植骨 | 27.32±2.868 | F=4.777,P=0.004 | |
| 结构性支撑 | 26.72±5.378 | ||
| 假体 | 22.52±8.047 | ||
功能评分与性别、左右侧、是否偏心、是否骨折、Campanacci分级、是否有软组织肿块、是否采用辅助灭活方式、是否采用磨钻、内固定方式均无明显相关(P>0.05)。
在欧美国家GCT占所有原发骨肿瘤的5%,在中国和印度则更常见,约占所有原发骨肿瘤的20%[3,12]。80%的GCT发生于成人长骨末端,膝关节周围(股骨远端、胫骨近端)占75%[13]。GCT常出现于人的第2~4个10年(60%~75%),男女性别比例为1∶1.2~1.5[3,14]。多数病变位于长骨,其中大多数位于膝关节周围。其他易发部位包括桡骨远端、肱骨近端、腓骨、骶骨和椎体(<3%)。本组140例胫骨近端GCT患者93例(66.4%)发病年龄在20~39岁,男女发病率比例为1.1∶1,这与既往文献报道结果一致。
关于胫骨近端GCT单一发病部位临床特征的文献,我们通过查阅国内外数据库,目前尚无大宗病例报道。本研究140例中,92例(65.7%)无病理性骨折;未侵袭骨皮质者8例(5.7%),骨皮质被侵袭但完整者65例(46.4%),突破骨皮质生长者为67例(47.9%);89例肿瘤体积有为中等体积,占63.6%,而>200 cm3者仅7例,这于胫骨近端本身体积以及发现疾病较早有关;肿瘤与关节面的距离≤3 mm者78例(55.7%),说明胫骨近端GCT容易侵及关节面;关节面破坏面积百分比25%~50%者54例(38.6%),>50%者18例(12.9%),说明在关节软骨下3 mm内的GCT,3/4的患者关节面破坏面积在25%~50%。
由于GCT的局部生物行为具有侵袭性,复发率高15%~45%[15,16],但外科手术治疗依然是GCT的主要治疗措施。对于局部复发的治疗包括再次病灶内刮除或扩大切除,以避免肿瘤进展而致残。用高速磨钻联合异体骨移植或骨水泥填充的病灶内手术复发率可降至12%~14%[17,18]。扩大切除比病灶内刮除复发率低,但是存在功能重建的难题[19]。本组140例中,行肿瘤广泛切除、肿瘤假体置换46例(32.86%),结构性支撑(结构性植骨或骨水泥填充,应用或不应用内固定)34例(24.28%),颗粒性植骨组49例(35.00%),其他组(植骨复合骨水泥、半关节假体、异体骨单髁关节置换)11例(7.86%)。手术方式的选择主要依靠病变本身的特点、专家共识及术者的临床经验。
2011年提出的GTOC骨巨细胞瘤评分系统[6],根据与肿瘤解剖特征密切相关的5个因素对肿瘤进行评分,达到指导手术方式选择的目的,并分析了16例行手术治疗的膝关节周围GCT患者,其中评分≥9分采用肿瘤广泛切除、肿瘤假体置换术;评分6~8分采用肿瘤刮除、结构性支撑重建(结构性植骨或骨水泥,应用或不应用内固定);评分<6分采用肿瘤刮除、异体或自体颗粒性植骨。16例中仅有1例复发。
我们回顾分析140例胫骨近端GCT患者,发病部位单一,避免了不同部位的评分偏倚。按照GTOC系统评分,其中≥9分的患者40例、6~8分者46例、<6分者43例,行假体置换的比例分别为:87.5%、19.6%、4.7%,颗粒植骨的比例分别为:20%、29.7%、82.9%。表明GTOC评分影响手术方式的选择(χ2=70.067,P=0.000)以及刮除患者重建方式的选择(χ2=32.803,P=0.000)。
GTOC评分系统是第一个尝试标准化肢体GCT解剖特征的评分系统,使GCT描述特点更客观化,可减少评分者主观因素造成的差异。我们应用此系统对胫骨近端GCT的手术进行了验证,表明其稳定性和可重复性,对手术方案的选择提供了可靠的依据,可进一步规范手术方案的制定,避免术后并发症的发生。
胫骨近端GCT局部复发率高,其原因之一为肿瘤侵及上胫腓关节时常规手术不容易彻底切除肿瘤[20]。本组140例中26例复发,复发率为18.57%;复发时间为3~79个月,平均复发时间为(25.85±21.69)个月。我们分析影响术后复发的多种相关因素:年龄、性别、首诊原复发、左右侧、是否偏心、骨折情况、骨皮质破坏情况、软组织肿块情况、手术方式、高速磨钻、辅助剂应用、重建方式。未能发现可能相关因素影响胫骨近端GCT复发情况。以往在可能影响GCT手术复发率的因素方面已有诸多研究,尽管影响GCT术后复发的原因众多,但多数学者认为,最重要的复发相关因素为外科治疗措施,尤其是不适当的手术选择[21]。手术的彻底性与局部复发的关系最为密切,这与术者的临床经验有关。对GCT治疗的理想结果是既切除肿瘤又保留关节功能[22]。本研究中,颗粒及结构性植骨的术后功能优于假体重建的术后功能,提示在严格掌握肿瘤切除原则的基础上,应当尽量减少对正常骨质的切除,保留自身关节功能。
本研究仍存在不足之处,本研究回顾性分析的数据来源于病历、影像和随访资料,存在一定片面性;本研究中切除患者相对较少,可能对统计结果造成一定的影响;部分患者随访时间较短;患者随访依从性较差,电话随访结果存在一定的主观性误差。



























