
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
IBD是一种慢性非特异性肠道疾病,主要包括CD和UC。IBD呈慢性病程、迁延不愈,严重影响患者生命质量。IBD的治疗经历了3个时期的演变,20世纪50年代引入糖皮质激素,60年代开始使用免疫抑制剂,而当今已进入生物制剂时代。随着治疗的进展和不断规范化,IBD的治疗效果有了长足的进步,患者并发症和病死率明显下降。然而这些药物单独或联合治疗会改变患者的免疫状态,从而带来相应的问题,特别是增加了机会性感染(opportunistic infection)的风险。
机会性感染是指对健康人体致病能力有限或无致病能力的微生物,当疾病(如艾滋病)或治疗因素诱发机体免疫功能低下时,则可致病而引发感染。IBD患者是机会性感染的高风险人群。首先,疾病本身可导致患者营养状况下降;其次,应用糖皮质激素、免疫抑制剂和生物制剂可严重抑制患者的免疫力,因此机会性感染发生率显著增加,需要予以关注和重视[1,2]。我国各类传染病较西方国家相对高发,故积极预防、早期诊断和及时控制机会性感染是改善我国IBD患者预后的前提[3]。本共识意见参考国内外的临床研究结果,并结合我国IBD患者特点加以总结,力求对临床实践具有指导作用。
中华医学会消化病学分会IBD学组组织专家讨论制订本共识意见。由我国IBD、感染、临床流行病和循证医学领域的专家们组成共识意见专家小组,采用国际通用的Delphi程序进行共识制订。我国IBD领域的专家们共分成7个研究小组,分别进行文献检索、筛选、评价,确定共识意见要解决的患者-干预-比较对照-结果(patients-intervention-comparison-outcome,PICO)问题后,通过电子邮件进行3轮投票(共计58名专家),并由第三方统计票数。根据投票结果面对面采用计票器投票(共计24名专家),经2次专家讨论会进行讨论,初稿在我国IBD学组全体会议中讨论、修改、通过。最终经感染和循证医学领域专家审阅后定稿,并达成本共识意见。
本共识意见中投票意见的推荐等级分为A级指标,即3/4及以上投票通过评分标准a;B级指标,3/4及以上投票通过评分标准a+b;C级指标,未达上述指标,删去。评分标准:a为完全赞同(必不可少,最起码的要求);b为部分赞成,推荐(应该做到,但未达到必不可少的高度);c为视情况而定;d为不赞成(删去,不合理、不必要、不合国情、不可操作、不可评估、不必放在本共识意见中)。
本次共识意见分为IBD合并巨细胞病毒(cytomegalovirus,CMV)感染、EB病毒(Epstein-Barr virus,EBV)感染、病毒性肝炎、细菌感染、结核分枝杆菌感染、真菌感染、寄生虫感染和疫苗等方面内容,共33个指标,以下对各部分的共识意见进行分别阐述。
1.IBD患者CMV血清IgG抗体阳性率高于健康对照者,UC合并CMV结肠炎者多于CD。
注释:CMV感染的流行病学与社会经济学背景等因素相关[4]。文献报道IBD患者CMV血清IgG阳性率较高。例如Yi等[5]报道我国武汉地区UC患者CMV血清IgG阳性率为73%,CD患者为89%,而健康人群仅为50.69%。IBD患者感染CMV的疾病形式表现不一,其中CD患者很少合并CMV疾病,文献报道比例<5%[6] 。
2.重度UC出现糖皮质激素抵抗者建议临床除外CMV活动性感染。
注释:多数文献指出,重度UC和(或)糖皮质激素抵抗的UC患者的CMV活动性感染率增高。据国外报道,糖皮质激素抵抗的重度UC患者中CMV结肠炎比例为20%~40%[7],行急诊结肠切除的UC患者中为27%[8]。我国资料显示,重度UC接受外科手术患者中CMV活动性感染比例为46.2%[9],难治性UC患者中为36.7%[10]。
3.CMV IgM抗体阳性和(或)CMV pp65抗原血症(每150 000个白细胞中CMV阳性细胞数≥1)和(或)血浆CMV DNA实时定量聚合酶链反应(real-time quantitative polymerase chain reaction, qPCR)检测阳性,提示CMV活动性感染。
注释:针对CMV活动性感染的检测手段很多,各检测手段均有其优点和不足,多种方法联合应用可增加其检出率。①CMV血清特异性抗体检测:包括IgM和IgG,血清IgM抗体多在感染2~4周后才相继出现,其早期诊断价值有限[11,12]。②CMV pp65抗原检测:诊断敏感度为60%~100%,特异度为83%~100%[13]。缺点是不能区分潜伏感染和活动性感染,且检测结果受外周血中性粒细胞计数减少的影响。③病毒培养:特异度高(89%~100%)但敏感度较低(45%~78%)[12],临床应用较少。④血浆和粪便CMV DNA qPCR检测:血浆CMV DNA qPCR诊断活动性感染的敏感度为65%~100%,特异度为40%~92%[13,14]。粪便CMV DNA qPCR检测方法敏感度较好,但对样本要求高,需要新鲜液状粪便标本[15]。
4.CMV结肠炎的诊断金标准是结肠黏膜组织HE染色阳性伴免疫组织化学染色(immunohistochemistry, IHC)阳性,和(或)结肠黏膜组织CMV DNA qPCR阳性。
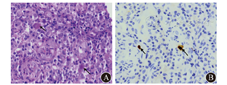
注释:①结肠黏膜组织HE染色的敏感度低,为10%~87%,早期诊断价值有限,但其特异度高达92%~100%[16,17,18]。若观察到巨细胞、核内包涵体、核周晕圈,类似"猫头鹰眼"改变,可诊断CMV结肠炎[19,20]。②结肠黏膜IHC染色的敏感度高(78%~93%)[21],是诊断CMV结肠炎的金标准。③结肠黏膜组织qPCR检测CMV DNA的敏感度为92.0%~96.7%,特异度为93.0%~98.7%。见图1。

5.若外周血CMV DNA qPCR检测阳性>1 200拷贝/mL者可考虑行抗病毒治疗。
注释:有报道应用ROC曲线方法判断,将CMV DNA qPCR检测的临界值设置在1 150拷贝/mL,其对CMV结肠炎诊断的敏感度和特异度分别是44.4%和78.9%。
6.结肠镜检查发现特殊内镜表现可提示CMV结肠炎,应常规行活组织检查并进行鉴别诊断。
注释:文献报道广泛黏膜脱失、深凿样溃疡、纵行溃疡、鹅卵石样改变、不规则溃疡等可能是CMV结肠炎内镜特征表现。Suzuki等[22]发现纵行溃疡对于预测CMV结肠炎的敏感度达100%,特异度达95%。有研究显示,UC合并CMV结肠炎患者黏膜可表现为深凿样溃疡、不规则溃疡和鹅卵石样改变。文献报道CMV包涵体多在炎性反应和溃疡部位存在,其中生长旺盛的细胞如溃疡周边肉芽组织或溃疡深部,更易发现CMV感染,因此行内镜活组织检查时在上述部位取材有利于提高检出阳性率。
7.发生糖皮质激素抵抗的重度UC患者若合并CMV结肠炎,建议及时给予抗病毒治疗。联合应用免疫抑制剂的患者是否停药需权衡利弊,可酌情减停。
注释:有证据表明对于难治性UC,CMV感染作为隐蔽因素可加重病情[11,23],而抗病毒治疗后临床缓解率达67%~100%,病死率可由71%下降至14.5%~17.6%[7,24]。
欧洲克罗恩病和结肠炎组织(European Crohn and Colitis Organization,ECCO)共识意见推荐,糖皮质激素抵抗的重度UC患者合并CMV结肠炎时,应给予抗病毒治疗,同时建议停用免疫抑制剂[25]。然而有研究提示,停用糖皮质激素或免疫抑制剂会加重UC病情[26]。故是否停药或酌情减停应个体化评估后决定。
8.IBD合并CMV结肠炎患者的抗病毒治疗疗程建议为3~6周。
注释:治疗的主要药物是更昔洛韦(ganciclovir)和膦甲酸钠(foscarnet sodium)[27]。其中更昔洛韦用法为5 mg/kg (2次/d)静脉滴注,疗程一般不少于3周。缬更昔洛韦(valganciclovir)是更昔洛韦的前体药物,口服生物利用度较好,吸收后经磷酸化变为三磷酸更昔洛韦,其疗效和更昔洛韦相当,常规剂量为900 mg (2次/d),可作为口服维持治疗。膦甲酸钠的疗效与更昔洛韦相当,用法为180 mg·kg-1·d-1静脉滴注,分2~3次给药,疗程一般不少于3周。
1.IBD患者在使用免疫抑制剂过程中出现活动性EBV感染,建议权衡利弊,争取停用免疫抑制剂。
注释:多项研究表明IBD患者有发生淋巴瘤的风险,尤其是接受巯基嘌呤治疗的患者,研究显示部分可能与EBV感染相关[28,29,30]。当使用免疫抑制剂的IBD患者出现疑似EBV感染,须密切监测血常规、外周血涂片、肝功能和EBV血清学指标。EBV DNA虽然缺乏明确的标准值,且特异性不高,但若EBV血清学原本阴性的患者出现EBV DNA升高,即提示有发生淋巴增生性疾病的危险[31]。首要治疗是减量或停用免疫抑制剂。停用免疫抑制剂后,EBV相关的淋巴细胞增生性疾病通常可自发缓解[32]。
2.IBD患者出现EBV相关淋巴增殖性疾病,应与血液科医师共同诊治。
注释:IBD患者出现活动性EBV感染时抗病毒治疗(阿昔洛韦,更昔洛韦)疗效欠佳,而出现EBV相关淋巴增殖性疾病时,抗病毒治疗无效[31]。首要的治疗是减少或者停止使用免疫抑制剂,有助于EBV相关的淋巴细胞增生性疾病自发缓解[32,33]。如果停用免疫抑制剂后疾病未缓解或加重,对CD20阳性的B细胞淋巴瘤者可以考虑使用利妥昔单克隆抗体。另外,EBV感染要高度警惕发生巨噬细胞活化综合征(marcrophage activation syndrome, MAS)和噬血淋巴组织增生症(hemophagocytic lymphohistocytosis,HLH)。一旦发生EBV感染合并MAS/HLH或EBV相关淋巴增生性疾病,建议与血液科医师密切协作、共同应对,制订合理的诊疗策略。
1.所有IBD患者均应筛查HBsAg、抗-HBs、抗-HBc,并对HBsAg阳性、抗-HBc阳性者进一步筛查HBeAg、抗-HBe和HBV DNA。
注释:国外研究报道6例IBD患者使用糖皮质激素和(或)硫唑嘌呤出现HBV再激活,其中5例发生肝衰竭[34,35,36]。英夫利西单克隆抗体(infliximab,IFX)导致IBD患者HBV再激活亦有报道[37]。国内一项关于应用IFX的临床调查显示,4例HBsAg阳性患者使用IFX治疗期间有3例出现ALT升高[38]。因此,当IBD患者在首次确诊时,建议同时进行HBV筛查,而不应在开始免疫抑制剂治疗后进行[39,40,41,42]。鉴于隐匿性感染存在HBV再激活的风险,也有研究建议对HBsAg阴性且抗HBc阳性者筛查HBV DNA[35]。
2.拟进行免疫抑制剂治疗的HBsAg阳性的IBD患者,不论HBV DNA水平,均需预防性使用核苷(酸)类药物抗病毒治疗,抗病毒治疗应在糖皮质激素、免疫抑制剂治疗前1~2周开始,持续至免疫抑制治疗停止后至少12个月。
注释:研究显示HBsAg阳性的IBD患者的HBV再激活率为16%~36%,再激活风险与长期(>3个月)联合(≥2种)应用免疫抑制剂和未接受预防性抗病毒治疗有关[42]。关于抗病毒治疗药物,拉米夫定是IBD患者最常用的预防性抗病毒药物,但其1年和5年耐药率分别为30%和70%[43],长期抗TNF制剂治疗可致耐药率进一步升高[44,45]。故目前拉米夫定仅推荐用于短期治疗。对于IBD患者,应尽量避免因抗病毒治疗而影响免疫抑制剂的应用,故推荐使用耐药率较低且强效抗病毒的替诺福韦和恩替卡韦[25,46,47]。HBV DNA> 2 000 IU/mL的慢性乙型肝炎患者发展为肝硬化和肝癌的风险显著增加,故HBV DNA> 2 000 IU/mL者还需继续抗病毒治疗,治疗终点同普通乙型肝炎人群[25,48,49]。
3.HCV不是免疫抑制治疗的绝对禁忌证,但可能增加HCV再次活动风险,故需密切监测。
注释:2013年Huang等[50]的研究显示IBD患者HCV感染率与普通人群比较差异无统计学意义,在714例IBD患者中,HCV的感染率为0.42%,而在非IBD患者群体中HCV感染率为0.36%(P=0.80),这与意大利Papa等[51]的一项研究结论一致。
IBD患者应用糖皮质激素和免疫抑制剂可能会影响丙型肝炎病程。Loras等[35]的研究显示糖皮质激素可能导致HCV大量复制,并出现肝脏损伤。Brunasso等[52]分析37篇相关研究,在153例因类风湿关节炎使用IFX的HCV感染者中,仅发现1例有明确证据支持的HCV患者肝脏病情恶化。就现有数据分析,抗TNF制剂治疗对合并HCV感染的IBD患者的安全性尚可接受[42,52]。
4.抗HCV治疗的常用药物IFN是否会加重IBD病情尚不肯定,需要充分考虑抗HCV治疗加重IBD病情的风险性,以及药物间的相互作用,推荐直接抗病毒药物(direct-acting antiviral agents,DAA)进行抗HCV治疗。
注释:目前我国主要的抗HCV方案为PR方案,即聚乙二醇干扰素α(peginterferon alfa, PEG IFN-α)联合利巴韦林治疗[53]。在无禁忌证的前提下,该方案适用于HCV所有基因型。此外,欧美国家已上市一类新型药物即抗HCV的DAA,此类药物在我国尚处于临床试验阶段。IBD患者在进行HCV感染的抗病毒治疗前,需要充分权衡抗病毒治疗加重IBD病情的风险,以及药物间可能的相互作用[42]。
1.IBD患者合并活动性细菌感染时,视情况考虑减停免疫抑制剂,并应用敏感抗生素治疗。
注释:由于免疫抑制剂和生物制剂都有可能导致患者免疫力下降,因此当IBD患者合并活动性细菌感染时,应暂时停用免疫抑制剂,并应用敏感抗生素治疗[25]。
2.IBD是难辨梭状芽孢杆菌(Clostridium difficile, C.diff)感染的独立危险因素。
注释:C.diff是一种革兰阳性产芽孢厌氧杆菌,为医院内感染的一种常见条件致病菌,可引起腹泻、伪膜性肠炎、严重脓毒血症等。该菌感染的危险因素包括抗生素暴露、免疫力低下、长期住院、高龄等[54,55]。欧美国家研究显示IBD是C.diff感染的独立危险因素,特别是UC患者[25]。一项单中心回顾性研究提示IBD患者C.diff感染率明显升高,活动期和结肠受累的IBD患者可能更易感染C.diff[56]。
3.手卫生防护是防止C.diff院内感染的重要手段。
注释:C.diff感染的传播媒介众多,其中经手传播是重要的途径[57]。通过手套或手卫生防护,是防止院内感染的重要手段。目前并不建议对C.diff感染进行药物预防。我国有研究对于5种不同手卫生方法清除手部C.diff的效果进行比较,发现普通肥皂液对于C.diff的清除效果最好,其次依次为抗菌肥皂液、季铵盐消毒湿巾、流动水、含醇快速手消毒液6步洗手法[58]。如果发现有确诊或疑似C.diff感染的患者,建议进行隔离,防止感染院内扩散[59]。
4.应用糖皮质激素和免疫抑制剂的IBD患者,病情复发和治疗效果不佳时,推荐进行C.diff检查。
注释:长期应用糖皮质激素、免疫抑制剂等的IBD患者,发生C.diff感染的风险显著增加,可加重IBD病情。一项大规模以普通人群为基础的研究发现,无论剂量或疗程如何,使用糖皮质激素的IBD患者与应用免疫抑制剂和生物制剂者相比,发生C.diff感染的风险增加3倍[60]。长期应用免疫抑制剂也增加IBD患者C.diff感染的风险[61],而长期应用生物制剂并不明显增加C.diff感染风险[60]。
5.C.diff检测可以通过ELISA法、细菌培养、毒素检测和核苷酸扩增技术(nucleic acid amplification technology,NAT)等检测脱氢酶抗原、毒素A/B。
注释:C.diff感染检查方法包括以下3种。①粪便C.diff毒素A/B的检测或毒素中和实验(cytotoxicity neutralisation assay,CCNA)。②检测细菌本身,如谷氨酸脱氢酶(glutamate dehydrogenase,GDH)抗原检测或培养。③NAT检测毒素基因等[62]。徐蓉等[63]比较了C.diff粪便培养、核苷酸PCR、ELISA法检测毒素A/B这3种方法,发现核苷酸PCR和ELISA法毒素检测与厌氧菌培养相比,其敏感性差异无统计学意义。
C.diff感染的检测方法有多种,CCNA对于C.diff毒素B的检测为C.diff感染检测的金标准。一般建议NAT与ELISA进行联合检测,内镜检查不作为C.diff感染的必需检测方法。
6.IBD患者合并感染C.diff的治疗,参考非IBD患者C.diff的治疗,可选用甲硝唑和万古霉素。对于严重C.diff感染者,万古霉素疗效优于甲硝唑,建议作为首选。
注释:甲硝唑是C.diff感染的首选治疗,包括复发感染[64]。甲硝唑的用量一般为口服200~250 mg (4次/d)或400~500 mg (3次/d),疗程为10~14 d。万古霉素可用于治疗复发型C.diff感染或甲硝唑治疗无效的C.diff感染[65]。Meta分析显示,万古霉素和甲硝唑与其他抗生素(如利福昔明等)相比,治疗轻中度C.diff的疗效差异无统计学意义[66,67,68]。但对于重症C.diff感染或经甲硝唑治疗后症状加重的患者,建议尽早使用万古霉素[69]。对于急性C.diff感染,建议万古霉素每6 h口服125 mg治疗[70]。为预防C.diff感染复发,建议万古霉素逐渐减量或间断用药,具体用法为每3 d口服125~500 mg,持续2~3周[65]。其他抗生素如硝唑尼特、利福昔明等,主要用于复发型C.diff感染[71]。替加环素静脉给药对于严重、复杂、复发型C.diff感染有效[72]。
7.对于IBD合并C.diff感染者,免疫抑制剂的使用需权衡利弊。
注释:IBD患者应用硫唑嘌呤可增加C.diff感染的风险[73]。但如果仅给予抗生素而未同时使用免疫抑制剂,则不增加上述风险。如果联合应用1种以上免疫抑制剂,上述风险可进一步增加[74]。因此,对于IBD合并C.diff感染的患者是否继续使用免疫抑制剂,建议酌情考虑,权衡免疫抑制剂治疗效果和C.diff感染导致不良后果的利弊。
1.抗TNF制剂治疗可致潜伏结核感染(latent tuberculosis infection,LTBI)再激活,或导致结核感染机会增加,故采用抗TNF制剂治疗前须常规筛查结核。
注释:近年来研究发现,使用抗TNF制剂前进行LTBI的筛查,用药后仍有少数IBD患者(1.65%)感染结核[75],且更易发生肺外结核,此时多表现为发热、CRP升高,而病原学检测阳性率更低[76]。因此有LTBI的IBD患者至少抗结核3周后才能使用抗TNF制剂;近3个月内应用结核分枝杆菌活疫苗者,亦不宜进行生物制剂治疗[25,77,78]。在使用抗TNF制剂过程中还需定期通过临床表现、胸部X线摄片等监测结核活动情况,建议每8~16周随访1次[79,80]。
2.应用糖皮质激素、嘌呤类药物和甲氨蝶呤进行治疗前,亦建议进行结核菌筛查。
注释:研究显示应用相当于泼尼松剂量≥15 mg/d时,治疗时间超过1个月,可增加LTBI活动的风险[81,82,83]。单独使用嘌呤类药物也可增加LTBI再活动风险[84,85],且嘌呤类药物与糖皮质激素和(或)抗-TNF制剂联合比单独应用更易发生LTBI再激活。
3.活动性结核或LTBI筛查建议:结合既往结核病史、结核接触史、胸部X线片、PPD和(或)干扰素γ释放试验(interferon-gamma release assays,IGRA)。IGRA对于结核病的诊断效力优于PPD,有条件情况下推荐首选IGRA。
注释:排除活动性结核需结合既往结核病史、结核接触史、有无结核中毒症状和胸部X线片所见进行判断[25,86,87],LTBI的筛查目前主要有结核菌素皮肤试验(tuberculin skin test,TST)和IGRA [包括QuantiFERON-TB Gold和T细胞酶联免疫斑点技术(T cell enzyme-linked immune-spot assay)两种检测方法],但TST和IGRA两种方法均无法区分LTBI和活动性结核。多项研究显示IGRA在有卡介苗(Bacillus Calmette Guerin)接种史、活动性肺结核接触者、高危医务人员和儿童肺结核的诊断方面优于TST[88,89,90,91,92,93,94]。鉴于我国为结核病高发国家,中华医学会结核病学分会建议PPD和IGRA均可用于我国LTBI的筛查,对PPD阳性者可进一步采用IGRA协助确认;并指出自身免疫病或器官移植患者在接受糖皮质激素或抗TNF制剂治疗前,应单用IGRA或联合PPD筛查LTBI[95]。
4.诊断为LTBI在抗TNF制剂、糖皮质激素(相当于泼尼松≥15 mg/d)治疗前建议给予1~2种结核杀菌药治疗3周,抗TNF制剂或糖皮质激素治疗中继续用该抗结核治疗方案6个月。
注释:对有LTBI的IBD患者在应用抗TNF制剂或糖皮质激素治疗中,建议采用以下方案,异烟肼0.3 g/d,利福平0.45 g/d,连续用药6个月;或异烟肼0.9 g/周,利福喷丁0.9 g/周,连续用药3~6个月。而对于既往陈旧性结核的IBD患者是否需要预防性抗结核治疗,需根据其既往治疗等情况而采取个体化方案,并与专科医师讨论后决定。
5.一旦诊断活动性结核,应立即开始规范抗结核治疗,并停用抗TNF制剂和免疫抑制剂(如嘌呤类、甲氨喋呤),糖皮质激素是否继续应用或减量则需权衡利弊,或与专科医师讨论后决定。
注释:目前尚无针对免疫抑制宿主抗结核治疗标准方案和疗程的建议,建议转结核专科医院就诊或在结核专科医师指导下用药。亦可参照WHO和我国结核病防治指南的建议,对初治肺结核患者给予2HRZE/4HR方案(H为异烟肼,R为利福平,Z为吡嗪酰胺,E为乙胺丁醇),疗程共6个月;复治肺结核患者给予3HRZES/6HRE方案(S为链霉素),疗程共9个月;结核性胸膜炎则给予2HRZE/10HRE方案,疗程共12个月。鉴于IBD合并活动性结核患者多属于免疫抑制宿主合并结核机会性感染,推荐给予2HRZE/10HRE共12个月的抗结核治疗方案。
6.如果IBD疾病治疗需要,可在规范抗结核治疗2~3个月,且患者结核相关指标改善后恢复使用生物制剂。
注释:参照世界胃肠学大会(World Congress of Gastroenterology, WCOG)关于IBD患者生物制剂应用的伦敦共识[77],以及ECCO关于IBD机会性感染共识[25],建议在规范抗结核治疗2~3个月,且患者结核相关指标改善后,可考虑恢复抗TNF制剂治疗。而合并结核的IBD患者何时恢复免疫抑制剂治疗,目前尚无研究数据支持,应视患者的整体状况决定,也可参考生物制剂的推荐意见。
1.真菌是人类胃肠道的常驻菌,对肠道稳态起重要作用,在IBD发病中的作用尚不明确,可成为IBD患者真菌感染的条件致病原。
注释:当人体免疫力下降(如应用免疫抑制剂和糖皮质激素、Dectin-1和CARD9等效应分子基因突变等)和(或)真菌负荷增大时(如大量使用抗菌药物,使肠道正常菌群紊乱,导致真菌过度生长),肠道和其他部位的正常真菌菌群可能成为病原菌,引起真菌感染性疾病,有时甚至是致命性的侵袭性真菌感染[96,97,98,99,100]。
2.IBD患者一旦合并侵袭性真菌感染,原则上需要停止使用对人体免疫功能具有抑制作用的药物,并及时启动抗真菌治疗。
注释:根据感染的部位、病情严重程度等不同,对真菌感染的治疗策略也有所不同。局灶性浅表真菌感染通常局部应用抗真菌药物,而播散性真菌感染通常需要静脉应用抗真菌药物,视情形可能还需要外科清创术、免疫疗法等[101,102]。
一旦确诊侵袭性真菌感染,原则上应停用对机体免疫功能具有抑制作用的药物,包括糖皮质激素、免疫抑制剂、生物制剂。如果真菌感染仅是浅表的(如皮肤局部感染),局部抗真菌药物能够有效控制,此时是否需要停用免疫抑制剂尚有争议,需要认真评估IBD患者病情和继续使用的利弊关系,但继续使用抗TNF制剂的风险较高。
1.应用免疫抑制剂前无需专门筛查寄生虫感染,除非患者久居疫区或有疫区旅游史。
注释:IBD合并寄生虫感染的研究相对较少。目前尚无明确证据支持常规寄生虫筛查,但如果患者有疫区久居史或旅居史,可酌情考虑。如果怀疑合并寄生虫感染,免疫抑制剂可酌情减量,当感染控制后,必须使用免疫抑制剂控制IBD病情时,可参考感染专科医师意见进行二级预防。
1.减毒活疫苗在IBD患者行免疫抑制剂治疗时是禁忌。
注释:IBD患者应用免疫抑制剂治疗后则成为免疫力受损个体,此时需考虑应用机会性感染病原体的疫苗[103,104]。如果应用免疫抑制药物期间需要接种减毒活疫苗,建议停用糖皮质激素1个月,停用免疫抑制剂3个月以上。如果在免疫抑制剂应用前需要接种减毒活疫苗,则应推迟使用免疫抑制剂至少3周。
2.IBD患者如果HBV血清学阴性(抗-HBs和抗-HBc均阴性),可接受IBD药物治疗,同时建议接种HBV疫苗。
注释:对于HBV血清学阴性的IBD患者(抗-HBs和抗-HBc均阴性),建议接种HBV疫苗[重组(酵母)乙型肝炎疫苗],并且最好在诊断IBD时接种[48,105]。
HBV疫苗接种程序:双倍剂量接种和(或)再接种程序可能更好,即初次全程接种3针(0、1、2月)40 μg重组乙型肝炎疫苗,接种最后1针后1~3个月内复查抗-HBs水平,抗-HBs<100 IU/L者再重复1次上述3针疫苗治疗。2次接种总应答率为57%~79%[106,107]。指南也有推荐初次接种失败后再接种3针[108,109]。
关于HBV疫苗接种后的筛查和补种,有文献和指南建议处于免疫抑制状态者接种HBV疫苗后每6~12个月筛查抗-HBs水平,抗-HBs<10 IU/L者应补种1针,但针对IBD患者尚无相关推荐[108,110]。
关于接种时间,短程(0、1、2月)可使免疫抑制状态者尽快获得免疫保护,长程(0、1、6月)可使最终的抗体效价更高,但却增加了延迟免疫反应者的HBV感染风险[108]。4针接种(0、1、2、6月)可能会提高应答[108],但还需在IBD患者中进一步研究。
关于IBD患者有效保护的抗体效价,抗-HBs水平>10 IU/L被认为是有效保护 [107]。然而,对于高风险人群,如处于免疫抑制状态者和慢性疾病者(包括IBD患者),抗-HBs>100 IU/L被认为是有效的血清学保护[111],包括IBD患者在内[112]。
3.IBD患者可酌情接种肺炎球菌疫苗。
注释:PPV23是针对肺炎链球菌的一种23价的多聚糖疫苗,含多达98%致肺炎的肺炎球菌血清型。在IBD患者的临床使用中获得良好的免疫作用[113]。ECCO建议在IBD患者开始治疗前2周接种肺炎球菌疫苗PPV23以预防该菌感染[25]。
执笔人(按文章章节顺序排序): 杨红,冉志华,刘玉兰,吴开春,吴小平,何瑶,刘占举
投票人(按姓氏汉语拼音排序):陈旻湖,程留芳,曹倩,陈焰,陈晔,陈宁,曹晓沧,陈敏,邓长生,杜奕奇,窦艳,范一宏,冯哲,高翔,甘华田,顾芳,胡品津,胡乃中,霍丽娟,韩英,韩玮,黄梅芳,胡益群,江学良,刘新光,李延青,李俊霞,吕红,梁洁,李瑾,李玥,缪应雷,梅俏,欧阳钦,庞智,沈骏,施华秀,田丰,涂轶,王化虹,王玉芳,王承党,王新颖,于成功,姚玮艳,郑家驹,钟捷,智发朝,张晓岚,张亚历,张红杰,张虎,郑萍,郑鹏远,郑长青,邹开方,朱振华,周峰
循证医学审阅人:詹思延
感染专业审阅人:盛瑞媛,刘晓清,周宝桐


























