
探讨免疫性血小板减少症(ITP)患者外周血中自然杀伤(NK)细胞数量及功能的变化。
选取2015年9月至2016年5月天津医科大学总医院血液科住院的初诊ITP患者34例,完全缓解ITP患者32例及健康志愿者30名。采用流式细胞术检测外周血NK细胞及其亚群比例,NK细胞表面分子激活性受体NKp44、抑制性受体NKG2A及CD16,胞质蛋白穿孔素及颗粒酶β的表达水平,并将其与ITP患者的免疫状态及血小板水平做相关性分析。
(1)NK细胞及其亚群占外周血淋巴细胞比例:NK细胞:初诊组(10.99%±4.89%)及完全缓解组(9.73%±6.75%)低于对照组(14.67%±7.24%)(P=0.023、0.003);Bright亚群:初诊组(0.48%±0.23%)及完全缓解组(0.41%±0.33%)低于对照组(0.64%±0.32%)(P=0.037、0.002);Dim亚群:初诊组(10.16%±5.02%)及完全缓解组(8.07%±5.74%)低于对照组(14.16%±7.19%)(P=0.009、0.007)。(2)各亚群占NK细胞的比例:Bright亚群:初诊组(6.48%±4.33%)高于对照组(4.21%±2.70%)(P=0.020);Dim亚群:初诊组(93.51%±4.33%)低于对照组(95.79%±2.70%)(P=0.020)。(3)激活性受体NKp44:初诊组低于完全缓解组及对照组[0.28%(0.95%)比0.61%(2.05%)、0.92%(0.90%),P=0.047、0.048];抑制性受体NKG2A:初诊组高于对照组(42.34%±23.86%比29.25%±12.83%,P=0.009);CD16:初诊组低于对照组(93.51%±4.33%比95.79%±2.70%,P=0.020)。(4)穿孔素:初诊组低于对照组[87.52%(25.29%)比91.55%(8.29%),P=0.025];颗粒酶β 3组之间差异无统计学意义。(5)NK细胞与外周血杀伤T细胞(CD3+CD8+)、B1细胞(CD5+CD19+)呈负相关(r=-0.387、-0.273,P=0.012、0.028),与外周血辅助/杀伤T细胞比值(CD3+CD4+/CD3+CD8+)、血小板计数呈正相关(r=0.358、0.314,P=0.028、0.011)。
ITP患者外周血NK细胞数量下降,发育障碍、功能降低,对自身反应性T、B细胞的抑制不足导致疾病的发生。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
免疫性血小板减少症(immune thrombocytopenia,ITP)是一种自身免疫介导血小板过度破坏所致的血小板减少性疾病,B淋巴细胞产生血小板相关抗体破坏血小板是ITP的经典发病机制。近年来有文献报道自然杀伤(NK)细胞在自身免疫性疾病如系统性红斑狼疮(SLE)[1]及类风湿性关节炎(RA)[2]中存在数量及功能异常,且多数研究认为NK细胞在自身免疫性疾病中主要起保护作用。NK细胞在ITP患者中研究尚少,本研究通过检测ITP患者不同疾病状态及健康对照者外周血NK细胞数量、亚群及功能的变化,探讨NK细胞在ITP发病机制中的作用。
选取2015年9月至2016年5月天津医科大学总医院血液科住院的初诊ITP患者(初诊组)34例,男14例,女20例,中位年龄50岁(14~65岁),均未接受免疫治疗,血小板计数<60×109/L ;完全缓解组ITP患者32例,男10例,女22例,中位年龄42岁(9~71岁),均已接受免疫治疗,血小板计数维持在(100~300)×109/L;健康志愿者30名作为对照组,男9名,女21名,中位年龄41岁(14~69岁)。初诊组及完全缓解组ITP患者均符合该疾病的诊断标准,且通过完善骨髓涂片、流式表型、染色体、甲状腺功能、免疫全项、腹部B超等检查排除了SLE等自身免疫性疾病、甲状腺疾病、骨髓增生异常综合征或淋巴瘤所致的血小板减少,同时也除外了脾功能亢进、假性及妊娠情况所致的血小板减少,所选受试者无感染、肿瘤及其他自身免疫性疾病等影响NK细胞水平等因素的干扰。3组间性别、年龄差异无统计学意义(均P>0.05)。研究方案经天津医科大学总医院伦理委员会批准,所有研究对象均已签署知情同意书。
纳入本研究的ITP患者治疗方案均使用糖皮质激素(1 mg·kg-1·d-1),根据病情严重程度,部分患者加用丙种球蛋白(400 mg·kg-1·d-1×5 d)和环孢素(3~5 mg·kg-1·d-1)联合治疗。ITP诊断及疗效标准参照《成人原发免疫性血小板减少症诊断与治疗中国专家共识(2016年版)》[3]。
将初诊组ITP患者中接受治疗后血小板计数恢复至>100×109/L的患者归为初诊治疗有效组,男9例,女14例,中位年龄52岁(22~66岁);接受糖皮质激素治疗无效或有效但疗效不能维持、大剂量丙种球蛋白及免疫抑制剂治疗无效的患者归为初诊难治性ITP组,男5例,女6例,中位年龄47岁(14~64岁),两组间性别、年龄差异无统计学意义(均P>0.05)。
鼠抗人多甲藻素-叶绿素蛋白标记的CD3抗体(PerCP-CD3)、鼠抗人藻蓝蛋白标记的CD56抗体(APC-CD56)、鼠抗人异硫氰酸荧光素标记的CD16抗体(FITC-CD16)、鼠抗人藻红蛋白标记的激活性NKp44受体抗体(PE-NKp44)、鼠抗人藻红蛋白标记的抑制性NKG2A受体抗体(PE-NKG2A)、鼠抗人藻红蛋白标记的穿孔素抗体(PE-穿孔素)、鼠抗人藻红蛋白标记的颗粒酶β抗体(PE-颗粒酶β),均购自美国Becton Dickinson公司;各抗体同型对照,溶血素及破膜剂购自美国BD公司;流式细胞仪为FACSCalibur型,美国BD公司产品。
取新鲜抗凝血200 μl,平分为2管,检测管1中加入同型对照IgG1-PerCP、IgG1-FITC、IgG1-APC各20 μl,检测管2中加入CD3-PerCP、CD56-APC和CD16-FITC各20 μl。4 ℃避光孵育30 min后加入2 ml溶血素,摇匀后室温避光8 min溶解红细胞,离心弃上清,磷酸盐缓冲液(PBS)洗涤后,使用流式细胞仪计数30 000个细胞检测NK细胞的数量。
取新鲜抗凝血300 μl,平均分为3管,检测管1中加入同型对照IgG1-PerCP、IgG1-FITC、IgG1-APC、IgG1-PE各20 μl,检测管2中加入CD3-PerCP、CD56-APC、CD16-FITC及NKp44-PE各20 μl,检测管3中加入CD3-PerCP、CD56-APC、CD16-FITC及NKG2A-PE各20 μl,4 ℃避光孵育30 min后加入2 ml溶血素,摇匀后室温避光8 min溶解红细胞,离心弃上清,PBS洗涤后加入PBS 300 μl,使用流式细胞仪计数30 000个细胞检测NK细胞表面受体的表达水平。
取新鲜抗凝血300 μl,平分为3管,检测管1中加入同型对照IgG1-PerCP、IgG1-FITC、IgG1-APC各20 μl,检测管2中加入CD3-PerCP、CD56-APC和CD16-FITC各20 μl,检测管3中加入CD3-PerCP、CD56-APC和CD16-FITC各20 μl,混匀,4 ℃避光孵育30 min,加入2 ml溶血素,室温避光8 min溶解红细胞,离心弃上清,将600 μl破膜剂加入上述溶血后的标本,室温避光10 min破膜固定,PBS洗1次,离心弃上清后分别加入抗体IgG1-PE、穿孔素-PE、颗粒酶β-PE各20 μl,4 ℃避光孵育30 min,PBS洗涤后各加入300 μl PBS,使用流式细胞仪计数50 000细胞检测NK细胞胞质蛋白穿孔素、颗粒酶β的表达水平。
使用SPSS 20.0统计软件。构成比之间比较(如性别)采用χ2检验。对于符合正态分布方差齐的计量资料以 ±s表示,两组间比较使用t检验,多组间比较采用单因素方差分析,相关分析采用Pearson相关分析;对非正态分布、方差不齐的变量值,用M(QR)表示,采用非参数检验。相关分析采用Spearman相关分析。P<0.05为差异有统计学意义。
±s表示,两组间比较使用t检验,多组间比较采用单因素方差分析,相关分析采用Pearson相关分析;对非正态分布、方差不齐的变量值,用M(QR)表示,采用非参数检验。相关分析采用Spearman相关分析。P<0.05为差异有统计学意义。
初诊组及完全缓解组NK细胞占外周血淋巴细胞比例低于对照组(P=0.023、0.003);初诊组及完全缓解组Bright亚群占外周血淋巴细胞比例低于对照组(P=0.037、0.002);初诊组及完全缓解组Dim亚群占外周血淋巴细胞比例低于对照组(P=0.009、0.007)(表1)。初诊患者中治疗有效组(11.71%±5.5%)高于难治组(7.97%±3.07%,P=0.045)。
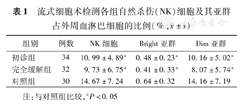
流式细胞术检测各组自然杀伤(NK)细胞及其亚群占外周血淋巴细胞的比例(%, ±s)
±s)
流式细胞术检测各组自然杀伤(NK)细胞及其亚群占外周血淋巴细胞的比例(%, ±s)
±s)
| 组别 | 例数 | NK细胞 | Bright亚群 | Dim亚群 |
|---|---|---|---|---|
| 初诊组 | 34 | 10.99±4.89a | 0.48±0.23a | 10.16±5.02a |
| 完全缓解组 | 32 | 9.73±6.75a | 0.41±0.33a | 8.07±5.74a |
| 对照组 | 30 | 14.67±7.24 | 0.64±0.32 | 14.16±7.19 |
注:与对照组比较,aP<0.05
初诊组Bright亚群占NK细胞的百分比(CD3-CD56BrightCD16-/CD3-CD56+ )高于对照组(P=0.020),Dim亚群占NK细胞的百分比(CD3-CD56DimCD16+/CD3-CD56+)低于对照组(P=0.020)(表2)。
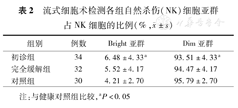
流式细胞术检测各组自然杀伤(NK)细胞亚群占NK细胞的比例(%, ±s)
±s)
流式细胞术检测各组自然杀伤(NK)细胞亚群占NK细胞的比例(%, ±s)
±s)
| 组别 | 例数 | Bright亚群 | Dim亚群 |
|---|---|---|---|
| 初诊组 | 34 | 6.48±4.33a | 93.51±4.33a |
| 完全缓解组 | 32 | 5.52±4.17 | 94.47±4.17 |
| 对照组 | 30 | 4.21±2.70 | 95.79±2.70 |
注:与健康对照组比较,aP<0.05
激活性受体NKp44:初诊组低于完全缓解组及对照组(P=0.047、0.048),抑制性受体NKG2A:初诊组显著高于对照组(P=0.009),CD16:初诊组显著低于对照组(P=0.020);穿孔素:初诊组显著低于对照组(P=0.025),颗粒酶β三组之间差异无统计学意义(P=0.560、0.426、0.179)(表3)。
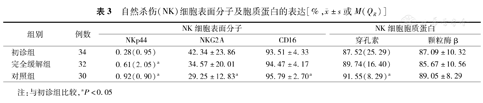
自然杀伤(NK)细胞表面分子及胞质蛋白的表达[%, ±s或M(QR)]
±s或M(QR)]
自然杀伤(NK)细胞表面分子及胞质蛋白的表达[%, ±s或M(QR)]
±s或M(QR)]
| 组别 | 例数 | NK细胞表面分子 | NK细胞胞质蛋白 | |||
|---|---|---|---|---|---|---|
| NKp44 | NKG2A | CD16 | 穿孔素 | 颗粒酶β | ||
| 初诊组 | 34 | 0.28(0.95) | 42.34±23.86 | 93.51±4.33 | 87.52(25.29) | 87.09±10.32 |
| 完全缓解组 | 32 | 0.61(2.05)a | 34.57±20.01 | 94.47±4.17 | 89.74(16.40) | 85.67±10.56 |
| 对照组 | 30 | 0.92(0.90)a | 29.25±12.83a | 95.79±2.70a | 91.55(8.29)a | 89.05±8.29 |
注:与初诊组比较,aP<0.05
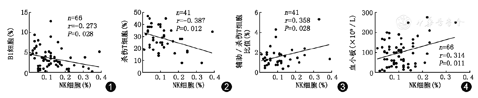
NK细胞占外周血淋巴细胞比例与ITP患者外周血CD3+CD4+T细胞、补体C3、补体C4、血小板抗体(CD41a+IgG、CD41a+IgM)水平、血清IgG、血清IgM、血清IgA、血清IgE、均无明显的相关性(r=-0.033、-0.168、-0.064、-1.380、0.026、-0.085、0.040、-0.007、-0.064,均P>0.05),与B1细胞(CD5+CD19+)呈负相关(n=66,r=-0.273,P=0.028)(图1),与外周血杀伤T细胞(CD3+CD8+)呈负相关(n=41,r=-0.387,P=0.012)(图2),与外周血辅助/杀伤T细胞比值(CD3+CD4+/CD3+CD8+)呈正相关(n=41,r=0.358,P=0.028)(图3),与外周血血小板计数呈正相关(n=66,r=0.314,P=0.011)(图4)。

ITP是最常见的自身免疫性出血性疾病,其发病机制除了经典的自身反应性B细胞产生抗体破坏血小板的发病机制外,还与CD8+ T细胞对血小板及巨核细胞的直接破坏有关[4],另外,DC亚群失衡、调节性B细胞(Breg细胞)功能下降等因素也被认为与ITP发病相关[5,6]。近些年NK细胞作为一种免疫调节细胞在自身免疫性疾病也越来越受到关注。研究发现SLE患者外周血中NK细胞数量、细胞杀伤活性显著降低,且合并关节炎和血小板减少的患者NK细胞数量的减少更加显著,认为NK细胞在疾病中主要起保护性作用[1]。此外RA[7]、Graves病[8]中也有类似发现。在ITP患者体内,也有研究发现NK细胞的数量是降低的,且病情越重,NK细胞数量降低越明显[9,10],另外,Ebbo等[11]将ITP患者及健康对照组脾脏中的NK细胞与K562细胞共培养,发现ITP患者NK细胞的杀伤功能下降。
NK细胞有重要的免疫调节作用,NK细胞对B细胞的分化有抑制作用,并且激活的NK细胞能够抑制B细胞产生自身抗体[12],成熟的CD8+T细胞虽然是有功能的,但因其缺乏主要组织相容性复合体-Ⅰ(MHC-Ⅰ)类分子而更容易被NK细胞杀伤[13]。成熟的NK细胞基于CD56的表达情况,可以分为两个亚群:CD56BrightNK亚群和CD56DimNK亚群。CD56BrightNK亚群处于NK细胞发育成熟的较早期阶段,CD56DimNK处于较成熟阶段,CD56DimNK来源于CD56BrightNK细胞,在NK细胞的发育过程中,NKG2A最先表达,之后是抑制性的免疫球蛋白样受体(KIR类),CD16在分化发育的后期表达[14]。
本研究不同于以往文献仅检测了NK细胞数量的变化,同时亦检测了其亚群组成的变化,表面受体及胞质蛋白的表达,并与ITP患者的免疫指标、临床指标及血小板水平做了相关性分析,检测NK细胞的功能指标更加全面,因此更具有代表性。本研究发现初诊ITP患者NK细胞及其亚群比例显著低于健康对照组,而初诊ITP患者经治疗后治疗有效组NK细胞比例显著高于难治组,提示ITP患者体内NK细胞数量减少,但经免疫治疗后得以提升;初诊ITP患者外周血CD56Bright亚群所占NK细胞的比例显著高于健康对照组,而其CD56Dim亚群较对照组降低,早期标志性抗原NKG2A初诊组显著高于对照组,晚期表达抗原CD16初诊组显著低于健康对照组,提示ITP患者体内NK细胞分化发育发生障碍,NK细胞没有完全分化,停留在早期阶段的NK细胞增多。另外,NKG2A也是NK细胞的抑制性受体,其表达升高,而激活性受体NKp44显著降低,初诊组ITP患者外周血NK细胞穿孔素的表达较对照组减低,提示NK细胞的功能降低,穿孔素途径减弱可能是NK细胞数量及功能不足的一种"表现",而我们将NK细胞与临床指标相关发现:NK细胞与外周血血小板计数呈正相关,与B1细胞及杀伤T细胞细胞呈负相关。由以上研究结果我们推测,ITP患者体内NK细胞数量减少、分化发育障碍、功能降低导致其对自身反应性B细胞、杀伤T细胞的抑制及杀伤不足,参与了疾病的发生。
在自身免疫性葡萄膜炎患者体内应用抗体封闭白细胞介素2受体(IL-2R)可以使调节性NK细胞扩增4~20倍,从而促进疾病的缓解。本研究发现ITP患者的NK细胞水平及功能减低,且与疾病严重程度相关。目前ITP的治疗主要是糖皮质激素、免疫抑制剂、丙种球蛋白等,是否可以通过体外扩增及自体回输NK细胞,为未来ITP的治疗提供了新的思路。



























