
分析细菌性肝脓肿合并败血症的临床特征、危险因素、临床结局等,为预防病情进展提供依据。
收集本院2011年1月1日至2015年12月31日住院确诊的细菌性肝脓肿合并败血症52例为病例组,随机选择相同时间内住院的无败血症的细菌性肝脓肿患者52例为对照组,分析比较病例组和对照组患者的临床、实验室、影像学及临床转归等指标。Logistic回归分析细菌性肝脓肿合并败血症的临床特征及危险因素。
与对照组比较,病例组患者合并糖尿病、合并恶性肿瘤、出现低蛋白血症、肾功能不全、黄疸、伴高血糖水平、多发脓肿及脓肿直径≥10 cm的比例均显著升高(P<0.05或<0.01)。病原学方面,细菌性肝脓肿合并败血症患者中血培养以肺炎克雷伯杆菌最多见(63.3%),其次是大肠埃希菌(16.7%)。单因素Logistic回归分析显示合并糖尿病(OR=2.200,95%CI 1.042~4.646)、合并恶性肿瘤(OR=3.667,95%CI 1.023~13.143)、低蛋白血症(OR=2.800,95%CI 1.009~7.774)、肾功能不全(OR=3.167,95%CI 1.265~7.929)、高血糖水平(OR=3.400,95%CI 1.254~9.216)、多发脓肿(OR=2.667,95%CI 1.043~6.815)及脓肿直径≥10 cm(OR=5.000,95%CI 1.096~22.820)是细菌性肝脓肿合并败血症的危险因素,多因素Logistic回归分析显示,脓肿直径≥10 cm(OR=14.016,95%CI 1.354~145.070)是细菌性肝脓肿合并败血症的独立危险因素。
败血症是细菌性肝脓肿常见的合并症,临床上应根据其相关的危险因素采取切实有效的预防和控制措施。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
细菌性肝脓肿是细菌侵入肝脏引起的感染性疾病,是临床上相对少见但较为严重的疾病,世界范围内的发病率为0.006%~2.2%[1,2],尤其在亚洲地区发病率较高,并有文献报道病死率可高达6%~14%[3,4,5]。既往文献显示糖尿病、肝硬化、恶性肿瘤、肝移植、败血症等是影响细菌性肝脓肿患者预后的危险因素[6,7,8],同时细菌性肝脓肿患者中败血症、眼内炎、中枢神经系统感染、恶性肿瘤等的发病率较高[9,10,11,12],其中败血症作为细菌性肝脓肿常见的合并症[1,2],不仅可增加病死率、严重影响预后,还增加临床诊治难度、延误病情。因此研究分析细菌性肝脓肿合并败血症的危险因素,为临床上细菌性肝脓肿合并败血症的诊疗过程,提前预测预后提供理论依据。
连续收集2011年1月1日至2015年12月31日在南京医科大学第一附属医院诊断为细菌性肝脓肿的患者(年龄>18岁)。其中经血培养证实有细菌生长且有全身感染中毒症状的肝脓肿患者52例作为病例组,对照病例是将肝脓肿患者住院时间顺序排位,选择相近住院时间(相差≤3 d)、血培养阴性且无明显全身感染中毒症状的肝脓肿患者。
细菌性肝脓肿诊断标准参考第8版外科学制定的诊断标准及文献:(1)有临床表现;(2)有超声或CT或MRI的影像学表现;(3)血培养或脓液培养的证据;(4)手术证实有肝脓肿;(5)当缺乏细菌培养证据或手术所见证据时,抗生素治疗后脓腔缩小或消失、治疗有效。败血症诊断标准:(1)临床具有全身炎症反应综合征(SIRS)的表现;(2)血培养至少一种病原菌阳性,且排除污染菌;(3)有白细胞计数(WBC)、中性粒细胞百分比(NEU%)、C-反应蛋白(CRP)及降钙素原(PCT)等炎症指标的升高。
(1)没有在本院接受完整治疗的病例;(2)肝脓肿不是作为第一诊断病因的病例;(3)阿米巴肝脓肿、真菌性肝脓肿病例;(4)腹腔肝外脓肿、肝脏肿瘤误诊为肝脓肿的病例。
采用回顾性分析研究方法,收集病例并对临床资料进行统一整理、统计,调查内容包括患者一般信息、基础疾病、合并症、住院时间、生命体征、实验室检查结果、脓肿特征及转归等信息。
应用SPSS 20.0统计软件进行统计分析,对计数资料采用χ2或Fisher确切概率法检验。危险因素采用单因素、多因素Logistic回归分析。P<0.05为差异有统计学意义。
细菌性肝脓肿合并败血症组和无败血症组患者的性别、年龄、住院天数、合并腹腔手术史、血肌酐水平、脓肿位置等方面均无明显差异(P值均>0.05),但分析两组的糖尿病、恶性肿瘤、血清白蛋白、血尿素氮、空腹血糖、血胆红素、脓肿个数、脓肿直径这些方面,差异有统计学意义(P值均<0.01或<0.05)。其中,细菌性肝脓肿合并败血症组中,合并糖尿病、恶性肿瘤、伴低蛋白血症、肾功能不全、黄疸、多发脓肿、脓肿直径≥10 cm的比例均高于无败血症组。同时,炎症指标可见,两组患者的CRP和PCT升高比例可达95%以上,见表1。

肝脓肿患者一般情况比较[例(%)]
肝脓肿患者一般情况比较[例(%)]
| 相关指标 | 病例组(n=52) | 对照组(n=52) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 年龄(岁) | |||||
| <60 | 21( 40.4) | 21( 40.4) | |||
| ≥60 | 31( 59.6) | 31( 59.6) | 0.000 | >0.05 | |
| 性别 | |||||
| 男 | 36( 69.2) | 39( 75.0) | |||
| 女 | 16( 30.8) | 13( 25.0) | 0.430 | >0.05 | |
| 住院时间(周) | |||||
| <2 | 9( 17.3) | 12( 23.1) | |||
| ≥2 | 43( 82.7) | 40( 76.9) | 0.537 | >0.05 | |
| 合并症 | |||||
| 糖尿病 | 26( 50.0) | 14( 26.9) | 5.580 | <0.05 | |
| 恶性肿瘤 | 11( 21.2) | 3( 5.8) | 4.044 | <0.05 | |
| 胆道感染史 | 8( 15.4) | 20( 38.5) | 7.038 | <0.01 | |
| 腹腔手术史 | 13( 25.0) | 11( 21.2) | 0.217 | >0.05 | |
| Alb(g/L) | |||||
| <35 | 45( 86.5) | 36( 69.2) | |||
| ≥35 | 7( 13.5) | 16( 30.8) | 4.522 | <0.05 | |
| BUN(mmol/L) | |||||
| <8.2 | 32( 61.5) | 45( 86.5) | |||
| ≥8.2 | 20( 38.5) | 7( 13.5) | 8.454 | <0.01 | |
| Cr(μmol/L) | |||||
| <133 | 48( 92.3) | 48( 92.3) | |||
| ≥133 | 4( 7.7) | 4( 7.7) | 0.000 | >0.05 | |
| 空腹血糖(mmol/L) | |||||
| <7.0 | 22( 42.3) | 33( 36.5) | |||
| ≥7.0 | 30( 57.7) | 19( 63.5) | 4.669 | <0.05 | |
| 血胆红素水平(μmol/L) | |||||
| <34.2 | 39( 75.0) | 47( 90.4) | |||
| ≥34.2 | 13( 25.0) | 5( 9.6) | 4.300 | <0.05 | |
| WBC>10×109/L | 40( 76.9) | 23( 44.2) | 11.636 | <0.01 | |
| NEU%>75% | 50( 96.2) | 46( 88.5) | 2.167 | >0.05 | |
| aCRP>10 mg/L | 50(100.0) | 40( 95.2) | - | >0.05 | |
| bPCT>0.05 ng/mL | 42(100.0) | 40(100.0) | - | >0.05 | |
| 脓肿个数 | |||||
| <2 | 31( 59.6) | 41( 78.8) | |||
| ≥2 | 21( 40.4) | 11( 21.2) | 4.514 | <0.05 | |
| 脓肿位置 | |||||
| 右叶 | 45( 86.5) | 41( 78.8) | |||
| 左叶 | 7( 13.5) | 11( 21.2) | 1.075 | >0.05 | |
| 脓肿直径(cm) | |||||
| <10 | 39( 75.0) | 47( 90.4) | |||
| ≥10 | 13( 25.0) | 5( 9.6) | 4.300 | <0.05 | |
注:"-" . Fisher确切概率法;a病例组和对照组的CRP病例数分别为50和42;b病例组和对照组的PCT病例数分别为42和40;Alb.白蛋白;BUN.尿素氮;Cr.肌酐;WBC.白细胞计数;NEU%.中性粒细胞百分比;CRP.C-反应蛋白;PCT.降钙素原;病例组.肝脓肿合并败血症组;对照组.肝脓肿组
在病原学方面,细菌性肝脓肿合并败血症组血培养共分离病原菌60株,其中革兰阴性菌50株(83.3%),以肺炎克雷伯杆菌多见(63.3%),其次为大肠埃希菌(16.7%);革兰阳性菌10株(16.7%),以粪肠球菌多见(8.3%),见表2。
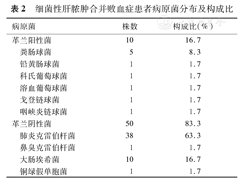
细菌性肝脓肿合并败血症患者病原菌分布及构成比
细菌性肝脓肿合并败血症患者病原菌分布及构成比
| 病原菌 | 株数 | 构成比(%) | |
|---|---|---|---|
| 革兰阳性菌 | 10 | 16.7 | |
| 粪肠球菌 | 5 | 8.3 | |
| 铅黄肠球菌 | 1 | 1.7 | |
| 科氏葡萄球菌 | 1 | 1.7 | |
| 溶血葡萄球菌 | 1 | 1.7 | |
| 戈登链球菌 | 1 | 1.7 | |
| 咽峡炎链球菌 | 1 | 1.7 | |
| 革兰阴性菌 | 50 | 83.3 | |
| 肺炎克雷伯杆菌 | 38 | 63.3 | |
| 鼻臭克雷伯杆菌 | 1 | 1.7 | |
| 大肠埃希菌 | 10 | 16.7 | |
| 铜绿假单胞菌 | 1 | 1.7 | |
以是否合并败血症为因变量(Y=1,Y=0),以收集的可能相关因素项目为自变量,分别对每个自变量做单因素Logistic回归分析。两分类变量采用0、1赋值。其中年龄≥60岁、性别为男、住院时间≥2周、合并糖尿病、合并胆道感染史、合并恶性肿瘤史、合并腹腔手术史、白蛋白<35 g/L、BUN≥8.2 mmol/L、Cr≥133 μmol/L、空腹血糖≥7.0 mmol/L、脓肿个数≥2个、脓肿位置位于右叶及脓肿直径≥10 cm分别赋值为1。经单因素Logistic回归分析后显示合并糖尿病、合并恶性肿瘤、白蛋白<35 g/L、BUN≥8.2 mmol/L、空腹血糖≥7.0 mmol/L、脓肿个数≥2个及脓肿直径≥10 cm是细菌性肝脓肿合并败血症的危险因素,见表3。
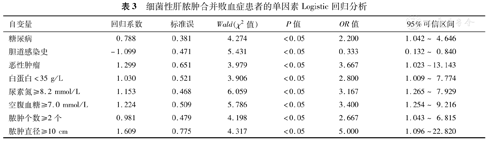
细菌性肝脓肿合并败血症患者的单因素Logistic回归分析
细菌性肝脓肿合并败血症患者的单因素Logistic回归分析
| 自变量 | 回归系数 | 标准误 | Wald(χ2值) | P值 | OR值 | 95%可信区间 |
|---|---|---|---|---|---|---|
| 糖尿病 | 0.788 | 0.381 | 4.274 | <0.05 | 2.200 | 1.042~ 4.646 |
| 胆道感染史 | -1.099 | 0.471 | 5.431 | <0.05 | 0.333 | 0.132~ 0.840 |
| 恶性肿瘤 | 1.299 | 0.651 | 3.979 | <0.05 | 3.667 | 1.023~13.143 |
| 白蛋白<35 g/L | 1.030 | 0.521 | 3.906 | <0.05 | 2.800 | 1.009~ 7.774 |
| 尿素氮≥8.2 mmol/L | 1.153 | 0.468 | 6.059 | <0.05 | 3.167 | 1.265~ 7.929 |
| 空腹血糖≥7.0 mmol/L | 1.224 | 0.509 | 5.786 | <0.05 | 3.400 | 1.254~ 9.216 |
| 脓肿个数≥2个 | 0.981 | 0.479 | 4.198 | <0.05 | 2.667 | 1.043~ 6.815 |
| 脓肿直径≥10 cm | 1.609 | 0.775 | 4.317 | <0.05 | 5.000 | 1.096~22.820 |
将单因素分析中对细菌性肝脓肿合并败血症的有显著性影响的因素纳入进行多因素Logistic回归分析。变量进入水准为P<0.05。多因素Logistic回归分析显示:肝脓肿直径≥10 cm是细菌性肝脓肿合并败血症的独立危险因素,见表4。
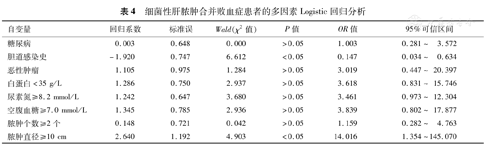
细菌性肝脓肿合并败血症患者的多因素Logistic回归分析
细菌性肝脓肿合并败血症患者的多因素Logistic回归分析
| 自变量 | 回归系数 | 标准误 | Wald(χ2值) | P值 | OR值 | 95%可信区间 |
|---|---|---|---|---|---|---|
| 糖尿病 | 0.003 | 0.648 | 0.000 | >0.05 | 1.003 | 0.281~ 3.572 |
| 胆道感染史 | -1.920 | 0.747 | 6.612 | <0.05 | 0.147 | 0.034~ 0.634 |
| 恶性肿瘤 | 1.105 | 0.975 | 1.284 | >0.05 | 3.019 | 0.447~ 20.397 |
| 白蛋白<35 g/L | 1.286 | 0.750 | 2.937 | >0.05 | 3.618 | 0.831~ 15.746 |
| 尿素氮≥8.2 mmol/L | 1.242 | 0.647 | 3.680 | >0.05 | 3.461 | 0.973~ 12.304 |
| 空腹血糖≥7.0 mmol/L | 1.345 | 0.785 | 2.936 | >0.05 | 3.839 | 0.802~ 17.877 |
| 脓肿个数≥2个 | 0.148 | 0.721 | 0.042 | >0.05 | 1.159 | 0.282~ 4.763 |
| 脓肿直径≥10 cm | 2.640 | 1.192 | 4.903 | <0.05 | 14.016 | 1.354~145.070 |
细菌性肝脓肿是细菌侵入肝脏引起的化脓性炎症性疾病,多地区都有文献报道肝脓肿是潜在的威胁生命的疾病[6,10,13,14,15,16],亚洲地区多见[17],且发病率呈上升趋势,败血症作为细菌性肝脓肿常见的并发症及危险因素[2,18],可导致患者出现水、电解质、酸碱平衡紊乱,甚至引起休克、DIC或全身多脏器功能衰竭等,从而进一步加重肝脓肿患者的病情、增加病死率,有文献指出败血症本身病死率就可高达10%[19,20],但是细菌性肝脓肿合并败血症患者早期临床表现不典型,常导致误诊、漏诊,而且病情发展迅速,因此研究分析细菌性肝脓肿合并败血症的危险因素,早发现、早诊断、早治疗,可有效防止疾病的进展。
我们调查的病例研究发现病例组与对照组间年龄、性别、合并腹腔手术史等一般情况方面无明显差异,两组间炎症指标方面如中性粒细胞百分比、CRP或PCT等也无明显差异,且CRP或PCT的升高比例可达95%以上,与既往报道文献相似[1],但表1中可见病例组中WBC>10×109/L的比例高于对照组,有统计学意义(P<0.05),这可能是因为细菌性肝脓肿患者在未明确病因前已于院外行抗生素治疗,但合并败血症组多病情较重。而且两组间数据可见中性粒细胞百分比升高(92.3%)较白细胞计数升高(60.6%)更敏感,与以前的研究结果一致[2]。病原学方面,细菌性肝脓肿合并败血症组血培养可见以革兰阴性菌(83.3%)多见,尤其是肺炎克雷伯杆菌(63.3%),对临床经验性用药有指导意义。本研究单因素Logistic回归分析中发现合并糖尿病、合并恶性肿瘤、低蛋白血症、肾功能不全、空腹高血糖水平、多发脓肿、脓肿直径≥10 cm等是细菌性肝脓肿合并败血症的危险因素,而在多因素Logistic回归中发现仅有脓肿直径≥10 cm是细菌性肝脓肿合并败血症的独立危险因素(OR=14.016,95%CI 1.354~145.07),且使细菌性肝脓肿患者发生败血症的风险是脓肿直径<10 cm患者的14倍左右,既往文献显示脓肿直径≥10 cm的患者多病情较重[1,2,18],且脓肿直径<5 cm的肝脓肿根据微生物培养的药敏试验结果,使用敏感的抗生素规范化治疗4~6周常可达到较好疗效[21,22],5~10 cm大小的肝脓肿一般需要穿刺引流联合抗生素治疗,直径≥10 cm的肝脓肿需引起重视,积极穿刺引流联合抗生素治疗,效果不佳可考虑外科手术治疗[21,23,24],这些都说明临床上脓肿直径≥10 cm的细菌性肝脓肿患者应提高警惕,治疗上积极应对,更要预防出现败血症等合并症进一步加重病情。
研究结果显示,多因素Logistic回归分析提示胆道感染史的OR=0.147,95%CI 0.034~0.634,但胆道感染史并不是细菌性肝脓肿合并败血症的保护性因素,这可能是因为临床上这些患者因有急性或慢性胆道感染病史,当诊断不明时出现发热、寒战、腹痛等症状后早期或预防性应用抗生素的原因。
总之,细菌性肝脓肿患者脓肿直径≥10 cm合并败血症的风险较大,临床上细菌性肝脓肿患者因其为深部脓肿,临床表现不典型,病程中有高热、寒战、腹痛等症状的患者,应早期应首选行B超或CT等影像学检查明确诊断,如脓肿直径≥10 cm应予以高度重视并警惕合并败血症,预防休克、DIC或全身多脏器功能衰竭等并发症。尤其持续高热的患者,需及时、多次行血培养、骨髓培养等细菌学检查,并行药敏试验根据结果调整敏感抗生素,联合穿刺引流效果不佳时可积极考虑外科手术治疗。
利益冲突 无



























