
探讨儿童纤维肌性发育不良(FMD)所致的肾动脉分支病变的类型和腔内治疗的临床疗效。
回顾性分析2014年6月至2015年12月河南省人民医院血管外科收治的8例FMD所致肾动脉分支病变患儿资料。常规行肾动脉CT血管造影(CTA)检查,明确肾动脉病变性质,并进一步行数字减影血管造影(DSA)明确诊断并分析病变特点。分析肾动脉分支病变类型及腔内治疗术后患儿血压、肾素水平、肾小球率过滤(GFR)、再狭窄等相关指标,并记录疾病转归。
8例患儿中涉及二级分支6例,涉及三级分支2例;累及2条及以上分支动脉4例,累及1条分支动脉4例;伴有囊性扩张或动脉瘤5例,其中发生夹层动脉瘤伴有局部肾梗死患者1例,伴有动脉瘤且动脉瘤位于分支分叉处者1例;仅发生动脉狭窄3例。造影显示局灶性病变者5例,多灶性病变3例。1例出现动脉瘤伴夹层样改变,分支动脉涉及的肾脏组织发生肾梗死,患儿血压可以通过药物得以良好控制,未实施手术治疗。另7例患儿行腔内治疗术,手术成功率100%,无明显动脉夹层、破裂、栓塞等手术并发症。术后1周患儿血压明显改善,肾功能未见异常,肾素活性水平下降,GFR恢复。术后随访3~12个月,3例高血压好转,4例高血压治愈,所有患儿术后肾素水平及GFR好转,随访期间发生再狭窄2例再次手术,1年后所有患儿的狭窄部位血流通畅,无明显狭窄。
FMD可引起肾动脉分支发生多样病变,应首选腔内治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
纤维肌性发育不良(FMD)引起的肾动脉病变是儿童及青少年继发性高血压的主要原因之一[1]。FMD是一种少见的节段性的非动脉硬化性和非炎症性的先天性血管疾病,可以表现为血管狭窄、瘤样扩张或动脉瘤、夹层等病变类型。FMD特征性影像学表现为动脉的"串珠样"改变,可以涉及全身的血管床,而以肾血管病变最为常见[2,3,4]。由于有些患者缺乏特异性症状及一些临床工作者缺乏对本病的充分认识而造成一些患者不能得以确诊[5,6],特别是FMD引起的肾动脉二级或三级分支病变报道较少。因为FMD引起的肾动脉细小分支病变复杂的病变解剖和病变类型及患者的年龄较小,所以涉及细小分支的肾动脉FMD病变给腔内治疗带来了挑战。本研究回顾性分析了8例分支病变类型的肾动脉FMD患儿的临床资料,探讨FMD引起肾动脉分支病变类型和腔内处理肾动脉FMD的治疗策略和临床预后。
回顾性分析2014年6月至2015年12月河南省人民医院血管外科收治的8例FMD所致肾动脉分支病变患儿的临床资料,见表1。本研究已获得医院伦理委员会通过及患儿监护人知情同意。
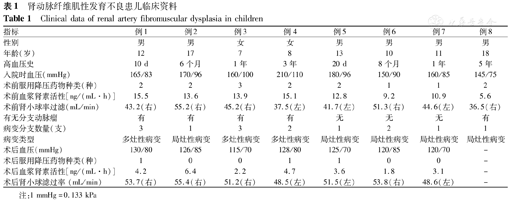
肾动脉纤维肌性发育不良患儿临床资料
Clinical data of renal artery fibromuscular dysplasia in children
肾动脉纤维肌性发育不良患儿临床资料
Clinical data of renal artery fibromuscular dysplasia in children
| 指标 | 例1 | 例2 | 例3 | 例4 | 例5 | 例6 | 例7 | 例8 |
|---|---|---|---|---|---|---|---|---|
| 性别 | 男 | 男 | 女 | 女 | 男 | 男 | 男 | 男 |
| 年龄(岁) | 12 | 17 | 7 | 8 | 13 | 10 | 11 | 18 |
| 高血压史 | 10 d | 6个月 | 1年 | 3年 | 20 d | 8个月 | 1年 | 5年 |
| 入院时血压(mmHg) | 165/83 | 170/96 | 160/100 | 210/110 | 180/96 | 150/90 | 160/85 | 145/75 |
| 术前服用降压药物种类(种) | 2 | 2 | 3 | 2 | 2 | 1 | 1 | 2 |
| 术前血浆肾素活性[ng/(mL·h)] | 15.5 | 13.6 | 13.9 | 15.1 | 12.8 | 9.2 | 10.9 | 5.6 |
| 术前肾小球率过滤(mL/min) | 43.2(右) | 55.2(右) | 45.2(右) | 37.5(左) | 41.7(左) | 51.3(右) | 44.6(左) | 36.5(右) |
| 有无分支动脉瘤 | 有 | 有 | 有 | 有 | 无 | 无 | 无 | 有 |
| 病变分支数量(支) | 3 | 1 | 3 | 2 | 1 | 2 | 1 | 1 |
| 病变类型 | 多灶性病变 | 局灶性病变 | 多灶性病变 | 多灶性病变 | 局灶性病变 | 局灶性病变 | 局灶性病变 | 局灶性病变 |
| 术后血压(mmHg) | 130/80 | 126/85 | 115/70 | 128/80 | 125/70 | 120/85 | 120/70 | - |
| 术后服用降压药物种类(种) | 1 | 0 | 0 | 1 | 1 | 0 | 0 | - |
| 术后血浆肾素活性[ng/(mL·h)] | 4.2 | 6.4 | 2.2 | 4.7 | 3.6 | 1.8 | 3.1 | - |
| 术后肾小球滤过率(mL/min) | 53.7(右) | 55.4(右) | 51.2(右) | 48.5(左) | 51.5(左) | 53.8(右) | 48.6(左) | - |
注:1 mmHg=0.133 kPa
所有患儿入院后行肝、肾功能,肾素活性,风湿三项,自身抗体,甲状腺激素等检查以排除血管炎性疾病和其他疾病引起的继发性高血压。肾素活性检查显示患儿出现不同程度的肾素活性水平增高。肾动态显影(ECT)显示病变肾脏出现肾小球滤过率(GFR)下降。患者术前主要阳性指标分布见表1。术前1周给予阿司匹林肠溶片100 mg/d,氯吡格雷片75 mg/d等抗血小板药物治疗。常规行肾动脉CT血管造影(CTA)检查,明确肾动脉病变性质,并进一步行数字减影血管造影(DSA)明确诊断并分析病变特点。
常规穿刺右侧股动脉入路,行肾动脉选择性造影明确病变特点。全身肝素化(100 U/kg)后,更换肾双弯导管(RDC导管)和眼镜蛇导管(Cobra导管)同轴超选择进入病变部位,更换0.014导丝后送入快速交换球囊(2.5~5.0 mm)扩张狭窄部位。扩张后撤出球囊复查造影,如出现严重残余狭窄(>50%)更换直径稍大球囊给予再次扩张。
术后再狭窄定义为术后出现原发部位狭窄>50%且伴难以控制的血压再次升高或再狭窄>75%。高血压疗效标准参考文献[1]。所有患儿术后住院观察1周并检测血压,积极调整降血压药物种类和数量。患儿术后给予氯吡格雷片和阿司匹林肠溶片100 mg/d治疗3个月,随后坚持服用阿司匹林抗血小板治疗,服药期间观察有无出血并发症。出院后6、12个月后来院复诊,观察血压变化、肾功能、肾素水平和肾小球率过滤情况。1年后复查CTA。随访期间出现难以控制的血压升高给予再次行CTA或DSA检查。
所有患儿均为FMD引起的单侧肾脏分支病变,无其他脏器动脉受累。涉及二级分支6例,涉及三级分支2例;累及2条及以上分支动脉4例,累及1条分支动脉4例;伴有囊性扩张或动脉瘤5例,其中发生夹层动脉瘤伴局部肾梗死患者1例,伴动脉瘤且动脉瘤位于分支分叉处者1例;仅发生动脉狭窄3例。局灶性病变者5例,其中管样狭窄2例;多灶性病变(指呈"串珠样"改变或多处血管损害)3例。相关病变类型分布见表1,图1、图2。
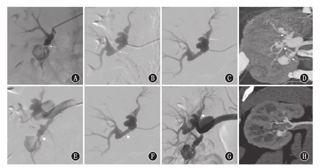
Selectively renal artery angiographies and computed tomography angiography before and after operation

注:A、B、C:显示此患儿3支肾动脉发生严重狭窄伴分支动脉瘤(箭头示狭窄部位);D:术前CT血管造影显示肾脏局部灌注缺血(白线以上区域低灌注);E、F、G:显示术后血管通畅(三角形示狭窄解除);H:术后1年CTA显示血管通畅和肾灌注良好,动脉瘤未见明显变化
A,B,C:the children with 3 renal artery severe stenosis with branch aneurysms (arrows showed stenosis);D:preoperative computed tomography angiography showed renal perfusion ischemia,hypoperfusion in the upper pole of the right kidney (above white line);E,F,G:vascular patency after operation (triangular showed stenosis release);H:1 year after operation,computed tomography angiography showed vascular patency and maintained renal perfusion,no obvious changes in aneurysms
Selectively renal artery angiographies and computed tomography angiography before and after operation
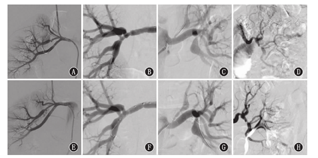
Different imaging findings of renal fibromuscular dysplasia in child with branch arterial disease before and after operation

注:A、B、C、D:术前病变特点;E、F、G、H:术后造影表现
A,B,C,D:preoperative lesions characteristics;E,F,G,H:postoperative angiography
Different imaging findings of renal fibromuscular dysplasia in child with branch arterial disease before and after operation
在FMD累及的肾动脉分支病变中,1例出现多发的二级或三级分支动脉瘤伴分支严重狭窄,动脉瘤位于分支动脉分叉处,无明显瘤颈,且动脉瘤最大直径10.6 mm×12.6 mm(图3),考虑到患儿的年龄较小(12岁)及较高的介入手术风险,暂不处理分支动脉瘤,仅给予狭窄处球囊扩张术。1例出现动脉瘤伴夹层样改变,分支动脉涉及的肾脏组织发生肾梗死,患儿血压可以通过药物得以良好控制,因此未实施手术治疗(图3)。所有行介入治疗的7例患儿手术成功率为100%,无明显动脉夹层、破裂、栓塞等手术并发症(图1、图2)。术后1周患儿血压明显改善,肾功能未见异常,肾素活性水平下降,GFR恢复。
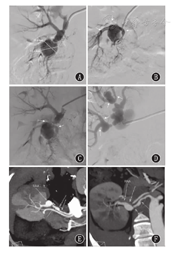
Imaging manifestations of renal branch aneurysms due to fibromuscular dysplasia

注:A、B、C:不同投射角度显示下分支动脉瘤位于分支动脉分叉处,累及分叉动脉,无明显瘤颈(箭头指示分叉动脉);D:显示中、上分支动脉瘤;E、F:CT血管造影显示纤维肌性发育不良相关肾夹层动脉瘤导致肾梗死表现
A,B,C:different projection angles showed lower aneurysms located in the branch artery bifurcation,involving the bifurcated artery,no obvious aneurysm neck (arrow indicated the bifurcation artery);D:showed middle and upper branch aneurysms;E,F:computed tomography angiography showed renal septal aneurysm leading to renal infarction due to fibromuscular dysplasia
Imaging manifestations of renal branch aneurysms due to fibromuscular dysplasia
在1年的随访中,2例患儿病变部位出现再狭窄(再狭窄率为28.6%),其中1例在术后第4个月出现血压突然增高,增加药物控制血压不佳,再次行DSA发现病变部位再狭窄,再次行球囊扩张;另1例患儿在术后6个月随访中CTA显示病变部位明显再狭窄(80%),予再次腔内治疗。所有患儿1年的随访中3例血压改善,4例高血压治愈(治愈率57%)。1年后复查CTA显示狭窄部位血流通畅,无明显狭窄。1例患儿伴多个肾内分支动脉瘤,尽管未予处理,但1年后随访动脉瘤保持稳定(术后随访最大动脉瘤直径10.6 mm×9.4 mm,见图1)。
FMD主要发生于幼年或青年、中年女性,根据病变主要累及动脉壁的层次,FMD常分为3个组织学分型:内膜纤维组织增生型、外膜纤维组织增生型、中膜发育不良型,最常见为中膜发育不良型,表现为典型的"串珠样"改变或肾动脉中段和远端的多灶性狭窄,其他2种类型主要表现为管样狭窄或局灶性病变[7,8]。本研究报道的8例患儿表现为不同的分支病变类型,包括"串珠样"改变,局灶性狭窄,长段管样狭窄,或合并动脉瘤,或合并夹层表现,比较全面地显示了FMD引起分支病变特点。
有研究报道,即使小分支的肾动脉狭窄也可以造成肾组织的局部缺血,产生肾小球的低灌注促使肾素分泌,从而产生全身性肾血管性高血压[6]。本研究中,所有患儿的肾动脉狭窄尽管发生在远端小分支动脉,然而仍可造成肾脏的局部缺血使患儿发生严重的高血压,经过介入治疗后患儿肾素水平和血压得到有效控制。FMD肾动脉分支病变患儿的临床特点是出现恶性高血压或难治性高血压,伴有肾素活性增高,GFR下降,虽然部分患儿肾动脉超声未见明显异常,然而进一步行CTA或选择性肾动脉造影发现肾动脉末端分支出现狭窄表现。因此如果年轻患者出现恶性高血压且无其他原因解释者,应注意进一步行CTA或DSA筛查肾动脉分支病变。
腔内治疗和外科手术能够有效地处理FMD引起的肾动脉狭窄,而球囊扩张成形术是治疗FMD引起的肾动脉狭窄的主要手段[9]。因为FMD导致血管中膜的过度增生反应和血管壁异常,支架置入可能加剧局部的病变,所以不推荐常规应用支架植入术治疗FMD引起的肾动脉病变[10]。球囊扩张成形术作为首选的治疗方法,能够取得优异的长期临床疗效[11]。然而FMD累及到肾脏远端细小分支动脉的病变给腔内治疗带来操作的困难,尤其合并肾动脉瘤时,介入操作易于引起血管破裂、夹层、痉挛或远端栓塞等。因此,应术前充分评估解剖特点,选择合适的球囊,避免多次操作。术中选择球囊以周围正常肾动脉直径为标准选择球囊直径,扩张后残余狭窄低于50%即达到扩张的效果,而且FMD引起的"串珠样"改变应全程扩张,而出现的肾动脉多处狭窄应逐一扩张。说明尽管所有患儿治疗后仍存在轻微的残余狭窄,但患儿高血压等临床症状改善明显,长期随访结果满意。
本研究中多例动脉瘤发生在肾动脉二级或三级分支的分叉处,较为少见。而另一患儿分支动脉瘤导致了远端的肾梗死。目前治疗FMD相关肾动脉瘤主要包括外科治疗和介入治疗。因为腔内治疗主要依赖动脉瘤的解剖特点,所以肾动脉瘤的破裂风险因素和最佳的介入治疗方案仍然存在争议[11,12]。一般来说,当肾动脉瘤超过20 mm时破裂风险增加,需要积极处理[2]。本研究中1例肾动脉瘤患儿缺乏有效的瘤颈,直径<20 mm,且病史较长,介入风险较大,暂时保守治疗,随访1年显示动脉瘤未见明显变化,这可能由于肾动脉狭窄处理后患儿的血压明显下降,减少了对动脉瘤的压力。
综上所述,儿童FMD引起的肾动脉分支病变较为少见,可导致肾动脉远端分支狭窄、动脉瘤或夹层表现。即使是细小分支动脉的狭窄仍可造成全身性高血压,球囊扩张成形术治疗FMD引起的肾动脉分支病变具有安全、有效、成功率高等特点,能够取得长期的临床疗效。肾动脉狭窄合并分支动脉瘤的治疗应根据瘤体的尺寸、形态、解剖特点和病情评估选择个体化治疗方案。



























