
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
主动脉内球囊反搏(IABP)是目前应用最广泛的机械循环辅助装置,是通过动脉系统置入一根带气囊的导管到左锁骨下以远、肾动脉以上的降主动脉内,在心脏的舒张期气囊充气,在心脏的收缩期气囊放气,起到对心脏辅助的作用。1952年Kantrowitz的实验为反搏技术提供理论基础,1958年Harken首次提出主动脉内球囊反搏的概念,60年代初Class等开始探索主动脉内球囊反搏方法。1968年Kantrowitz首次用于心源性休克的治疗并获得成功[1]。1973,IABP首次用于心脏外科手术术中辅助体外循环停机。随着技术进步,反搏装置及气囊导管的不断改进,IABP在临床的应用越来越广泛,已经成为心脏重症患者治疗不可或缺的手段。IABP临床应用已有半个世纪的时间,全球约有1百万例患者接受过IABP辅助治疗,在美国每年约有7万例患者植入IABP,国内尚无相关的统计数据。
调查研究显示,不同医疗机构IABP在临床的应用存在很大的不同[2],随着心脏外科手术量的不断增加,IABP的临床应用亦越来越多,IABP应用的共识国内尚处于空白阶段。中国心脏重症主动脉内球囊反搏治疗专家委员会基于循证医学证据以及多名心脏重症专家的临床经验制定IABP心脏外科围手术期应用专家共识,共识的推荐强度由推荐级别及证据等级组成,推荐级别:Ⅰ类:已证实和(或)一致公认有效;Ⅱ类:有用性和有效性的证据尚有矛盾或存在不同观点;Ⅱa类:有关证据和(或)观点倾向于有用和有效;Ⅱb类:有关证据和(或)观点尚不能充分说明有用和有效;Ⅲ类:已证实和(或)一致公认无用和无效并在有些病例可能有害,不推荐应用。证据水平:证据水平A:资料来源于多项随机临床试验或荟萃分析;证据水平B:资料来源于单项随机临床试验或多项非随机试验;证据水平C:专家共识和(或)小型试验结果。
IABP辅助原理是IABP的球囊位于锁骨下动脉与肾动脉之间的降主动脉,在心电或压力信号的触发下,在心脏的舒张期气囊迅速充气,使主动脉内的舒张期压力升高,IABP可以使主动脉舒张压较辅助之前提高30%~70%。球囊在心脏收缩期迅速放气,主动脉压(心室舒张期末主动脉压)随之降低5%~30%,左心室后负荷降低,同时心排血量增加0.5~1.0 L/min,最高增加30%左右。心排血量的增加是IABP球囊的泵吸作用所致,左心室的舒张末压和容积也因此降低10%~15%。Frank-Starling曲线左移提示左心室功能的改善。应用IABP时主动脉收缩压的峰值会降低5%~15%[3]。
IABP能够明显改善心肌氧供需平衡,增加心肌的氧供同时降低氧耗。IABP增加主动脉舒张压,改善冠状动脉的血流,增加氧供;降低左心室舒张末压,左心室室壁张力下降从而能降低氧耗,改善心内膜下的冠状动脉血流。
外周血管的血流取决于压力、阻力、血流经过的长度和内摩擦力。IABP在心脏舒张期充盈,血压升高,继之动静脉压力差增加,外周血流增加;同时充盈的球囊容积作为心搏出量的一部分,使心输出量增加,从而激活主动脉的压力感受器,使延髓的血管收缩反射受到抑制,外周血管的阻力下降,血流改善。研究显示IABP反搏可以提高心脏外科术后肾脏的灌注,增加桥血管的血流量,改善心室舒张功能[3]。
Benchmark注册研究共登记入选203家医院16 909例使用IABP的患者,发现IABP临床应用适应证包括:心导管术中或术后的血流动力学支持(20.6%)、心源性休克(18.8%)、辅助体外循环停机(16.1%)、高危冠状动脉旁路移植术(CABG)患者术前辅助(13%)、顽固性心绞痛(12.3%)、心力衰竭(6.5%)以及急性心肌梗死的机械并发症(5.5%)[4]。
克利夫兰心脏中心1995至2005年心脏外科手术(包括CABG、瓣膜手术以及瓣膜手术联合CABG)共30 269例,围手术期植入IABP共1 310例(4.32%),术前植入567例(43.3%)、术中植入673例(51.4%)、术后植入70例(5.3%),死亡率分别为术前植入12.6%、术中植入17.5%、术后植入47.7%[5]。心脏外科围手术期植入IABP的患者均为危重人群,相对于未置入者有着较高的死亡风险,术后较术前及术中植入预后差,瓣膜手术植入IABP较CABG手术植入预后差。回顾性分析显示IABP植入死亡的高危因素为:女性、吸烟史、术前的肌酐水平>120 mmol/L、主动脉的阻断时间>80 min以及术后植入IABP[6]。
研究证实对于高危CABG患者术前预防性植入IABP能够降低死亡率,减少住院时间及花费[7,8]。荟萃分析显示对于高危CABG患者预防性植入IABP可以降低住院死亡率,减少术后急性肾损伤、低心排血量综合征的发生率。但是近期的一项随机对照试验(RCT)得出了阴性的结果,在非急诊手术、血流动力学稳定、左心室射血分数(LVEF)<35%的CABG患者术前预防植入IABP并不能降低死亡率。随后的荟萃分析再次证实高危患者术前预防植入IABP能够获益(表1)。关于术前预防植入IABP的时机从术前24 h在ICU内植入到手术切皮以前,不同的医疗机构选择有所不同。高危人群的定义亦不尽相同,多集中在低的左室射血分数、左主干病变或广泛弥漫冠状动脉病变以及二次手术。
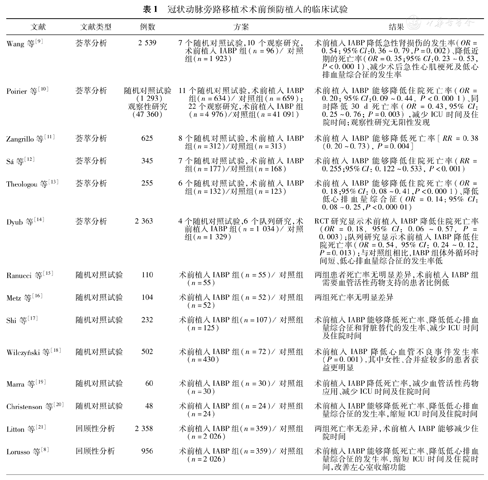
冠状动脉旁路移植术术前预防植入的临床试验
冠状动脉旁路移植术术前预防植入的临床试验
| 文献 | 文献类型 | 例数 | 方案 | 结果 |
|---|---|---|---|---|
| Wang等[9] | 荟萃分析 | 2 539 | 7个随机对照试验,10个观察研究,术前植入IABP组(n=96)/对照组(n=1 923) | 术前植入IABP降低急性肾损伤的发生率(OR=0.54; 95%CI:0.36~0.79,P=0.002)、降低近期的死亡率(OR=0.35;95%CI:0.23~0.53,P<0.000 1)、减少术后急性心肌梗死及低心排血量综合征的发生率 |
| Poirier等[10] | 荟萃分析 | 随机对照试验(1 293) | 11个随机对照试验,术前植入IABP组(n=634)/对照组(n=659);22个观察研究,术前植入IABP组(n=4 976)/对照组(n=41 091) | 术前植入IABP能够降低住院死亡率(OR=0.20; 95%CI:0.09~0.44, P<0.000 1)、同时降低30 d死亡率(OR=0.43,95%CI:0.25~0.76; P=0.003) ,减少ICU时间及住院时间;观察性研究无阳性发现 |
| 观察性研究(47 360) | ||||
| Zangrillo等[11] | 荟萃分析 | 625 | 8个随机对照试验,术前植入IABP组(n=312)/对照组(n=313) | 术前植入IABP能够降低死亡率[RR=0.38(0.20~0.73), P=0.004] |
| Sá等[12] | 荟萃分析 | 345 | 7个随机对照试验,术前植入IABP组(n=177)/对照组(n=168) | 术前植入IABP能够降低住院死亡率(RR=0.255;95%CI: 0.122~0.533, P<0.001) |
| Theologou等[13] | 荟萃分析 | 255 | 6个随机对照试验,术前植入IABP组(n=132)/对照组(n=123) | 术前植入IABP能够降低住院死亡率(OR=0.18;95%CI: 0.08~0.41,P<0.000 1)、降低低心排血量综合征(OR=0.14;95%CI: 0.08~0.25,P<0.000 01) |
| Dyub等[14] | 荟萃分析 | 2 363 | 4个随机对照试验,6个队列研究,术前植入IABP组(n=1 034)/对照组(n=1 329) | RCT研究显示术前植入IABP降低住院死亡率(OR=0.18, 95%CI: 0.06~0.57, P=0.003);队列研究显示术前植入IABP降低住院死亡率(OR=0.54, 95%CI: 0.24~0.12, P=0.013);与对照组相比,IABP组体外循环时间短、低心排血量综合征的发生率低 |
| Ranucci等[15] | 随机对照试验 | 110 | 术前植入IABP组(n=55)/对照组(n=55) | 两组患者死亡率无明显差异,术前植入IABP组需要血管活性药物支持的患者比例低 |
| Metz等[16] | 随机对照试验 | 104 | 术前植入IABP组(n=52)/对照组(n=52) | 两组死亡率无明显差异 |
| Shi等[17] | 随机对照试验 | 232 | 术前植入IABP组(n=107)/对照组(n=125) | 术前植入IABP能够降低死亡率、降低低心排血量综合征和肾脏替代的发生率、减少ICU时间及住院时间 |
| Wilczyński等[18] | 随机对照试验 | 502 | 术前植入IABP组(n=72)/对照组(n=430) | 术前植入IABP降低心血管不良事件发生率(P=0.001),其中女性、合并症较多的患者获益更明显 |
| Marra等[19] | 随机对照试验 | 60 | 术前植入IABP组(n=30)/对照组(n=30) | 术前植入IABP降低死亡率,减少血管活性药物应用、减少ICU时间及住院时间 |
| Christenson等[20] | 随机对照试验 | 48 | 术前植入IABP组(n=24)/对照组(n=24) | 术前植入IABP能够降低死亡率、降低低心排血量综合征的发生率,缩短ICU时间及住院时间 |
| Litton等[21] | 回顾性分析 | 2 358 | 术前植入IABP组(n=359)/对照组(n=2 026) | 两组死亡率无差异,术前植入IABP能够减少住院时间 |
| Lorusso等[8] | 回顾性分析 | 956 | 术前植入IABP组(n=359)/对照组(n=2 026) | 术前植入IABP能够降低死亡率、降低低心排血量综合征的发生率,缩短ICU时间及住院时间,改善左心室收缩功能 |
推荐意见1(Ⅱa A):建议高危患者CABG术前预防植入IABP。
有研究证实单独CABG术中及术后植入IABP与相同的危险因素的未植入IABP的患者相比,有降低总体手术死亡率的趋势[22]。术中由于其他原因导致的低心排血量综合征植入IABP相对于缺血的原因植入预后差。
尽管术中植入IABP辅助体外循环停机已成为共识,但是植入的适应证及时机难以分析,很难有循证医学的证据支持。
推荐意见2(ⅠC):在体外循环手术术中停机失败1次以上,推荐植入IABP。
心脏外科围手术期低心排血量综合征发生率约3%~45%,当通过调整正性肌力药物、优化前后负荷等治疗后低心排血量综合征仍无改善者,应考虑植入IABP,减少正性肌力药物的心肌损伤,减少心脏做功,使心肌充分休息恢复功能,利用机械辅助增加心排血量满足外周脏器灌注,减少外周器官功能障碍。
推荐意见3(ⅠC):药物治疗无效的低心排血量综合征考虑植入IABP,尤其是缺血导致的低心排血量综合征。
手术的类型和IABP植入的时间直接影响患者的预后。相对于单独CABG,其他类型的心脏手术植入IABP死亡率上升2倍,无论IABP植入时间的早晚,瓣膜手术及其他手术合并CABG均具有较高的死亡率。关于非CABG手术植入与不植入IABP预后差别研究很少,多为小样本回顾性分析。回顾性分析显示瓣膜手术术中植入IABP较术后植入死亡率低;对于高龄无冠心病的主动脉瓣置换的患者,术前植入IABP能够降低心血管不良事件的发生[23,24]。尽管IABP能使心输出量提高10%~20%,这对于使用大量血管活性药物的患者来说是不够的,多数需要其他的心室辅助装置[7]。对于除了单独CABG手术以外的心脏外科手术使用IABP证据不足。
推荐意见4(Ⅱb B):对于除了单独CABG手术以外的心脏手术使用IABP辅助循环获益有限。
对于IABP植入的适应证已经有大量的临床试验证实,但是对于植入时机没有统一的标准。并没有多中心的临床试验研究这方面的问题,且由于实践中患者的不同很难直接比较。以往的临床实践推荐:多巴胺用量>10 μg·kg-1·min-1,同时应用两种药物的情况下血压进行性下降;心排血量<2.0 L·m-2·min-1;平均动脉压<50 mmHg(1 mmHg=0.133 kPa);左心房压>20 mmHg;中心静脉压>15 mmHg;尿量<0.5 ml·kg-1·h-1;末梢循环差,手足凉;精神萎靡,组织氧供不足,乳酸持续上升,动脉血氧饱和度下降明显。目前的研究倾向于有适应证的患者尽早行IABP辅助,改善预后,以免病情恶化,错过治疗时间[26]。
推荐意见6(Ⅰ C):患者有IABP植入的适应证,应尽早植入。
植入IABP后尽快检查球囊的位置是否位于左锁骨下动脉远端(胸片第2肋间)及肾动脉以上以免影响肾动脉血流。选择合适的触发方式:首选心电图触发,选择R波高尖的最佳导联,确保QRS波群>0.5 mV,低于0.5 mV不利于触发,也可通过调节心电图增益来提高QRS波群的辨识度。当患者为起搏心率时选择起搏触发。首选IABP 1∶1辅助,1∶2时辅助效果明显下降。当心率>150次/min时,IABP辅助效果降低,应控制心率而不是降低辅助频率。当心电图不能触发时,可选用压力触发,此时主动脉收缩压应>50 mmHg。机内触发只适用于严重低心排血量综合征、心脏骤停、严重低血压、无理想动脉波形的患者。
心律失常会干扰IABP球囊的触发、充气和放气,及时发现、早期处理。在房颤时IABP球囊会自动选择R波放气。室速、室颤和心脏骤停时可选择固有频率反搏。
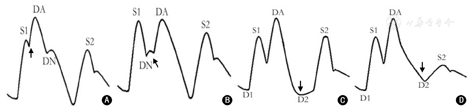
尽管目前的IABP机器均带有自己的软件,精确地计算反搏的时相,当出现反搏效果下降、主动脉舒张末压较无反搏时下降,应注意有无以下情况:充气过早或过晚;放气过早或者过晚(图1)。

严密观察植入IABP肢体的动脉搏动、皮肤温度、颜色以及大小腿围等,并与对侧进行比较。发现异常积极处理。也可用IABP自带的血管超声评价动脉的血流频谱;定期检查患者有无出血倾向,如穿刺部位出血或血肿、皮下瘀斑、口鼻出血以及生命体征不稳、血红蛋白持续下降、需要输血的大出血等;植入IABP后由于机械损伤、出血以及肝素诱导的血小板减少等原因,血红蛋白及血小板会出现下降。有研究显示植入IABP的患者血红蛋白会有所下降[29]。因此应监测血红蛋白及血小板的变化,必要时补充。
IABP管路充分固定、注意无菌操作,同时预防感染;植入IABP后要求患者体位相对固定,半卧位不能超过45°。加强心理护理,对于躁动患者必要时适当镇静。
仔细阅读使用的IABP机器的说明书,熟悉预警系统,包括触发、漏气、气源不足及系统报警的处理。
IABP植入后,通过导管中心腔进行压力监测,连接标准动脉血压监测装置,同时使用3 ml/h的肝素盐水冲洗中心管保证其通畅。为了预防IABP导管植入相关的血栓形成以及随之而来的血栓栓塞导致的肢体缺血,大的临床中心以往的推荐是植入IABP后给予普通肝素抗凝,维持活化部分凝血活酶时间(APTT)在50~70 s,活化凝血时间(ACT)在150~180 s,但是并没有证据支持这一理论[1]。Benchmark注册研究发现IABP植入相关的并发症在使用9.5 F导管的患者发生率只有2.6%,严重的肢体缺血的发生率在0.5%[4]。Meisel等[30]报道161例接受IABP辅助的患者植入8 F导管,肢体缺血需要接受血管介入治疗的患者仅有2例。RCT研究证实植入8 F的IABP导管,无抗凝组与接受肝素抗凝组相比并不增加肢体缺血的发生率,而肝素组出血的风险增加[31]。Cooper等[32]通过前后对比的方法分析肝素抗凝与有选择的肝素抗凝两组患者之间的差异来评价肝素抗凝的临床净效应,结果显示两组并发症发生率无统计学差异,植入8 F或7.5 F的IABP球囊导管血栓栓塞的发生率只有0.4%。同时肝素抗凝不减少肢体缺血的发生率,反而增加出血风险。有选择的肝素抗凝优于肝素抗凝。
肢体缺血主要与周围血管病变、IABP球囊导管直径以及IABP导管留置在主动脉内的时间相关。经皮股动脉植入IABP导管不可避免的会影响穿刺点远端的肢体血流灌注,导管直径大小对远端血流影响是非线性关系。1根直径12.2 F的导管置入内径5 mm的血管,只有19.9%血流到达远端,1根直径6.1 F的导管植入相同管径的血管有92%的血流能够到达肢体远端。若股动脉内径在5 mm,目前8 F导管对肢体远端血流不会产生显著的影响。所以,IABP导管的直径大小是决定远端肢体缺血发生的主要因素。在无抗凝的条件下,工作状态中的IABP导管表面无论肉眼还是电子显微镜扫描下观察均未发现有血栓形成[31]。
推荐意见7(Ⅰ C):植入IABP前,有条件的单位应首先评价双侧股动脉的情况,选择动脉粥样硬化程度轻的一侧植入,对于严重病变不能植入的选择其他路径植入。
推荐意见8(Ⅱa B):推荐采用有选择的抗凝方案:对于围手术期心肌缺血、房颤、瓣膜置换、持续血滤以及存在血栓形成高危因素的患者,如存在外周血管病变、女性以及高龄的患者给予静脉肝素或低分子肝素抗凝,同时密切观察有无皮下出血、瘀斑等情况并及时调整肝素的剂量,必要时停用。禁用肝素的患者可选择阿加曲班等不同抗凝机制的药物。长期应用IABP反搏的患者可选择华法林抗凝。
关于IABP撤机指征并没有统一的标准,调查研究显示对于IABP撤机重要的指标包括血压(92%)、心率(76%)、肺动脉楔压(59%)、去甲肾上腺素的剂量(78%)、多巴胺的剂量(57%)、肾上腺素的剂量(57%)、多巴酚丁胺的剂量(37%);而对于撤机非关键的指标包括患者意识状态(80%)、心输出量(78%)、尿量(68%)、血红蛋白水平(57%)、中心静脉压(52%)、血气结果(50%)[33]。
没有直接的证据显示减少辅助频率或减少球囊容积哪种停机方式更为有利。与减少IABP辅助频率相比,采用减少辅助球囊容积的方法,患者血流动力学更稳定、乳酸的水平更低[34]。抗凝的患者在撤机之前评估凝血状态,肝素抗凝者应先中和肝素以利于减少穿刺点出血。注意球囊静止状态不能超过30 min,以免血栓形成。降低反搏频率后密切监测循环状态,如患者血流动力学保持稳定,IABP能够撤除。球囊辅助期间记录的血压低于未辅助时的血压,所以在撤除IABP时血压的升高不能成为判断病情及能否成功撤除IABP的敏感方法。
关于呼吸机与IABP撤除时间先后的问题:澳大利亚在全国ICU的调查研究显示47%的ICU在拔管之前撤除IABP,而10%的ICU选择先拔管再撤除IABP[3]。在意大利50%的中心会选择在撤除呼吸机之后停止IABP辅助,15%的中心选择在患者镇静呼吸机辅助呼吸时撤除IABP[35]。
推荐意见9(Ⅰ C):小剂量的血管活性药物支持且依赖性小;心排满意;可以撤除IABP。
推荐意见10(Ⅰ C):如果出现下肢缺血、气囊功能障碍、严重的血小板减少或者感染等并发症时提示尽早撤除IABP。
推荐意见11(Ⅰ C):开始撤除IABP时可以选择减少辅助频率或减少球囊容积,亦可两者结合。
推荐意见12(Ⅰ C):重度主动脉瓣反流;主动脉病变:如主动脉夹层、主动脉瘤、主动脉外伤以及重度的主动脉粥样硬化等。
IABP作为有创性操作早期报道的并发症发生率较高,随着植入技术的进步,以及球囊导管的改进,IABP的并发症发生率明显下降。Benchmark注册研究显示,IABP的并发症(主要包括肢体缺血、严重的出血、球囊破裂、与IABP植入失败直接相关的死亡)发生率在2.6%,而女性、高龄以及外周血管病变是高危因素[4]。目前普遍认为IABP的并发症多与器具本身和插管技术有关。术前评估以及术后严密的监护能够使IABP并发症的发生率下降。
肢体缺血是最常发生的并发症,严重者可发生骨筋膜室综合征导致截肢,由于对于肢体缺血定义的不同,发生率在各个报道之间存在较大的差异。下肢缺血的原因包括低血容量、低血压;血管痉挛;球囊导管或鞘管直径较大;股动脉细或者股动脉粥样硬化造成的狭窄;球囊导管周围血栓形成;血栓或者粥样硬化的斑块脱落等。肢体缺血的高危因素包括女性、周围血管疾病、高龄、糖尿病、吸烟以及高血压。
推荐意见13(Ⅰ C):有条件的单位术前通过影像学手段评估股动脉的情况。选择搏动好、病变轻的一侧植入;选择合适的球囊导管;尽量选择无鞘植入;高危患者适当抗凝。
推荐意见14(Ⅰ C):一旦出现肢体缺血的症状,积极处理不能缓解,要立即停止IABP辅助并拔出导管,需要继续辅助的患者选择其他的部位植入。球囊在撤除的过程中,动脉粥样硬化的斑块或者血栓脱落有可能引起动脉栓塞,注意在拔出导管后要严密监测下肢血运情况。
穿刺可能会出现主动脉或者髂动脉夹层、穿孔,严重者导致腹膜后出血,是IABP植入极罕见的并发症,发生率不到1%,尸检的结果在5%~9%[4]。
出血、感染、脑卒中,其他的栓塞事件包括截瘫、肾脏以及肠系膜动脉的缺血。
原因可能是在植入球囊导管时,尖锐物擦划球囊;动脉粥样硬化斑块刺破球囊;球囊未完全退出鞘管或通过锁骨下动脉植入形成折曲,折曲部位易破裂。表现为反搏波消失,导管内见血液。一旦发生要立即拔出球囊导管,否则进入球囊内的血液凝固,气囊无法拔出,只能通过动脉切开取出。
对于腹主动脉、髂动脉、股动脉闭塞或者上述部位手术的患者,植入IABP可以考虑经升主动脉、锁骨下动脉或腋动脉植入。其中术中或者术后经胸升主动脉植入是最常见的路径,约占总体1.9%~6.2%,多为股动脉植入失败后的选择。与经典的经股动脉植入相比,经胸升主动脉植入IABP,不增加植入相关的并发症[5]。多项研究表明对于需要IABP长时间辅助的患者,经腋动脉或锁骨下动脉植入,有利于患者康复训练以及救护车转运,且安全性良好[28,37,38,39]。见图2。
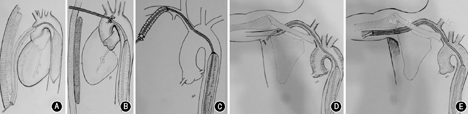

推荐意见15(Ⅱa B):对于腹主动脉、髂外动脉、股动脉闭塞或者上述部位手术、经股动脉植入失败的患者可以选择其他部位植入。
IABP植入10 h后,乳酸>11 mmol/L的患者死亡率为100%;碱剩余>12 mmol/L、平均动脉压< 55 mmHg、尿量<50 ml/h连续2 h、肾上腺素或去甲肾上腺素>0.4 mg·kg-1·min-1、左房压>17 mmHg均高度提示预后不良。心脏外科术后低心排血量综合征患者植入IABP后乳酸持续升高、低血压、仍需大量血管活性药物维持循环,应尽早选择其他机械循环辅助装置[26]。
推荐意见16(ⅠC):IABP植入后血流动力学不能改善,持续恶化,建议选择其他机械循环辅助装置。
项目主持者:张海涛(中国医学科学院阜外医院心脏外科ICU);高润霖(中国医学科学院阜外医院心脏内科);郑哲(中国医学科学院阜外医院心脏外科)
项目执笔者:周宏艳(中国医学科学院阜外医院心脏外科ICU第一执笔者);李白翎(上海长海医院胸心外科);曹芳芳(中国医学科学院阜外医院心脏外科ICU);杜雨(中国医学科学院阜外医院心脏外科ICU)
中国心脏重症主动脉内球囊反搏治疗专家共识编写委员会(按姓氏汉语拼音排序):曹芳芳(中国医学科学院阜外医院心脏外科ICU);曹舸(四川大学华西医院心胸外科ICU);晁彦公(清华大学第一附属医院华信医院急诊/ICU);陈伟新(深圳孙逸仙心血管医院重症医学科);陈文劲(首都医科大学宣武医院神经外科ICU);陈子英(河北医科大学第二医院心脏外科);陈祖君(中国医学科学院阜外医院心脏外科ICU);褚银平(山西省人民医院心脏外科);丁盛(成都市军区陆军总医院SICU);董念国(武汉协和医院心脏外科);董啸(南昌大学第二附属医院心胸外科);杜雨(中国医学科学院阜外医院心脏外科ICU);冯晓东(同济大学附属东方医院心脏外科);高润霖(中国医学科学院阜外医院心脏内科);谷天祥(中国医科大学附属第一医院心脏外科);郭建华(同济大学附属东方医院心脏外科SICU);韩宏光(沈阳军区总医院心脏外科ICU);洪军(浙江省人民医院重症医学科);侯晓彤(首都医科大学附属安贞医院心脏外科ICU);胡亚兰(郑州市第七人民医院,郑州市心血管病医院重症医学科);黄晓波(电子科技大学临床医学院四川省人民医院重症医学中心);纪广玉(上海长征医院心胸外科);纪洪生(山东省立医院外科ICU);贾士杰(北京安贞医院SICU);李白翎(上海长海医院胸心外科);李丹(吉林大学第二医院心血管外科);李培军(天津市胸科医院ICU);林柏松(吉林大学第三医院心脏外科);林玲(浙江大学邵逸夫医院ICU);刘彬(亚洲心脏病医院心脏外科ICU);刘宏生(山东济宁医学院附属医院心脏ICU);刘志刚(天津泰达国际心血管病医院外科部);罗哲(复旦大学附属中山医院大血管外科ICU);孟树萍(河南省人民医院心脏外科ICU);宁波(解放军空军总医院重症医学科);庞昕焱(山东省齐鲁医院心脏外科ICU);申红亚(郑州大学第二附属医院心血管外科重症监护室);沈振亚(苏州大学附属第一医院心脏外科);师桃(西安交通大学第一附院心脏外科ICU);史嘉伟(华中科技大学附属协和医院心脏外科ICU);宋先荣(河南省胸科医院心脏外科ICU);唐白云(中山大学附属第一医院心脏外科ICU);吴海卫(南京军区南京总医院心胸外科);吴明营(首都医科大学附属北京同仁医院心血管中心);武卫东(山西大医院重症医学科);谢波(上海交通大学附属仁济医院心脏外科SICU);熊卫萍(广东省人民医院心血管研究所心脏外科ICU);许卫江(武汉亚洲心脏病医院心脏外科ICU);杨谦(厦门市心血管病医院心脏外科);杨苏民(青岛大学附属医院心脏外科);叶明(哈尔滨医科大学附属二院重症医学科);虞敏(上海交通大学附属第一人民医院心血管外科);于湘友(新疆医科大学第一附属医院重症医学科);张海涛(中国医学科学院阜外医院心脏外科ICU);张杰(南京大学医学院附属鼓楼医院ICU);张志成(海军总医院ICU);章渭方(浙江大学医学院附属第一医院外科ICU);赵荣(第四军医大学第一附属医院心血管ICU);周飞虎(解放军总医院重症医学科);郑哲(中国医学科学院阜外医院心脏外科);周宏艳(中国医学科学院阜外医院心脏外科ICU)

























