版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
病理性瘢痕分为增生性瘢痕和瘢痕疙瘩,是创伤修复异常时出现的以成纤维细胞为主的细胞过度增殖、细胞活性增强,以Ⅰ、Ⅲ型胶原为主的细胞外基质沉积导致真皮组织过度增生的一种病理过程[1]。组织受损后便启动炎性反应,免疫细胞迁移至创面,皮肤基底细胞和干细胞开始增殖、分化,合成细胞外基质,形成肉芽组织[2]。病理性瘢痕有时也被认为是过度的、延长的炎性反应[3,4],相关研究一直以来面临的一个重要难题就是缺乏理想的实验模型。目前普遍认为:个体遗传学易感性和早期炎性反应的程度在瘢痕形成中起关键作用,而两者的体外或动物(体内)模型构建都十分困难。科学家们建立了不同的实验模型,期望为探究瘢痕形成机制及药物研发提供一个更理想的模型。
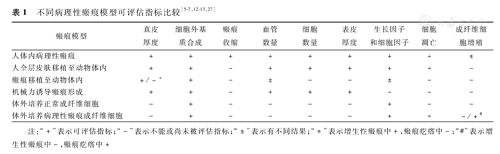
由于动物并不形成与人类相当的病理性瘢痕,许多学者直接将人瘢痕疙瘩全层或真皮层移植到无胸腺小鼠皮下,由于T细胞免疫缺陷,移植物排斥反应明显减小,虽然成纤维细胞活性略为下降,移植物体积缩小,但此模型较易观察瘢痕疙瘩的病理和生理变化,是相对理想的模型[5,6]。Alrobaiea等[7]将人正常全厚皮肤移植至裸鼠背部并造成深至真皮层的划痕,通过检测皮肤厚度、胶原含量等指标,证实其瘢痕在形态学、免疫学、组织学上与人增生性瘢痕相似(表1)。Wang和Luo[8]应用组织工程方法将瘢痕疙瘩成纤维细胞在聚乳酸-羟基乙酸共聚物支架上进行培养,1周后植入裸鼠皮下,发现其可保持特性地生长,成功建立了瘢痕疙瘩的动物模型,可用于研究成纤维细胞的作用机制或药物治疗试验,但仅使用瘢痕疙瘩成纤维细胞一种细胞是其主要局限性。
上述模型应用裸鼠,忽略了损伤周围免疫环境这一重要因素。人们发现,猪的皮肤与人类相似,均有较厚的表皮层、相似的更新周期和胶原结构,且不像其他动物依赖于皮毛来御寒或防晒,作为瘢痕实验动物的潜力巨大。Zhu等[9]在雌性红色杜洛克猪背部造成8 cm×8 cm全层伤口,观察到增生性瘢痕类似物形成,可能与其皮肤内含锥体细胞有关。但该模型仅能诱导增生性瘢痕形成,并不能用于研究瘢痕疙瘩。
机械应力因素在病理性瘢痕的发病机制中也有一定作用[10,11]。1983年Ehrlich和Needle[12]在皮肤紧张的小鼠(tight-skin mouse)背部造成全层切口,观察到创面愈合后组织中有大量胶原纤维、增生的结缔组织及新生血管,与人增生性瘢痕十分相似,解决了其他模型遇到的瘢痕挛缩问题,但不能长期维持这些特性(表1)。Aarabi等[13]在创面愈合细胞增殖期将可调节螺钉和钢板支撑装置置于小鼠背部2 cm长的全层切口之上,使机械牵张力作用于创面而又不与之直接接触,从第4天开始每天牵张2~4 mm,持续2周。由于Akt信号通路能够抑制p53介导的细胞凋亡,所以p53基因敲除小鼠形成的增生性瘢痕更加典型,而BclⅡ基因敲除小鼠的Akt信号通路被阻断,使得成纤维细胞凋亡增加,即使在机械应力作用下也未能形成增生性瘢痕,该模型首次证明了机械应力刺激通过Akt信号通路抑制细胞凋亡可诱导小鼠增生性瘢痕形成。由于所使用动物并非裸鼠,具有正常免疫系统,因此该模型可用于研究机械应力与炎性信号通路对皮肤纤维化的作用机制[14,15]。
损伤方式不同对瘢痕形成亦有影响。Robb等[16]将人正常皮肤移植于裸鼠背部后予以深Ⅱ度烧伤,瘢痕特性可保持6个月,通过此模型能观察创面愈合至增生性瘢痕形成的全过程。有学者将兔耳腹侧全层皮肤环形切除后形成增生性瘢痕,并进行了应用5-Fu、异常黑胆质成熟剂等治疗方面的研究[17,18],此类模型虽然操作简便,但其形成瘢痕的机制可能与兔耳中软骨有关,破坏软骨膜可能影响瘢痕增生程度,因此应用范围有限。Aksoy等[19]用煤焦油涂于白化变种的雄性豚鼠创面,通过检测G6PD活性及形态学观察,证明部分豚鼠可建立增生性瘢痕模型,但煤焦油的毒性及致癌性需被考虑,且豚鼠寿命未被提及,实验重复性不高,因此未被广泛应用。
尽管已有大量研究报道了应用鼠、兔、猪等动物模型研究病理性瘢痕,但这些模型与人体在基础生理、免疫环境及创伤愈合过程等方面有明显差异。所以,体外模型的建立亦为重要研究方法。
早期模型应用传统单层细胞环境,将正常皮肤组织和瘢痕组织中的成纤维细胞进行比较,或诱导健康皮肤成纤维细胞向瘢痕显型分化,此方法简单、快速、经济,但皮肤除成纤维细胞外,还由许多其他细胞组成,应用Transwell技术将成纤维细胞与角化细胞共培养,可研究二者间相互作用及影响[20]。Chiu等[21]将瘢痕疙瘩成纤维细胞与胶原凝胶混合后,表面加入正常皮肤角化细胞悬液共培养,构建了生理上更相似的三维环境,可促进成纤维细胞表现出瘢痕的特点,但由于正常角化细胞与瘢痕疙瘩角化细胞相差甚远[22],因此有很大局限性。
表皮层角化细胞与真皮层成纤维细胞相互作用,调节细胞外基质的合成,据此,引入器官型培养模型进行研究。所谓"皮肤器官模型" ,即在体外条件下,通过模拟体内环境,使培养于真皮类似物上的皮片或角化细胞进行分层和分化,形成复层表皮。其基本方法是:将浸没式培养的表皮细胞转移至真皮样载体,使表皮细胞浮出液面接触空气继续培养,这更加符合皮肤生理结构,是培养技术的新方向[23]。其中真皮类似物可分为去表皮的死真皮、胶原凝胶、脱细胞真皮、覆盖有胶原或成纤维细胞的微孔滤膜等。Bellemare等[24]从增生性瘢痕中取角化细胞,种植于含成纤维细胞的真皮基质上,角化细胞可表现出一些病理性瘢痕的特性,但此模型主要用于研究角化细胞在瘢痕形成中的作用。van den Broek等[25]做了进一步改进,将重建表皮培养在含皮下脂肪来源间充质干细胞(adipose tissue-derived mesenchymal stromal stem cell, ASC)及真皮成纤维细胞的真皮基质上,构建增生性瘢痕的组织工程模型。将ASC及真皮成纤维细胞种植于Transwell皿,健康角化细胞种植于无细胞真皮基质上,浸没培养7 d,将含角化细胞的基质置于ASC和成纤维细胞之上,使后两者迁移至基质网状结构中继续培养,形成皮肤替代物后,加入烧伤创面渗出液或其他刺激因子,如趋化因子CCL27等培养24 h后进行检测。此方法特点是将ASC、真皮成纤维细胞及角化细胞共同培养,观察3种细胞对不同刺激的反应,进而讨论其在创面愈合中的不同作用。尽管该模型有所进步,但仅能代表暴露脂肪组织的严重创伤(如烧伤等)引起的增生性瘢痕,而不能代表外科常规切除所引起的病理性瘢痕。
研究发现瘢痕疙瘩来源的多能间充质样干细胞也参与瘢痕疙瘩的形成[26],瘢痕疙瘩移植模型中因可能含有这些细胞而值得关注。Bagabir等[27]将打孔器取下的人瘢痕疙瘩标本培养于气液交界面,胶原凝胶作为培养床,通过检测胶原含量、免疫细胞标志物等证明该模型可保持瘢痕疙瘩特性6周,用地塞米松治疗后表皮厚度减少、瘢痕缩小,验证了模型的功能性(表1)。此模型的特点是保留了完整的瘢痕疙瘩所含细胞和结构特性,缺点是完全依赖并受限于新鲜、足够大的瘢痕标本,限制了其广泛应用。
①动物模型对人体瘢痕形成的研究并不完全适用。如裸鼠模型并非自身形成瘢痕组织,且无胸腺和T细胞,不能模拟人的正常生理环境和人体炎性反应事件[28]。②人体细胞培养模型仍受其单一性所限。瘢痕形成是在创伤伊始由一系列细胞间复杂的相互作用所介导的,成纤维细胞、角化细胞、内皮细胞、免疫细胞均参与其中,但仅有少数细胞应用于研究模型,而且机械应力因素也未被考虑在内。③未考虑遗传倾向性。几乎所有严重烧伤都会形成增生性瘢痕,一个未被考虑的重要因素即遗传倾向性,此特性会影响从炎性反应到组织重塑再到最后瘢痕形成的全部过程。多数动物模型仅能诱导增生性瘢痕形成,而瘢痕疙瘩仅能通过移植至动物皮下进行观察研究,也与瘢痕疙瘩形成受遗传影响有关。④瘢痕模型有效期限仅数日至数月,而人类瘢痕可发展数月至数年。
进一步研究并充分利用端粒酶逆转录酶永生细胞系的优势[29],使其可以保持不同瘢痕的特性,并解决由于需要切除新鲜标本而带来的道德伦理问题。可结合组织工程材料进行体内、外实验,有研究用电纺丝技术制成聚己内酯材料,不接种任何细胞,直接缝于豚鼠背部创面,观察创面愈合过程[30],今后可考虑将瘢痕中多种相关细胞种于新型材料,进行体内或体外培养,并评估模型效果。近来,仿真人体器官芯片(organ-on-a-chip)亦被作为器官和疾病模型,也有望用于体外瘢痕模型研究[31]。器官芯片结合了微流体技术和硅芯片技术,含有多种人体活体细胞,可以模拟体内环境及人体器官的活动。这种芯片为透明的塑料矩形,有小沟槽纵横其中,细小的渠道允许空气和液体通过,并与各种管线相连,这些可控条件使其模拟皮肤环境、皮肤弹性和细胞间相互作用均成为可能,且微流体环境使得模型使用期限延长,有利于模拟血管或淋巴管而将免疫细胞引入。目前已有的器官芯片包括"肺芯片"、"肝脏芯片"、"肾脏芯片"等[32,33]。若能建立"瘢痕芯片",用不同类型瘢痕皮肤及免疫细胞构建正常瘢痕、增生性瘢痕及瘢痕疙瘩模型将成为可能,这不仅有助于研究病理性瘢痕的形成机制,也可用于研究基因在疾病进展中的作用。总之,这将为发展靶向药物治疗提供平台,可建立不同基因背景的储存库用于体外临床试验。