
收集6例术后晚期囊袋阻滞综合征病例,分析其临床表现及可能发病原因,并探讨各种治疗方法的优劣。
2012年1至6月收集白内障超声乳化吸除及人工晶状体植入术后并发晚期囊袋阻滞综合征患者共6例,排除其他眼部疾患造成术后视力下降的因素,囊袋阻滞综合征诊断明确后,其中5例患者行YAG激光囊膜切开术,1例患者行囊袋积液抽吸术。术后观察患眼视力、眼压、屈光度改变,眼底有无黄斑水肿或视网膜毒性反应;囊袋积液抽吸后行病理学检查,分析晚期囊袋阻滞综合征的可能发病原因,分析人工晶状体材质与其发病是否存在关联。
(1)6例患眼人工晶状体与后囊膜之间的沉积物均得以释放、吸收,囊袋扩张松解;(2)6例患者术后屈光度均发生改变,其中5例视力提高;(3)1例患者行YAG激光前囊膜切开术后出现急性眼压升高,出现显著视力损害;(4)囊袋积液抽吸术患者,其囊袋中沉积物为蛋白渗出物。
(1)术后晚期囊袋阻滞综合征的发病主要与晶状体上皮细胞迁移、增殖造成的囊袋纤维化有关;(2)尚未能明确证实,亲水性人工晶状体是否为诱发晚期囊袋阻滞的危险因素;(3)同时行YAG激光前、后囊切开松解术,对于晚期囊袋阻滞患者可能更为有效;(4)囊袋液体抽吸能彻底清除囊袋积液,安全有效,且能为囊袋阻滞综合征提供病因学诊断依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
囊袋阻滞综合征(capsular block syndrome,CBS),是继发于白内障术后的一种较为罕见的并发症,由Davison在1990年首次描述[1]。随着白内障超声乳化手术、中央连续环形撕囊(continuous curvilinear capsulorhexis,CCC)及人工晶状体(intraocular lens,IOL)植入的普及,CBS的发生逐渐增多,就目前所知这一并发症的发生率为0.3%~1.6%[2]。CBS的主要特征为,人工晶状体与囊袋间形成密闭空腔,液体积存,进而产生视力下降、屈光度数改变、甚至人工晶状体前移、前房变浅等。本文中收集2012年1月至6月就诊于北京同仁医院眼科的6例CBS病例,记录治疗前后的视力、眼压、散瞳验光结果及眼前节图像,分析其可能发病原因,讨论不同IOL类型、治疗方式对于CBS发生和预后的影响。
例1. 67岁,女性。左眼视力下降7月,于2012年1月就诊。患眼6年前行白内障超声乳化吸除IOL植入术(ACR6D SE,CORNEAL,单片一体型亲水性丙烯酸酯折叠IOL)。左眼视力0.2,眼压18 mmHg,散瞳验光:-2.00 DS→0.3-;IOL与后囊之间明显间隙,不均匀沉积物呈花瓣样结晶,界线清楚(图1),前节OCT示致密物质沉积于IOL与后囊间隙。行YAG激光后囊膜切开治疗,沉积物涌入玻璃体。一周后视力0.4,眼压19 mmHg,散瞳验光-0.00 DS+0.75 DC×165°→0.5;后囊沉积物消失。
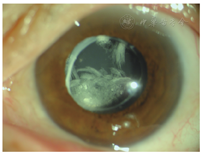

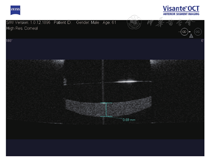
例2. 61岁,男性。右眼视力下降1月,于2012年2月就诊。患眼8年前行白内障超声乳化吸除IOL植入术(ACR6D SE,CORNEAL,亲水性丙烯酸酯IOL),右眼视力0.5,眼压16 mmHg,散瞳验光:-0.5 DS-0.75 DC×85°→0.8;可见IOL后表面与后囊间存在间隙,乳白色物质均匀沉积,前节OCT示较致密物质沉积于IOL与后囊间隙(图2)。行YAG激光周边前囊膜切开及后囊膜切开术,混浊物质从前囊口溢出,团块状浑浊物沉于前部玻璃体。一周后视力0.8,眼压16 mmHg,散瞳验光:-1.00 DC×85°→0.8,仅存极少量沉积物。

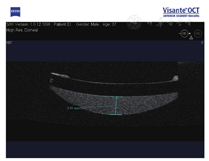
例3. 37岁,男性。右眼视力下降10 d,于2012年2月就诊。患眼7年前行白内障超声乳化吸除IOL植入术(MA60AM,AcrSof疏水性丙烯酸酯IOL)。右眼视力0.25,眼压20 mmHg,散瞳验光:-2.50 DS-0.75 DC×90°→0.25;IOL后部呈现均匀白色沉积物,前节OCT示致密物质沉积于IOL与后囊间隙(图3)。行YAG激光周边前囊膜切开术,泡沫状白色物质涌出。12 h后就诊,诉右眼胀痛放射至同侧头部,无光感,眼压69 mmHg。急行前房穿刺术,90 min后眼压57 mmHg,手动视力,予降压眼药水滴眼、脱水剂口服,又经前房穿刺口放液约0.2 ml,视力恢复至一尺指数,眼压13 mmHg。予血栓通静脉滴注,后眼压恢复正常。19 d后行再YAG激光后囊膜切开术,混浊物呈棉絮状漂进玻璃体。一周后视力0.04,眼压15 mmHg,散瞳验光-2.75 DS+0.50 DC×20°→0.4,仅见机化残膜。予神经营养药物口服,4个月后复查裸眼视力0.2。

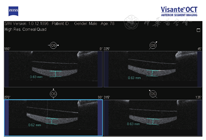
例4. 78岁,男性。左眼视力下降3月,于2012年4月就诊。患眼10年前行白内障超声乳化吸除IOL植入术(MA60BM,Acrysof疏水性丙烯酸酯IOL)。左眼视力0.2,眼压14 mmHg,散瞳验光:-2.50 DS+1.25 DC×85°→0.2;IOL后表面与后囊间乳白色物质沉积,前节OCT示较致密物质沉积于IOL与后囊间隙(图4)。行YAG激光周边前囊膜切开及后囊膜切开术,泡沫状混浊物质从前囊口及后囊溢出。一周后视力0.3,眼压14 mmHg,散瞳验光:-0.50 DS+1.00 DC×180°→0.4,沉积物消失。

例5. 74岁,男性。右眼视物不清1月余,于2012年5月就诊。右眼8年前行白内障超声乳化吸除术及IOL植入术(MA60BM,Acrysof疏水性丙烯酸酯IOL),右眼视力0.8,眼压10 mmHg,散瞳验光:+1.00 DC×160°→0.8;IOL与后囊之间呈均匀乳糜状浑浊,下方有颗粒状渣滓沉积。前节OCT显示较致密物质沉积于IOL与后囊间隙。行YAG激光后囊膜切开术,后囊膜皱缩为条索状飘浮,有蒂与主体相连,其与IOL之间的沉积物涌入玻璃体。一周后视力0.9,眼压13 mmHg,散瞳验光0.5 DS+0.75 DC×180°→1.0-;IOL后沉积物消失(图5)。
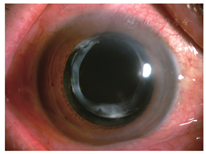

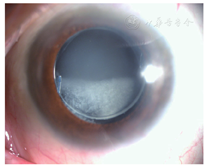
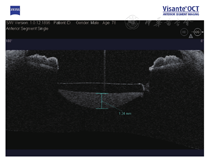
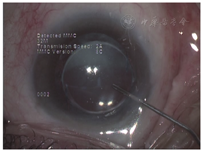
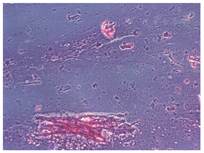
例6. 78岁,男性。左眼视物模糊3月,于2012年6月就诊。左眼10年前行白内障超声乳化吸除术及IOL植入术(MA60BM,Acrysof疏水性丙烯酸酯IOL)。左眼视力0.5,眼压17 mmHg,散瞳验光-1.50 DS→0.5;见灰白色颗粒状物质沉积于后囊膜与IOL后表面之间,形成一整齐液平面(图6A),前节OCT显示较致密物质沉积于IOL与后囊间隙(图6B)。行囊袋积液抽吸术(图6C),抽出不足0.1 ml的后囊积液,行HE染色,显微镜下观察为均质粉染物质,无明显细胞或组织结构,为蛋白渗出物(图6D,leica倒置相差显微镜,10X10)。术后一周视力0.7-2,眼压12 mmHg,散瞳验光-0.25 DS-1.25 DC×145°→0.8,后囊沉积物消失。




Miyake在1998年最先基于CBS的发生时间对其做出了分型[3],主要分为术中、术后早期及晚期CBS。术后晚期CBS发生于白内障术后5年或以上时间,平均时间为3.8年[4]。本研究中的6例均为此型。发生术后晚期CBS的主要机制,在于囊袋纤维化所导致的IOL光学部前表面与撕囊口的粘附[5],IOL-虹膜隔前移,造成屈光改变,浅前房及眼压升高,部分患者闭角型青光眼发作。残留的晶状体上皮细胞(lens epithelial cell,LEC)在CBS发生过程中起到了重要作用,LEC迁移、增生,相应产生胶原及细胞外基质,堆积于囊袋内,导致囊袋内渗透压增高,从而囊袋内液体渗透性增加,囊袋膨胀[6]。
有研究证明,囊袋内液体的蛋白质主要为高浓度的α和β晶体蛋白,这也从另一个角度证实了LEC在CBS发生中的作用[7]。本研究中,例6患者的囊袋沉积物被吸出后行HE染色,病理报告为蛋白渗出物(图6D)。
根据我们的观察,术后CBS的总体特征为,撕囊口边缘与IOL光学部前表面相贴,其后表面与后囊膜之间形成了相对密闭的腔隙,液体积聚,后囊膜扩张IOL前移,从而引发患者视力下降、屈光度改变(主要表现为近视度数增加)等一系列临床症状和体征。多数情况下,术后CBS继发于环形撕囊及IOL植入于囊袋内之后,本研究中6例均属于此。
另外,IOL相关因素可能会影响CBS发病。一项历时5年的回顾性研究发现,疏水性、直角边缘设计的IOL比亲水性IOL发生CBS的几率大大减小[8];也有人认为四襻IOL后部边缘并不呈直角设计,使得IOL与前囊的接触面积相对于其他后房型IOL更大,另外由于四襻设计限制了IOL动度,术中吸除其后房粘弹剂稍显困难,因此该型晶体发生CBS的可能性显著增高[9]。本研究中,例1、4使用亲水性丙烯酸酯IOL,例2、3、5、6使用疏水性材料人工晶状体,但目前CBS例数太少,IOL材质与其发生之间的关系尚有待证实。
由于存在前囊膜-IOL的微小渗漏通道,少量的CBS存在自愈倾向[3],但CBS自愈可能引发急性闭角型青光眼、慢性前房炎症,所以现阶段的术后CBS主要以积极治疗为主。
(1)YAG激光前囊膜或后囊膜切开术:这是目前最常见的CBS治疗方法,简单且效果明确。本文中,例1-5采用YAG激光囊膜切开术,通过切开晶状体前囊和(或)后囊,释放囊袋中沉积的物质,一方面直接解除了光线通路的遮挡,另一方面缓解囊袋扩张,使IOL后移[10],患眼均有一定程度的屈光度变化,且以近视度数减少为主(4例),但需要注意的是,并非所有患者行囊膜切开后均有屈光改变,而例5经激光治愈后,患眼反而增加了0.5 D的近视。
若对术后晚期CBS患者单纯行YAG激光前囊膜切开,乳白色积液可能会在短期内重新形成[11],或者因囊膜长时间受到牵拉,前囊切开后,后囊很可能塌陷皱缩影响视力,同时行后囊膜切开可能是更有效的方法。可以观察到,后囊膜切开后,囊袋中的沉积物质涌入玻璃体,在数天至数周之内逐渐吸收。术后观察,患眼均未出现明显的视网膜毒性反应。
然而,YAG激光囊膜切开并非十全十美。激光能量及焦距控制不佳,会伤及IOL或其他眼内组织。前囊膜切开时沉积物释放入前房,堵塞小梁网,可造成眼压急升,伤及虹膜可造成出血或虹膜后粘连[12]。例3患者行前囊膜切开术后,白色泡沫状物质涌入前房,12 h后眼压急升至69 mmHg,无光感;虽急行前房穿刺、输液等降眼压治疗,视功能仍然受到不可逆的严重损害。后囊膜切开的患者,亦有可能因囊袋松解,前囊边缘与IOL的贴附松动,而使囊袋积液流入前房,升高眼压。故不论行何种方式的囊膜切开,均须格外警惕这一可能造成严重后果的并发症。
(2)手术治疗:对于因积液过厚、激光无法聚焦于后囊膜者,无法充分散瞳、周边前囊未能充分显露者,手术治疗当作为首选治疗方法[11]。
手术治疗,关键在于彻底吸除IOL与囊袋间沉积物,消除密闭腔隙,松解囊袋牵拉及其与IOL前表面的贴附。术中注意轻柔操作,注射器针头将IOL抬起吸除后方积液时,要避免伤及角膜内皮及IOL,用力要适当,以免撕裂囊膜。对于囊膜纤维化明显、后囊膜混浊显著者,还可行后囊膜抛光,以获得更佳的术后视力[7]。术中IOL发生位移,前房稳定性受到挑战,可注入适量黏弹剂,完全清除囊袋中积液后,再吸除黏弹剂及流入前房的积液,以免术后前节反应增大,眼压波动。
相较于YAG激光,手术治疗CBS花费更高、耗时更长、流程也更为繁杂,对术者的手术技巧提出了更高要求,但手术效果明确、安全,抽吸出的物质还能进行病理学、细胞生物学检验,为CBS的病因学诊断提供依据。
综上,术后晚期CBS是白内障术后一种较罕见并发症,其病因与LEC增殖迁移、囊袋纤维化及IOL自身特性相关,发病机制尚有待进一步明确,YAG激光囊膜切开术和囊袋积液抽吸作为常用的治疗方式各有优劣。近年来有学者提出,为了防止后囊膜混浊,应使撕囊口更小[13],且随着微小切口白内障与CCC的不断成熟和普及,术后CBS的发生率在一定程度上会有所增加[14]。如何根据患者情况选择最佳治疗方法,仍值得眼科医师进一步探索,以提高白内障术后视力和患者满意度。



























