
探讨晚期囊袋阻滞综合征(CBS)的临床表现、发生机制及治疗方法。
回顾性分析解放军总医院2012年6月至2016年6月,收治的白内障超声乳化吸除联合人工晶状体植入术后晚期CBS患者7例(7只眼),均采用前囊膜松解及囊袋内液体吸除术治疗,囊袋内"牛奶状"液体成分运用Western blot检测。
7例发病时间为术后1~6年,平均术后3.7年,均表现为近视漂移、前囊口缩小、人工晶状体前移位及后囊扩张。7例囊袋内均有"牛奶状"混浊液体积聚。术后最佳矫正视力不同程度提高。Western blot证实囊袋内液体含有大量αB及βB晶状体蛋白,但肿瘤坏死因子-α(TNF-α)及白细胞介素-1β(IL-1β)未见表达。
囊袋内混浊液体来源于晶状体上皮细胞,炎症反应可能不参与CBS病变过程。前囊膜松解及囊袋内液体吸除术治疗晚期CBS安全有效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
晶状体囊袋阻滞综合征(capsular block syndrome,CBS)是一类与连续环形撕囊(continuous circular capsulorhexis,CCC)密切相关的并发症,最早由Davison于1990年报道[1]。CBS目前尚无统一的定义,比较认可的是由于前囊口被晶状体核或人工晶状体光学面机械性阻塞导致晶状体囊袋形成一个密闭的空腔并出现液体或半液体样物质滞留,以及由此产生的如前房变浅、眼压升高、后囊膜破裂、晶状体核下沉、虹膜后粘连、后发性白内障、屈光度改变和继发性青光眼等一系列眼部改变的综合征。本研究回顾性分析了就诊于我院的7例晚期CBS的诊治流程,并就其临床表现、发生机制及治疗方法进行探讨。
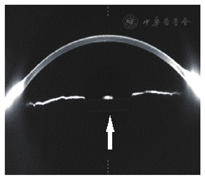
收集2012年6月至2016年6月在解放军总医院眼科就诊的晚期CBS患者7例(7只眼),其中男性5例,女性2例,年龄56~76岁(平均67.71岁),左眼2只,右眼5只,均以视力下降为主诉就诊。就诊时间为白内障术后1~6年(平均3.7年)。所有患者均否认糖尿病、高血压等既往病史。所有患者均于外院行白内障超声乳化吸除联合人工晶状体植入术,术中顺利。裂隙灯检查可见散瞳后前囊膜撕囊口完全覆盖于人工晶状体(intraocular lens,IOL)的前表面,前囊撕囊口直径均小于IOL光学面直径,但前囊口边缘未见纤维化,IOL与后囊膜之间可见乳糜性、"牛奶状"混浊液体积存(图1,图2)。
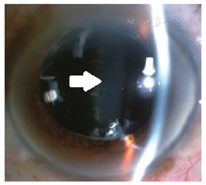

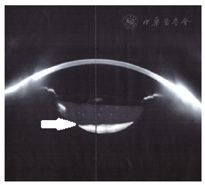

术前及术后1 d、1周、1个月及3个月视力检查(标准对数视力表)。前节OCT(ASOCT)测量患者术前及术后1个月前房深度。非接触眼压计测量患者术前及术后1个月眼压变化。
7例晚期CBS患者均于表麻下性前囊膜松解及囊袋内液体吸除术:15°穿刺刀及3.0 mm穿刺刀分别于2点位及10点位近角膜缘透明角膜处做角膜切口,前房内注入黏弹剂,囊膜剪自10点位主切口伸入前房,剪开12点位前囊膜,撕囊镊撕囊扩大前囊口,手动注吸头伸到IOL光学区后注吸清除乳糜性混浊液体并抛光后囊膜。此时可见后囊膜前移,前囊膜与IOL光学区后移至正常位置,手动注吸清除前房及囊袋内黏弹剂及增生物,调整IOL正位,必施形成前房,切口自闭。术中乳糜性混浊液体吸出后立即保存至-80℃冷藏。
水浴融化冻存样本,取适量液体至离心管中,BCA蛋白定量试剂盒测定蛋白浓度后,沸水加热样品5 min后放入-70℃冰箱冻存样品待用。取50 μg蛋白样品进行SDS-PAGE凝胶电泳,电泳完毕后,应用电转仪将样品转移至PVDF膜,质量分数5%脱脂奶粉封闭1 h,分别加入兔抗人αB晶状体蛋白抗体一抗(1:1 000)、兔抗人βB晶状体蛋白抗体一抗(1:1 000)、兔抗人TNF-α抗体一抗(1:1 000)及兔抗人IL-1β抗体一抗(1:1 000)4℃孵育过夜,洗膜后加入相应的羊抗兔IgG二抗(1:5 000)室温孵育1 h,洗膜后化学发光ECL法显影,暗室曝光。以小鼠抗人β-actin(1:5 000)作为内参阳性对照。正常培养的人晶状体上皮细胞内的晶状体蛋白作为对照组。各独立实验均重复三次。
7例晚期CBS(7只眼)经过手术治疗,术后视力恢复至0.5-1.0,病例1-3患者术前屈光度测不出,病例4-7患者术后屈光度变化0.75-1.50 D(平均1 D),术后散光度较术前未见明显变化。术后1周、1个月及3个月视力及屈光度均未见显著变化。结果见表1。
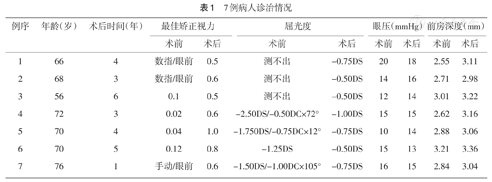
7例病人诊治情况
7例病人诊治情况
| 例序 | 年龄(岁) | 术后时间(年) | 最佳矫正视力 | 屈光度 | 眼压(mmHg) | 前房深度(mm) | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 术前 | 术后 | 术前 | 术后 | 术前 | 术后 | 术前 | 术后 | |||
| 1 | 66 | 4 | 数指/眼前 | 0.5 | 测不出 | -0.75DS | 20 | 18 | 2.55 | 3.11 |
| 2 | 68 | 3 | 数指/眼前 | 0.6 | 测不出 | -0.50DS | 14 | 16 | 2.71 | 2.98 |
| 3 | 56 | 6 | 0.1 | 0.5 | 测不出 | -0.50DS | 12 | 14 | 3.01 | 3.22 |
| 4 | 72 | 3 | 0.02 | 0.6 | -2.50DS/-0.50DC×72° | -1.00DS | 15 | 15 | 2.62 | 3.16 |
| 5 | 70 | 4 | 0.04 | 1.0 | -1.750DS/-0.75DC×12° | -0.75DS | 10 | 14 | 2.88 | 3.06 |
| 6 | 70 | 5 | 0.12 | 0.8 | -1.25DS | -0.50DS | 15 | 13 | 3.21 | 3.36 |
| 7 | 76 | 1 | 手动/眼前 | 0.6 | -1.50DS/-1.00DC×105° | -0.75DS | 16 | 15 | 2.84 | 3.04 |
7例患者术前前房深度2.55~3.21 mm(平均2.83 mm),周边虹膜平坦。术前眼压10~20 mmHg(平均14.57 mmHg)。术后1个月前房深度2.98~3.36 mm(平均3.13 mm),眼压13~18 mmHg(平均15 mmHg)。术后前房深度较术前显著增大,两者差异具有统计学意义(P<0.05)。术后眼压较术前变化不显著,两者差异不具有统计学意义(P>0.05)。
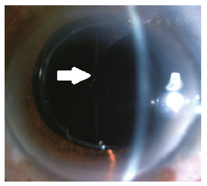
7例患者(7只眼)手术过程均顺利,术中未发生前囊膜放射状撕裂,术后人工晶状体透明位正,无皮质残留,后囊膜未见明显混浊,眼底未见明确异常(图3,图4)。


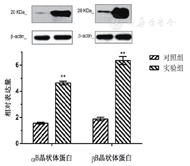
Western blot检测证实7例晚期CBS患者囊袋内乳糜状混浊液体含有大量αB及βB晶状体蛋白,且含量较常规培养晶状体上皮细胞内蛋白含量更多,两者差异具有统计学意义(P<0.05)(图5)。而TNF-α及IL-1β检测阴性。

CBS是一类与连续环形撕囊密切相关的并发症,由Masket于1993年首次正式提出[2]。1998年Miyake等[3]依据发生发展时间将其分为术中、术后早期及术后晚期CBS。而2008年Hong等[4]依据临床特点将CBS分为无细胞型、炎症型及纤维型。但无论何种类型的CBS,连续环形撕囊口被晶状体核或人工晶状体光学区机械性阻塞致晶状体囊袋形成密闭性液腔是其共同的病理生理过程。近年来,有关CBS的临床研究屡见报道[5,6]。Hong等[4]预计与白内障超声乳化吸除术相关的CBS发病率达到0.43%。目前国内缺乏相关流行病学资料,多为个案报道,对此并发症未引起足够重视。
晚期CBS发生于白内障超声乳化术后数月至数年,平均3.8年,发生条件与术中环形撕囊,前囊口较小或环形撕囊口变小而IOL光学区相对较大有关[7]。前囊膜与IOL光学区紧密相贴,残余的晶状体上皮细胞增生并分泌大量晶状体蛋白,结果导致囊袋中乳糜性混浊液体积存,患者出现不同程度的视力下降。晚期CBS亦可伴发近视漂移、前房变浅、继发性青光眼等等眼部症状。多种机制参与晚期CBS近视漂移的发生[8]。首先IOL的前移及囊袋内混浊液体屈光指数增加使视网膜成像靠前,其次充满混浊液体的囊袋类似一枚透镜,增加了眼内的屈光力。本次随访的7例患者(7只眼)晚期CBS分别发生于白内障超声乳化术后1~6年,平均3.7年,与文献报道一致,共同特点为前囊膜连续环形撕囊,撕囊口相较于IOL光学区小,直径约为4.5~5.0 mm,4例患者术后屈光度变化0.75~1.50 D(平均1 D),前房深度较术前不同程度增大,后囊膜距离IOL光学区后表面增大,囊袋内储留大量乳糜性、"牛奶状"混浊液体。但所有患者术前与术后眼压并无显著变化,提示我们,晚期CBS可能诱发青光眼,但并非其共性表现。
关于晚期CBS囊袋中乳糜性混浊液体形成机制的文献认为,其发生发展依赖于阻滞时囊袋内外液体造成的渗透压差,后囊膜在一定程度上起到半透膜的作用,若此时囊袋内液体的渗透压增大(如蛋白含量及Ca2+的增加),将会吸引玻璃体或房水中的水分渗入囊袋内,使囊袋内液体增多。这是一个动态发展的过程[9]。Bao等[10]通过质谱分析法对晚期CBS囊袋内乳糜性液体成分进行分析,发现其蛋白成分及Ca2+含量增加,蛋白成分主要为α及β晶状体蛋白。提示我们乳糜性液体中蛋白成分主要来自于晶状体上皮细胞,而晶状体上皮细胞的不断坏死是乳糜性液体中Ca2+含量增加的主要原因。Eifrig等[11]将囊袋内乳糜性液体抽出进行电泳分析,发现其中有大量α晶状体蛋白,少量白蛋白,但是未发现γ球蛋白,认为抗原抗体介导的炎症反应并未参与其中。但是近年有人在其研究的8例晚期CBS患者中发现其中2例伴有明显的炎症反应,给予抗炎治疗后症状明显缓解,说明抗原抗体介导的炎症反应可能参与其中[4]。Dhaliwal等[12]在晚期CBS患者囊袋内容物中培养出痤疮丙酸杆菌。本次报道的7例患者,我们对其囊袋内乳糜性混浊液体进行了Western blot检测,发现囊袋内乳糜性液体液体含有大量αB及βB晶状体蛋白,与既往文献一致,但未检测到TNF-α及IL-1β表达,表明上述7例未有炎症反应参与。综上所述,晚期CBS的形成原因可能是一个较复杂的过程,多种机制可能于不同时间参与其发生发展,有待于进一步研究。
一旦发生晚期CBS,应建议患者尽早治疗,有利于恢复视力,避免相关并发症(如继发性青光眼)的发生。既往文献提及手术及Nd:YAG激光后囊膜切开两种治疗方式[13,14,15]。YAG激光治疗简单,但晚期CBS往往积液量大且混浊,易影响后囊膜观察及激光聚焦,其次YAG激光后囊膜切开术可引起黄斑囊样水肿(CME)及一过性眼压升高。最为重要的是,囊袋内的乳糜性混浊液体含有大量晶状体蛋白,一旦行激光后囊切开,大量内容物将进入玻璃体腔,易引发视物黑影甚至细菌性或无菌性眼内炎的发生。本次报道的7例患者均选择手术治疗,虽然创伤较YAG激光后囊膜切开为大,但具有其他方式不可比拟的优点:①扩大前囊口,避免CBS的再次发生;②可将混浊液体完全清除于眼外,降低眼内炎症发生发展的可能;③保留了后囊膜的完整性及屏障作用。术后3个月随访结果显示,所有患者视力均恢复理想,患眼无相关并发症发生,满意度高。
为了预防晚期CBS的发生,笔者认为应在白内障超声乳化手术中做到以下几点:①撕囊大小应与IOL光学区直径大小相适宜,一般为5.5~6 mm,<5 mm则易发生CBS;②术中彻底清除皮质,并进行前囊膜及后囊膜抛光,减少晶状体上皮细胞的残留;③IOL植入术后应彻底清除黏弹剂,尤其是IOL后方的黏弹剂;④术后进行抗炎治疗,特别是对合并青光眼及糖尿病的患者,术后更应严格遵循我国白内障围手术期非感染性炎症反应防治专家共识进行术后抗炎治疗。
总之,对于晚期CBS,预防及早期治疗尤为重要,注重术中操作合理性,同时在白内障术后复诊过程中,尤其是小瞳孔下仔细检查有无CBS的发生,对于不明原因视力下降,屈光度增加大大超出术前预计及前房变浅、眼压升高的患者应排除其可能性。手术治疗晚期CBS疗效稳定,相比YAG激光后囊膜切开更具可预测性,值得临床推广。



























