
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女性,60岁,以"反复腰背痛20余年,加重5年"被收入华西医院内分泌科。20多年前患者无明显诱因出现阵发性腰背痛,伴颈后、双肩关节疼痛。分别在5年、3年前无明显诱因出现腰背痛加重。2年前在用手提拉重物后再次出现腰背疼痛加重伴明显活动受限,在当地骨科医院诊断腰3椎体压缩性骨折,卧床制动后活动能力逐渐恢复。近两年连续2次于外院就诊,予以输注唑来膦酸治疗,自觉症状无好转。3个月前(距上一次输注唑来膦酸6个月)因腰背疼痛就诊,诊断为"重度骨质疏松症伴骨折" 。为求进一步诊治,遂入本院内分泌科。自患病以来身高较年轻时下降3 cm。既往高血压病史10年,血压控制可。患者15岁初潮,48岁绝经,孕2次,顺产1胎,流产1胎,哺乳2年。余个人史及家族史无特殊。
入院体格检查示生命体征平稳,神志清楚。身高153 cm,体重53 kg。胸骨柄膨大伴压痛,无明显红肿。心、肺、腹未见明显阳性体征。旋颈征阳性,脊柱、棘突无压痛及叩痛,双肩关节活动无受限。手掌、脚掌可见轻度皮肤脱屑。余无特殊。
常规及生化检查:血钙2.22 mmol/L(参考范围2.1~2.7 mmol/L,下同)、血磷1.18 mmol/L(0.81~1.45 mmol/L)、尿钙3.98 mmol/24 h、尿磷15.52 mmol/24 h、碱性磷酸酶(ALP) 117 IU/L(50~135 IU/L)、骨特异性碱性磷酸酶(BALP)17.35 μg/L(11.4~24.6 μg/L)、抗酒石酸酸性磷酸酶5b片段(TRAP-5b)2.47 U/L(1.87~4.75 U/L)、Ⅰ型胶原羧端肽(CTX)0.368 ng/ml(0.3~0.584 ng/ml)、甲状旁腺素(PTH)8.65 pmol/L(1.6~6.9 pmol/L)、25-羟维生素D 70.94 nmol/L。血常规、大小便常规、肝肾功、电解质、血清白蛋白电泳、免疫固定电泳、血轻链、尿轻链、血沉、C反应蛋白、白细胞介素6、人类白细胞抗原B27(HLA-B27)、免疫球蛋白、ENA抗体谱、ANA抗体、T细胞亚群分析等未见明显异常。
骨密度及影像学检查:双能X线吸收测定法(DXA)示腰1至腰4、股骨颈、全髋骨密度值分别为0.588、0.632、1.069、0.711、0.678、0.624 g/cm2,对应的T值分别为-3.7、-3.9、-0.7、-3.6、-2.1、-2.7,其中腰3椎体骨密度明显更高。胸椎正侧位X光片示胸骨、双侧锁骨近端及第1肋局部稍增粗、骨质密度增高(图1A、图1B),腰3椎体骨密度较其他椎体明显增高(图1C、图1D),胸11、腰3、5椎体楔形变。骨显像示双侧胸锁、第一肋胸关节及胸骨柄骨代谢增高(图1E)。双上肢超声:各关节、骨无明显异常,右侧肱二头肌长头腱腱鞘积液。
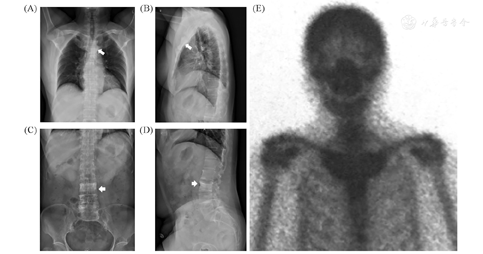

注:(A)(B)患者胸锁关节、第一肋关节及胸骨柄骨肥厚;(C)(D)腰3椎体骨密度增高;(E)骨显像提示患者胸骨柄及双侧胸锁关节有放射性核素浓聚,为SAPHO综合征特征性的"牛头征"
病理检查:腰3椎体行骨活检示出血坏死组织中见少许钙化死骨片伴纤维组织增生,个别炎细胞浸润。
综上所述,患者严重骨质疏松症伴多发椎体压缩性骨折诊断明确,但患者胸骨、双侧锁骨近端及腰3骨密度异常增高原因不明。进一步追问病史,患者诉10年前无明显诱因出现双手、右足跟长皮疹,皮疹分布为散在、簇集,瘙痒难忍,在外院诊断为"掌跖脓疱疮病" ,给予外敷、浸泡中药治疗好转,但每2周左右脓疱疮会复发,周期性行上述治疗。至此,结合患者双侧胸骨及胸锁关节、腰3椎体骨肥厚、掌跖脓疱疮病史,最终诊断:(1)SAPHO综合征;(2)严重骨质疏松症伴胸11、腰3、腰5椎体压缩性骨折;(3)椎间盘突出症。
治疗及随访:在输注唑来膦酸后,患者腰背痛情况有所改善,骨转换指标提示CTX从0.368 ng/ml下降到0.087 ng/ml。加用美洛昔康7.5 mg qd后胸骨阵发性疼痛消失,腰痛进一步缓解。出院后继续口服钙片600 mg qd、阿法骨化醇0.5 μg qd、美洛昔康7.5 mg qd。自觉疼痛较用药前好转,但活动时仍会加重。偶有胸骨及腰痛加重时将美洛昔康间断加量到7.5 mg bid。输注唑来膦酸6个月后患者自觉腰背痛再次逐渐加重,9个月后遂到本院要求再次输注唑来膦酸,入院后查CTX为0.325 ng/ml,血尿钙磷及其他常规检查无明显异常。骨显像和胸腰椎影像学较之前无明显变化。骨密度提示腰椎骨密度平均增长7.4%(表1)。再次输注唑来膦酸后疼痛再次较前缓解,CTX降至0.086 ng/ml。方案无调整,带药出院,继续随访。
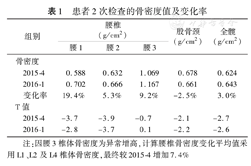
患者2次检查的骨密度值及变化率
患者2次检查的骨密度值及变化率
| 组别 | 腰椎(g/cm2) | 股骨颈(g/cm2) | 全髋(g/cm2) | |||
|---|---|---|---|---|---|---|
| 腰1 | 腰2 | 腰3 | ||||
| 骨密度 | ||||||
| 2015-4 | 0.588 | 0.632 | 1.069 | 0.678 | 0.624 | |
| 2016-1 | 0.702 | 0.666 | 1.167 | 0.661 | 0.643 | |
| 变化率 | 19.4% | 5.3% | 9.2% | -2.5% | 3.0% | |
| T值 | ||||||
| 2015-4 | -3.7 | -3.9 | -0.7 | -2.1 | -2.7 | |
| 2016-1 | -2.8 | -3.7 | 0.1 | -2.2 | -2.6 | |
注:因腰3椎体骨密度为异常增高,计算腰椎骨密度变化平均值采用L1、L2及L4椎体骨密度,最终较2015-4增加7.4%
本文报道1例在严重骨质疏松症基础上发生局限性骨密度增高、骨肥厚和掌跖脓疱疮,诊断SAPHO综合征的患者。
该患者为绝经后老年女性,临床表现为典型的腰背痛、活动能力下降、椎体压缩性骨折,在排除了如多发性骨髓瘤、骨软化等代谢性骨病后,符合原发性骨质疏松症的诊断。在2次输注唑来膦酸后,患者的腰痛缓解时长较一般骨质疏松患者更短,即输注后更快出现症状加重(约6个月左右),在评价唑来膦酸的疗效时必须排除对其疗效有影响的因素,如伴发其他骨骼病变等。该患者体格检查及影像学检查显示患者有局限性的骨密度增高和骨肥厚(胸骨柄、胸锁关节、腰3椎体),且有疼痛症状,不符合骨质疏松症患者的骨骼改变,需要临床医师引起重视,进一步明确诊断。
骨密度增高貌似和骨质疏松症的病理生理表现相反,但这并不是骨质疏松症的保护性因素,绝大多数是骨骼疾病的另一种极端表现。骨密度增高可以是绝对升高,例如T值或Z值大于2~4,也可以是相对升高,特别是和其他部位骨密度相比有显著的差异。临床发现骨密度增高的情况并不少见,主要分为以下两类:假性骨密度增高和真性骨密度增高。假性骨密度增高几乎占了所有骨密度增高病例的一半,其中大约有一半是脊柱骨关节炎导致的,即在椎体边缘形成椎体终板及小关节的硬化和骨赘,即使是轻度的脊柱骨关节炎也会导致腰椎DXA骨密度上升24%[1],使很多的老年患者通过DXA检查无法真实反映椎体松质骨的骨密度,导致漏诊骨质疏松症。然而,这种患者的髋部骨密度受骨质增生的影响有限,其髋部和腰椎骨密度的明显差异可提醒临床医生注意假性骨密度升高。强直性脊柱炎也会使椎旁韧带钙化或骨化,导致DXA骨密度假性升高[2]。椎体压缩性骨折也是导致假性骨密度增高的常见原因。本例患者虽然腰3椎体的骨密度并未达到该标准,但是在严重骨质疏松症的基础上,同样发生压缩性骨折的腰5椎体在影像学上骨密度也显著低于腰3椎体,因此腰3椎体是骨密度相对异常升高。除此之外,由于DXA检测骨密度的固有局限性,X射线穿透路径中的血管钙化、腹部脓肿、结石、肠内钡剂、骨水泥、手术植入物等都会导致骨密度值假性偏高。
在排除了假性骨密度增高之后,剩下的真性骨密度增高又分为2种情况:全身性和局限性骨密度增高。全身性骨密度增高又分为2种类型,即遗传性和获得性。前者不仅包括如石骨症、致密性成骨不全、骨斑点症、肢状纹状肥大等因骨吸收降低所致的疾病,还包括硬化性骨病、van Buchem′s病、低密度脂蛋白相关蛋白(LRP)5和LRP4突变所致的骨密度增加等成骨活性异常增加的疾病[3]。还有一种就是骨形成和骨吸收紊乱,例如Ghosal综合征和Camrati-Engelmann病。获得性的全身性骨密度升高主要原因有肾性骨营养不良、氟骨症、肢端肥大症、丙肝相关骨硬化、骨髓纤维化、肥大细胞增多症等[4,5,6]。遗传性骨病一般都有家族史、发病年龄偏早等特点;而获得性则有基础疾病的其他表现,一般情况下不难鉴别。
局限性的骨密度增高可见于Paget′s病、肿瘤(包括成骨性的原发性骨肿瘤和其他实体肿瘤的成骨性骨转移)、结节性骨硬化、慢性骨髓炎和及本病例中的SAPHO综合征,这些疾病的骨密度增高各具特征[7,8,9]。如Paget′s病主要累及腰椎和髋部,除了骨密度增高,更有特征性蜂窝和板层骨的排列紊乱和局部过度膨大的骨骼畸变;肿瘤的成骨型骨转移常见于前列腺癌,也可见于乳腺癌、胃癌、宫颈癌、结肠癌等。单个椎体的骨密度增加可能是脊柱成骨细胞瘤、尤文氏肉瘤、类癌、血管瘤或浆细胞瘤。结节性骨硬化相对罕见,是常染色体显性遗传疾病,常表现为骨皮质的硬化和骨密度增加,伴发学习障碍、惊厥、心脏平滑肌瘤、血红蛋白尿等。
SAPHO综合征是一种主要累及骨、关节及皮肤的慢性无菌性炎症,主要表现为滑膜炎(synovititis)、痤疮(acne)、脓疱病(pustulosis)、骨肥厚(hyperostosis)和骨炎(osteitis),故名SAPHO。其发病率常认为<1/10 000,好发年龄为40~60岁,男女发病几率相当。目前认为其可能为原发性炎症性骨病,其机制主要与免疫、感染和遗传三方面有关[10]。本病的临床表现主要为皮肤和骨关节及皮肤损害。骨关节损害包括骨炎、骨肥厚、滑膜炎、关节炎、韧带附着端病等。受累部位与发病年龄有关,儿童或青少年最易累及长骨干骺端,其次为前上胸壁和脊柱,成人受累骨主要是肋胸锁骨,其次为中轴骨,包括脊柱和骶髂关节。超过90%的SAPHO综合征患者有关节受累,滑膜炎通常表现为大关节部位的非侵蚀性少关节炎型。症状主要表现为骨或关节的疼痛、压痛,程度可以很严重并持续多年,也可发生发热和局部水肿。骨显像可特异性的显示患者胸锁关节、胸骨柄骨肥厚,呈现"牛头征" 。SAPHO综合征的皮肤病变发病率为50%~70%,严重程度不一,主要表现为脓疱疮和重度痤疮,特征性病变是掌趾部脓疱疮、爆发性痤疮和脓疱性银屑病等。男性中痤疮发生率高,女性患者则以掌趾部脓疱疮较为常见[11]。实验室检查对SAPHO综合征并无诊断意义,炎症指标多正常或轻度升高,部分患者HLA-B27阳性。其诊断标准常用Kahn标准,符合以下任意一条即可诊断:(1)骨和(或)关节病变伴有掌趾脓疱病或寻常型银屑病;(2)骨和(或)关节病变伴有严重型痤疮;(3)成人孤立的无菌性骨肥厚或骨炎;(4)儿童慢性复发性多灶性骨髓炎;(5)骨和(或)关节病伴有炎性肠病并同时除外感染性骨炎和肿瘤骨转移。
SAPHO综合征的治疗以缓解症状为主,非甾体抗炎药(NSAIDs)是目前认可的一线用药,少部分患者使用抗生素有效,病变组织培养阳性的患者疗效可能更显著。对于使用NSAIDs和止痛药后病情反复的患者,使用糖皮质激素可能可以取得较好效果。对于激素用量较大或反复复发的SAPHO患者,可用改善病情抗风湿药(DMARDs)。部分研究发现拮抗肿瘤坏死因子-ɑ(TNF-ɑ)的单克隆抗体在使用NSAIDs、糖皮质激素和DMARDs后病情反复的SAPHO综合征患者中起效迅速[12]。二膦酸盐可通过抑制骨吸收、降低骨转换或可能通过抑制白细胞介素1、白细胞介素6和TNF-ɑ等炎症介质的产生发挥作用,SAPHO综合征患者静脉输注二膦酸盐可使骨痛明显缓解,即使在使用NSAIDs、糖皮质激素和DMARDs后病情仍反复的患者中也有良好的效果。骨转换指标的抑制程度可反映使用二膦酸盐后的临床疗效,在随访过程中可和症状改变一起协助确定二膦酸盐的使用间隔。例如本例患者,其症状在用药6个月后开始加重,而CTX在用药9个月后复查发现已和上次用药前的水平差不多,证明唑来膦酸对骨吸收的抑制作用已经基本消失,与普通的骨质疏松症患者对药物的反应有较大的差异。患者在二膦酸盐和NSAIDS二联用药下疼痛控制可,一定程度上改善了生活质量,缓解了病情。对于同时合并严重骨质疏松症的患者,更是具有一举两得的作用。
长期以来,骨矿物质密度作为评估骨质疏松和骨折风险的重要指标而被重视,临床医生也往往更关注骨矿物质密度降低的情况而忽视了对骨矿物质密度增高情况的深入探讨,可能导致了骨密度增高相关疾病的误诊或漏诊。通过对本例SAPHO综合征合并严重骨质疏松症病例的学习,希望能帮助临床工作者理清骨密度增高病例的思路,提高临床诊治水平。


























