
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
低促性腺激素性性腺功能减退症(hypogonadotropic hypogonadism,HH)是一种多病因引起的以下丘脑-垂体释放激素障碍为特征的性激素缺乏症,可分为先天性和获得性:先天性HH可有KAL1、FGFR1、PROK2和PROKR2等基因的突变,其中伴听力障碍称为Kallmann综合征,占先天性HH的60%;获得性HH病因包括外伤、药物、高催乳素血症、营养不良等。男性HH患者临床上常表现为声细、胡须缺如、外生殖器幼稚、小阴茎、小睾丸或隐睾。HH合并肥胖鲜有报道,本科近期收治一HH合并肥胖男性患者,现报告如下。
患者,男,15岁,因"体重进行性增加10年,加重3年"入院。患者为足月顺产,出生体重3.9 kg,母乳喂养,学习成绩可。4岁多时患者玩耍时不慎摔倒,枕部外伤,有明显肿块,未行影像学检查及特殊处理,3~4周后自行消退。自5岁起出现体重大幅增长,9岁时体重约50 kg,之后平均每年体重增加10 kg,12岁时体重达80 kg,同时发现耳廓边缘,颈后,双手,腋下及双侧腹股沟区皮肤黑棘皮样改变,12岁至15岁患者平均每年体重增加12 kg,3年内体重共增加37.4 kg,身高增长约20 cm。患者既往有大三阳乙肝病史,无其他重大疾病、手术及过敏史,否认遗传性疾病史,父母非近亲结婚,有1弟,弟弟生长发育正常。初诊时(2015年4月)身高158 cm,体重117.4 kg,体重指数47.03 kg/m2。查体:多血质面容,神智清,反应稍慢,头面部无畸形,胡须缺如,无喉结,声音细,腋毛缺如,颈后、耳后、腋窝及腹股沟处可见黑色天鹅绒样皮肤改变,双侧乳腺发育B2-B3期,腹部无紫纹,外生殖器发育幼稚(P1G1),阴毛缺如,阴茎长3~4 cm,埋于皮肤内,双侧睾丸位于阴囊内,约2~3 ml,质软。臂展145.5 cm,上部量84 cm,下部量76 cm。
入院实验室检查:丙氨酸转氨酶72.3 U/L,门冬氨酸氨基转移酶89.8 U/L,尿酸446.9 μmol/L,总胆固醇7.07 mmol/L,低密度脂蛋白胆固醇4.91 mmol/L,FT4 9.15 pmol/L,TSH 10.192 mU/L,睾酮1.7 nmol/L,雌二醇411.6 pmol/L,垂体催乳素61.3 μg/L,生长激素0.1 μg/ml(表1)。影像学检查:骨龄约13岁。乳腺超声显示双乳头下后方见低回声区,边界不清晰,内部回声类似乳腺组织,范围22 mm×14 mm×26 mm(右侧)、15 mm×10 mm×21 mm(左侧)。睾丸超声:右侧睾丸13 mm×8 mm×10 mm;左侧睾丸12 mm×10 mm×10 mm,双附睾未显示。上腹部CT(平扫+增强):脂肪肝。肾上腺CT平扫+增强提示未见明显异常。垂体平扫+增强扫描提示未见明显占位。染色体46,XY。
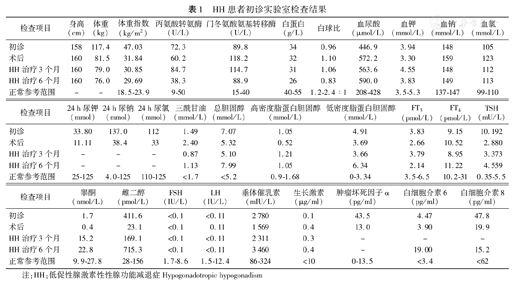
HH患者初诊实验室检查结果
HH患者初诊实验室检查结果
| 检查项目 | 身高(cm) | 体重(kg) | 体重指数(kg/m2) | 丙氨酸转氨酶(U/L) | 门冬氨酸氨基转移酶(U/L) | 白蛋白(g/L) | 白球比 | 血尿酸(μmol/L) | 血钾(mmol/L) | 血钠(mmol/L) | 血氯(mmol/L) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 初诊 | 158 | 117.4 | 47.03 | 72.3 | 89.8 | 34 | 0.96 | 446.9 | 3.94 | 148 | 105 |
| 术后 | 160 | 81.5 | 31.84 | 60.2 | 118.2 | 32 | 1.10 | 572.2 | 3.30 | 159 | 123 |
| HH治疗3个月 | 160 | 79.0 | 30.85 | 84.7 | 114.7 | 31 | 1.06 | 563.6 | 4.55 | 148 | 112 |
| HH治疗6个月 | 160 | 76.0 | 29.69 | 38.3 | 88.9 | 26 | 0.83 | 590.0 | 3.83 | 149 | 113 |
| 正常参考范围 | - | - | 18.5-23.9 | 9-50 | 15-40 | 40-55 | 1.2-2.4∶1 | 208-428 | 3.5-5.3 | 137-147 | 99-110 |
| 检查项目 | 24 h尿钾(mmol) | 24 h尿钠(mmol) | 24 h尿氯(mmol) | 三酰甘油(mmol/L) | 总胆固醇(mmol/L) | 高密度脂蛋白胆固醇(mmol/L) | 低密度脂蛋白胆固醇(mmol/L) | FT3(pmol/L) | FT4(pmol/L) | TSH(mU/L) |
|---|---|---|---|---|---|---|---|---|---|---|
| 初诊 | 33.80 | 137.0 | 112 | 1.49 | 7.07 | 1.05 | 4.91 | 3.83 | 9.15 | 10.192 |
| 术后 | 11.11 | 38.4 | 33 | 2.40 | 5.32 | 0.52 | 3.69 | 2.66 | 10.52 | 2.880 |
| HH治疗3个月 | - | - | - | 0.87 | 5.10 | 1.21 | 3.66 | 3.79 | 8.95 | 3.373 |
| HH治疗6个月 | - | - | - | 1.13 | 7.99 | 1.05 | 6.34 | 2.14 | 11.22 | 4.559 |
| 正常参考范围 | 25-125 | 4.0-125 | 110-125 | <1.7 | <5.2 | 0.9-1.68 | 0-3.34 | 3.5-6.5 | 10.2-31 | 0.35-5.5 |
| 检查项目 | 睾酮(nmol/L) | 雌二醇(pmol/L) | FSH(IU/L) | LH(IU/L) | 垂体催乳素(mIU/L) | 生长激素(μg/ml) | 肿瘤坏死因子α(pg/ml) | 白细胞介素6(pg/ml) | 白细胞介素8(pg/ml) |
|---|---|---|---|---|---|---|---|---|---|
| 初诊 | 1.7 | 411.6 | <0.1 | <0.11 | 2 780 | 0.1 | 43.5 | 4.47 | 47.8 |
| 术后 | 0.4 | 23.1 | <0.1 | 0.11 | 1 569 | 0.4 | 13.0 | 3.90 | 19.9 |
| HH治疗3个月 | 15.2 | 169.1 | <0.1 | <0.11 | 2 311 | 0.3 | - | - | - |
| HH治疗6个月 | 22.8 | 715.3 | <0.1 | <0.11 | 3 460 | 0.4 | - | 19.00 | 15.2 |
| 正常参考范围 | 9.9-27.8 | 28-156 | 1.7-8.6 | 1.5-12.4 | 86-324 | <10 | 0-13.5 | <3.4 | <62 |
注:HH:低促性腺激素性性腺功能减退症Hypogonadotropic hypogonadism
治疗经过:因患者体重指数>40 kg/m2,考虑目前肥胖为主要矛盾,且睾酮、生长激素、甲状腺激素水平异常可能由于肥胖引起,故决定先进行减重治疗,于2015年5月11日行LSG(laparoscopic sleeve gastrectomy,袖状胃切除术)。术后1天复查,患者血钾:3.3 mmol/L、血钠:159 mmol/L、FT3 2.66 pmol/L、TSH 2.88 mU/L。患者LSG术后3个月入院复查,其体重较前减少35.9 kg,睾酮0.4 nmol/L,雌二醇23.1 pmol/L,LH<0.1 IU/L, FSH 0.11 IU/L,生长激素0.4 μg/ml,血钠159 mmol/L,24 h尿钠11.11 mmol/L(表1)。对比患者减重前后各项指标发现:患者体重虽较前下降明显,但各类激素水平仍未见改善,为明确其病因:(1)首先行HCG兴奋试验,血睾酮峰值出现在第3天,峰值为基础值3.5倍;(2)再行GnRH兴奋试验(100 μg 30 s内静推),发现在180 min内LH、FSH并无明显升高,考虑患者垂体功能可能由于长期缺乏GnRH刺激而对其反应较差,故予以GnRH脉冲泵佩戴(戈纳瑞林600 U混合生理盐水3 ml;给药频率设定为16次/d,10 U/次,90 min/次),发现LH可在行GnRH刺激后第4天后逐渐升高并接近正常水平;(3)由于患者近几年身高增长不明显,我们进一步采用精氨酸刺激试验和低血糖兴奋试验行生长激素激发试验,其结果均提示生长激素完全缺乏(表2);(4)嗅觉测定:蒙眼凭嗅觉可分辨酒精、水及醋。结合患者病史及上述实验室检查,目前认为其主要诊断为"肥胖症;低促性腺激素性性功能减退症;生长激素缺乏症" ,治疗方案为:绒毛膜促性腺激素(hCG)2 000 U biw肌肉注射改善第二性征,保肝,运动方式干预等对症治疗。未行生长激素替代治疗。
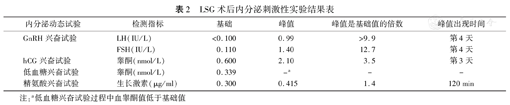
LSG术后内分泌刺激性实验结果表
LSG术后内分泌刺激性实验结果表
| 内分泌动态试验 | 检测指标 | 基础 | 峰值 | 峰值是基础值的倍数 | 峰值出现时间 |
|---|---|---|---|---|---|
| GnRH兴奋试验 | LH(IU/L) | <0.100 | 0.99 | >9.9 | 第4天 |
| FSH(IU/L) | 0.110 | 1.40 | 12.7 | 第4天 | |
| hCG兴奋试验 | 睾酮(nmol/L) | 0.600 | 2.10 | 3.5 | 第3天 |
| 低血糖兴奋试验 | 睾酮(nmol/L) | 0.339 | -a | - | - |
| 精氨酸兴奋试验 | 生长激素(μg/ml) | 0.300 | 0.415 | 1.4 | 120 min |
注:a低血糖兴奋试验过程中血睾酮值低于基础值
当男性骨龄大于12岁或生物年龄大于18岁时,尚无第二性征出现和睾丸体积增大,总睾酮水平<3.47 mmol/L,且FSH、LH水平正常或降低,可诊断为HH[1,2]。本例患者年龄15岁,仍在青春发育期,其激素水平异常首先需排除体质性青春发育延迟(constitutional delayed puberty, CDP)。CDP定义为14岁后才自发出现青春发育,不影响第二性征及生精能力。一般认为CDP患者对于GnRH兴奋试验可有与其骨龄相符的反应,但对HH患者单剂量注射GnRH后的LH、FSH呈低弱反应,而多次持续注射GnRH后,多数患者LH、FSH分泌水平逐渐增高,可能接近正常范围[3]。本患者年龄15岁而未出现正常发育,为确诊采用戈纳瑞林兴奋试验。单次戈纳瑞林兴奋结果为阴性,考虑存在长期促性腺激素释放激素缺乏所致垂体对其反应性较差的可能,予戈纳瑞林泵连续给药后第4天LH、FSH可明显升高,且患者的骨龄落后于实际年龄近3岁,故HH诊断成立。
HH可由遗传、外伤、肿瘤、系统性疾病等多病因导致[4]。鉴于本例患者除存在发育迟缓外,还伴随有重度肥胖、电解质紊乱、甲状腺激素水平异常、生长激素缺乏、高催乳素血症等多项内分泌代谢指标异常,而在患者行LSG术后,虽其肥胖明显改善但上述激素水平异常仍存在;且在术后随访中患者诉常有低体温症状(最低约为35℃),强烈提示患者存在下丘脑功能紊乱,又称为下丘脑综合征(hypothalamic syndrome)。其发病机制为下丘脑相关核团受损,致多个内分泌轴功能受抑,进而出现代谢紊乱,临床上常表现为精神行为异常,水电解质代谢紊乱,多项激素水平异常等,发生在儿童早期可表现为肥胖、高催乳素血症、生长激素缺乏、青春期HH等[5,6,7,8]。本患者除无明显精神行为异常外,与上述其余临床表现相符。下丘脑综合征可由多因素导致,最常见为肿瘤,其次有炎症、肉芽肿、外伤、遗传缺陷等,其中病因不明的下丘脑综合征称为特发性下丘脑综合征。本文患者在5岁时有头部外伤史,而在此之前家属诉患儿各项生长发育指标均正常,故推测脑外伤史为其下丘脑综合征的可能病因,但仍需进一步筛查与HH相关及与垂体发育相关的致病基因,排除由基因突变所致疾病的可能。
此外,患者性腺发育不良及肥胖起病早,需考虑遗传性疾病可能:Prader-Willi综合征患者表现为低促性腺激素性性腺功能减退及生长激素缺乏[9],其特征性为出生即出现吸吮障碍、肌张力低下,有特征性面容,伴性格改变,染色体检查有15q11-q13位点基因表达缺失;Bardet-Biedl综合征(BBS)患者也可表现为肥胖,研究发现其机制与BBS基因缺失致瘦素受体功能异常进而导致的瘦素抵抗有关,该病患者常合并色素性视网膜炎、肾功能异常、轴后性多趾/指症、学习障碍及泌尿系统损害[10]。本患者生长史无殊,无相关疾病家族史,查体无特殊面容、畸形或视力障碍,无学习障碍,肾功能无明显异常,实验室检查无自身免疫相关阳性指标,染色体核型正常,且患者症状为后天出现,其先天性基因变异可能性较小。
值得注意的是,本例患者除存在HH外,其体重指数≥40 kg/m2,属于重度肥胖[11]。目前认为,肥胖与下丘脑-垂体-性腺轴的功能明显相关,而下丘脑神经元合成的kisspeptin可能是联系肥胖与性激素的关键因素。研究发现,肥胖患者所伴随而来的瘦素抵抗、低度炎症、高雌激素血症等均会导致KISS神经元释放kisspeptin减少,导致GnRH分泌减少;而上述代谢异常也可直接作用于性腺,使睾丸Leydig细胞对促性腺激素反应性降低,减少睾酮分泌;此外,肥胖患者的高胰岛素水平及胰岛素抵抗状态会抑制肝脏合成性激素结合球蛋白(SHBG),后者为睾酮及雌激素的重要载体蛋白;另白色脂肪组织大量分泌细胞色素芳香化酶P450,使睾酮向雌激素不可逆转化,进一步加重其性激素失调[12,13,14]。据报道,肥胖所致的性激素分泌异常可短期内(3个月内)通过代谢性手术得到改善[13,15]。然而,本患者行LSG后4个月余体重明显下降,但其睾酮及促性腺激素水平持续偏低,故支持肥胖并非导致患者HH的病因。结合患者病史及其他激素异常,强烈提示患儿存在重度肥胖的可能原因为下丘脑功能紊乱所致,但仍需要进一步筛查患儿是否存在与重度肥胖相关的基因,如LEP(leptin,瘦素)和LEPR(leptin receptor,瘦素受体)基因以及MCR4(melanocortin-4 recepto,黑色素皮质激素第四受体)基因等,以排除由上述单基因突变所引起的肥胖的可能。
本文患者重度肥胖已采用LSG手术治疗,且体重下降明显,术后近1年时,其体重指数已由43 kg/m2下降至30 kg/m2,且脂肪肝程度及肝功能等代谢指标得到明显好转。而针对其HH及生长激素缺乏的治疗,患者因家庭原因,拒绝使用生长激素,仅采用hCG肌注纠正低雄激素血症,随访过程中患儿的身高增长约2 cm,自觉时有晨勃、体力较前增加,查体发现外生殖器逐渐有色素沉着,阴茎及睾丸体积逐渐增大;睾酮水平逐渐上升至正常,为22.8 nmol/L(表1)。但在随访过程中,患者的甲状腺激素水平时有波动,血钠高于正常,PRL持续较高,时有低体温及神智恍惚,反应迟钝等情况发生,进一步支持患者存在下丘脑综合症的可能。
本文报道了1例男性HH合并重度肥胖的患者,在临床上实属罕见,且患者还存在多种垂体激素的异常及电解质紊乱,强烈提示存在下丘脑综合症。临床医生对存在重度肥胖的患者应注意筛查是否存在其他激素的异常,以免漏诊及误诊为单纯性肥胖。


























