
报道1例以多饮、多尿为主诉的39岁女性中枢性尿崩症患者,合并肺部病变,经实验室和病理学检查明确诊断为IgG4相关性疾病。对于中枢性尿崩症合并肺部病变等多个器官病变时,要考虑到IgG4相关性疾病的可能性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女性,39岁,因多尿、多饮3个月,加重2周于2014年10月入院。患者入院前3个月,无明显诱因出现口渴多饮,喜冷饮,每日饮水约3 000 ml,尿量2 500 ml以上,伴夜尿4次/夜,无多食、消瘦等。3周前,因纳差于外院行胃镜检查后出现咽痛,每日饮水量减至约1 000 ml,尿量仍在每日2 500 ml以上。2周前,患者出现头晕、嗜睡、言语不清,无发热、咳嗽等症状。1周前,于我院急诊查电解质:血钠178 mmol/L、血钾3.9 mmol/L;血糖29.6 mmol/L;尿常规:尿糖4+、尿酮体-、尿比重1.005;血气分析:pH 7.41、PCO2 43 mmHg(1 mmHg=0.133 kPa)、PO2 74 mmHg,BE 2.7 mmol/L,乳酸2 mmol/L,给予补液、小剂量胰岛素输注等治疗后,头晕减轻,意识清醒,但尿量增至7 000~8 000 ml/d,尿渗透压(226 mOsm/kg H2O)<血渗透压(392 mOsm/kg H2O),考虑"尿崩症"不除外,给予醋酸去氨加压素(弥凝)0.1 mg试验性治疗后,尿量明显减少,为进一步诊治收入我科。患者2个月来体重下降共计15 kg。既往史:类风湿性关节炎10余年,2年余前开始口服泼尼松2.5 mg tid治疗,1个月前停用。6个月前,体检空腹血糖4.5 mmol/L,1个月前发现血糖升高达8 mmol/L。
体格检查:体温36.2℃,脉搏95次/min,呼吸14次/min,血压109/80 mmHg,体重指数20.43 kg/m2,营养中等,急性面容,痛苦表情,被动体位,神志欠清,全身皮肤黏膜略干燥,全身浅表淋巴结未触及肿大。双肺呼吸音清,未及干湿啰音。心律齐,未及杂音。腹软,无压痛,肝脾未触及。双侧肘关节外展轻度受限。双下肢不肿。
实验室检查:血常规:白细胞6.63×109/L,中性粒细胞百分比55.7%,血红蛋白130 g/L,血小板123×109/L。电解质:血钠178 mmol/L(正常参考范围137~147,下同)。血淀粉酶58 U/L(30~110),脂肪酶104 U/L(23~300)。尿渗透压226 mOsm/kg H2O(600~1 000),血渗透压392 mOsm/kg H2O(275~305)。空腹C肽354.9 pmol/L(270~1282)。ICA、GAD抗体均阴性。甲状腺功能:TT3 0.75 ng/ml(0.6~1.81)、TT4 5.8 μg/dl(4.5~10.9)、FT3 1.74 pg/ml(2.3~4.2)、FT4 0.56 ng/dl(0.89~1.8)、TSH 5.51 mIU/L(0.55~4.78)。甲状腺球蛋白抗体50.5 U/L(<60),甲状腺过氧化物酶抗体373.7 U/L(<60)。皮质醇:08∶00 13.7 μg/dl(5~25)、16∶00 4.4 μg/dl、24∶00 2.3 μg/dl。ACTH:08∶00 24.6 pg/ml(7.2~63.3)。性激素:催乳素7.49 ng/ml(1.9~25),FSH 20.5 IU/L(0.7~11.1),LH 8.61 IU/L(0.8~7.6),孕酮<0.64 nmol/L(0.86~2.9)。免疫球蛋白:IgG 27.5 g/L(6.94~16.18),IgA 5.37 g/L(0.7~3.8),IgE 508 IU/ml(≤100)。IgG亚型:IgG1 12.3 g/L(4.05~10.11), IgG2 8.89 g/L(1.69~7.86), IgG3 0.669 g/L(0.11~0.85), IgG4 2.87 g/L(0.03~2.01)。
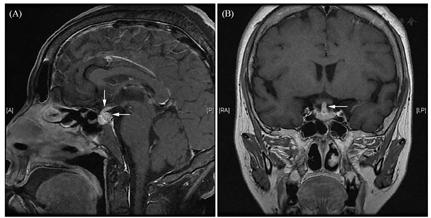
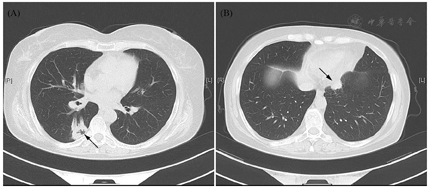
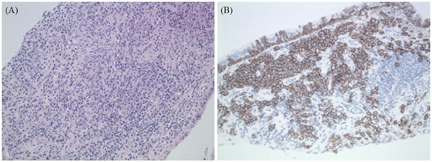
影像学资料:鞍区MRI平扫+增强提示垂体后叶及垂体柄信号异常(图1)。甲状腺超声:甲状腺实质弥漫性病变,不除外桥本甲状腺炎。全身浅表淋巴结超声波检查提示双侧锁骨上区多发稍大淋巴结,右侧大者1.0 cm×0.7 cm,左侧大者0.9 cm×0.7 cm。肺CT:右肺下叶背段空洞合并双肺多发性结节影(图2)——化脓性感染、肺脓肿?经CT引导下右肺下叶结节穿刺活检,病理学检查结果回报:肺间隔明显增宽,部分实变,伴大量淋巴细胞、浆细胞及少许嗜酸性粒细胞浸润(图3)。免疫组化染色提示CD138+、IgG4+,部分热点区域IgG4+细胞约为40个/高倍视野。特殊染色:弹力纤维+,革兰氏-,PSA-,PASM-,黏液卡红-。请结合临床除外IgG4相关性疾病(IgG4-related disease, IgG4-RD)。未见明确真菌、结核及肿瘤性病变。腹部CT未见异常。



有明显的多饮、多尿的症状,就诊于我院急诊时存在严重的高钠血症、低比重尿、尿渗透压<血渗透压,因此中枢性完全性尿崩症诊断明确。中枢性尿崩症的病因主要包括获得性、遗传性以及特发性。该患者除尿崩症外,还同时合并糖尿病、桥本甲状腺炎、类风湿性关节炎、肺部病变等多系统病变,因此需考虑自身免疫疾病的可能。结合肺部穿刺病理学检查结果,最终明确诊断为IgG4-RD。此外,患者糖尿病诊断明确,在糖尿病分型方面,根据患者病史、空腹C肽水平及抗体阴性考虑1型糖尿病可除外;因IgG4-RD常有自身免疫性胰腺炎,因此需考虑特殊类型糖尿病可能,但患者临床上并无胰腺炎的症状,血淀粉酶正常,且腹部CT并未提示胰腺受累,故目前可能性不大。糖尿病考虑2型糖尿病可能性较大。
治疗上,确诊为IgG4-RD后,予强的松龙40 mg QD口服治疗。针对尿崩症,给予醋酸去氨加压素:早0.1 mg、午0.05 mg、晚0.1 mg,治疗后每日入量约2 000~3 000 ml,尿量2 000~3 000 ml,出入量大致平衡,血钠降至正常。对于糖尿病,予阿卡波糖控制血糖,空腹血糖约5~7 mmol/L,餐后2 h血糖约7~10 mmol/L。对于类风湿性关节炎,给予来氟米特、硫酸羟氯喹治疗。1个月后患者病情稳定出院。出院前复查空腹C肽561.5 pmol/L。甲状腺功能:TT3 0.93 ng/ml、TT4 8.1 μg/dl、FT3 2.28 pg/ml、FT4 0.87 ng/dl、TSH 1.44 mIU/L。皮质醇:08∶00 17.5 μg/dl。ACTH:08∶00 18.3 pg/ml。出院后患者定期随诊,门诊复查HbA1C 6%。出院半年后强的松龙改为强的松。目前醋酸去氨加压素为早0.2 mg、午0.1 mg、晚0.1 mg,强的松5 mg qd,IgG4下降至0.534 g/L,患者病情稳定,复查肺部病变较前缩小(图4)。
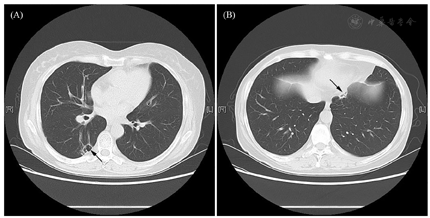

在临床上,自身免疫性疾病是完全性中枢性尿崩症的常见病因。本例患者提示,当中枢性尿崩症合并肺部病变、自身免疫性甲状腺疾病等多个器官病变时,需要考虑IgG4-RD的可能性。
IgG4-RD是一组系统性炎症纤维化的疾病,其主要特征为血清中IgG4升高和多个器官IgG4+细胞浸润,进而导致组织硬化和纤维化。男性好发,男女比例约为3∶1,发病年龄多在50岁以上[1]。患者多为慢性或亚急性起病,多数无全身症状,主要症状与受累器官有关。IgG4-RD可累及泪腺、腮腺、甲状腺、肺脏、胰腺、中枢神经系统、肾脏等,其中自身免疫性胰腺炎和IgG4相关肾病较为常见,累及中枢神经系统或肺部的IgG4-RD相对较少。
IgG4-RD累及肺部时,其临床表现和影像学改变多样化,可表现为肺内结节、毛玻璃样改变、胸膜增厚或肺间质纤维化[2,3]。累及甲状腺时可以表现为Riedel甲状腺炎或桥本甲状腺炎,但目前尚未达成共识,有部分学者认为应该单独诊断为IgG4相关性甲状腺炎[4,5,6,7]。淋巴结受累主要表现为无痛性淋巴结肿大,既可以波及全身淋巴结,也可以仅为病变周围淋巴结肿大,多数直径为1~3 cm。然而,因为淋巴结穿刺很难确定其纤维化的程度,所以依靠淋巴结穿刺诊断IgG4-RD较为困难[8]。IgG4-RD累及垂体极为少见,其可以表现为垂体炎[9],导致垂体前叶和后叶激素分泌异常。MRI可显示垂体柄增粗、蝶鞍扩大。
2012年1月,日本学者提出了IgG4-RD的诊断标准[10],其中包括:(1)一个或多个器官出现弥漫性/局限性肿胀或肿块的临床表现;(2)血清IgG4浓度≥1.35 g/L;(3)组织病理学检查:①显著的淋巴细胞、浆细胞浸润及纤维化;②IgG4+浆细胞浸润:IgG4+/IgG+细胞>40%,且IgG4+浆细胞>10个/高倍视野。确定诊断:1+2+3;很可能诊断:1+3;可能诊断:1+2。2012年5月,国际病理学会发布了IgG4-RD病理表现的诊断共识[11]。主要包括:(1)诊断IgG4-RD主要依赖其组织病理学特征,次要标准是其组织内的IgG4+细胞计数及IgG4+/IgG+细胞比例。(2)IgG4组织病理特征包括以下3个方面:①大量淋巴浆细胞浸润;②纤维化,特征性的形态为席纹状;③闭塞性静脉炎。(3)IgG4+细胞计数的阳性界点:因为诊断时器官的纤维化程度不同,故难以选择统一的阳性界点作为标准。IgG4+/IgG+细胞比例>40%是IgG4-RD诊断的必要条件,但不能作为充分条件。
本例患者主要表现为中枢性尿崩症,其鞍区MRI提示垂体柄增粗、垂体后叶亮信号消失。同时合并肺内多发结节病变、桥本病、淋巴结肿大,化验检查提示IgG4为2.87 g/L,右肺下叶结节穿刺活检病理学检查示大量淋巴细胞、浆细胞及少许嗜酸性粒细胞浸润,免疫组化染色提示IgG4+细胞约为40个/高倍视野,因此诊断为IgG4-RD。
关于IgG4-RD的治疗,目前首先推荐的是激素治疗(强的松龙每日0.6~1.0 mg/kg,2~4周后以每1~2周5 mg的速度逐渐减量,2~3个月后完全停用或以小剂量维持)[12,13],但目前尚缺乏大规模的临床试验数据的支持。此外,也可选用免疫抑制剂如硫唑嘌呤、吗替麦考酚酯,上述治疗无效还可以考虑利妥昔单抗治疗。本例患者给予强的松龙治疗后肺部病变和垂体病变都明显缩小,IgG4水平显著下降,进一步支持该诊断。尽管如此,关于中枢性尿崩症,目前仍需醋酸去氨加压素治疗。目前患者仍在定期随访之中。



























