
甲状腺细胞病理学Bethesda报告系统(The Bethesda System for Reporting Thyroid Cytopathology, TBSRTC)于2007年首次提出,2009年正式发布,是最广为接受的、规范化的甲状腺细胞病理学诊断分类依据。基于近年来甲状腺领域出现的众多进展,2017年10月修订后的第二版TBSRTC面世。本文对新版TBSRTC的更新点做以概括和解析。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺细针穿刺(fine needle aspiration, FNA)细胞学检查是评估甲状腺结节良恶性的重要方法。要想充分发挥其作用,细胞病理学诊断是核心之一。甲状腺细胞病理学Bethesda报告系统(The Bethesda System for Reporting Thyroid Cytopathology, TBSRTC)是最广泛被接受的甲状腺细胞病理学诊断分类依据。它的建立为进一步决定甲状腺结节的治疗策略提供了依据,为不同医疗机构提供了统一的甲状腺细胞学诊断术语和评判标准,为临床和科研团队间互享细胞病理学信息和有效交流提供了可能。美国甲状腺学会(American Thyroid Association, ATA)在其颁布的甲状腺结节和甲状腺癌诊治指南中,明确推荐采用TBSRTC进行甲状腺FNA细胞病理学的诊断分类。
第一版TBSRTC于2007年首次提出。当时,随着甲状腺FNA研究的深入和相应临床数据的不断积累,对相关诊断名词及其分类系统进行标准化和规范化的需求日益迫切。TBSRTC的初稿经过两轮网上征询意见和修改后,于2007年10月22至23日,美国国立癌症研究所在贝塞斯达(Bethesda)召开了甲状腺FNA的专题会议,多学科专家学者们(包括细胞病理学家、内分泌学家、影像学家、外科医生和分子生物学家)展开热烈讨论,议题包括甲状腺FNA的形态学诊断标准、临床意义和分子病理进展等。根据会议的讨论和新一轮网上征询意见,首版TBSRTC最终定稿,于2009年正式发表[1]。TBSRTC问世后,甲状腺肿瘤领域又出现很多进展,如甲状腺癌的分子标记物检测,以及病理亚型中"具有乳头状核特征的非浸润性甲状腺滤泡性肿瘤(NIFTP)"的提出等[2,3,4,5,6]。因此,2016年在日本横滨召开的国际细胞学大会上,以美国Faquin B、瑞士Pusztaszeri M和意大利Rossi ED教授带领的17位国际知名病理学专家,回顾了2010~2016年间的新文献,对TBSRTC要更新的内容进行讨论并形成共识[7]。这一共识为2017年10月最终定稿出版的第二版TBSRTC[8]奠定了重要基础。
基于两个出发点,本文将对新版TBSRTC的主要更新点作一介绍:第一,TBSRTC是国际公认的甲状腺细胞病理学标准,若想与国际接轨,必须推广、规范其应用,主动跟踪进展,正确解读FNA细胞病理结果;第二,甲状腺结节的诊断和评估涉及多个学科,为了提供更优质的医疗服务、开展更好的多学科交流和合作,除病理科之外的相关学科医生也应当对TBSRTC有所了解。
首先要明确的是,新版TBSRTC仍然沿用了第一版中使用的甲状腺细胞病理学结果的六个类别名称,即:Ⅰ,标本无法诊断或取材不满意(Nondiagnostic or Unsatisfactory, UD/UNS);Ⅱ,良性病变(Benign);Ⅲ,意义不明确的细胞非典型病变,或意义不明确的滤泡性病变[Atypia of Undetermined Significance (AUS) or Follicular Lesion of Undetermined Significance (FLUS)];Ⅳ,滤泡性肿瘤或可疑滤泡性肿瘤(如为许特尔细胞型需特殊标明) [Follicular Neoplasm (FN) or Suspicious for a Follicular Neoplasm (SFN),specify if Hürthle cell (oncocytic) type];Ⅴ,可疑恶性肿瘤(Suspicious for Malignancy, SM);Ⅵ,恶性肿瘤(Malignancy)。而且,新版将仍然基于这六类细胞学结果,分别给出恶性风险度和临床处理建议。
与第一版TBSRTC相比,新版的主要更新点在于:第一,Bethesda Ⅰ、Ⅲ、Ⅳ、Ⅴ类细胞学结果的恶性风险度有所调整;第二,对"滤泡性肿瘤或可疑滤泡性肿瘤(FN/SFN)"和"恶性肿瘤"的界定标准进行修改;第三,将NIFTP的影响考虑其中;第四,对细胞病理学诊断为Bethesda Ⅲ、Ⅳ、Ⅵ类的结节,临床处理意见给予修订。我们将两版内容对比概括于表1,并按照Bethesda分类具体解析如下:
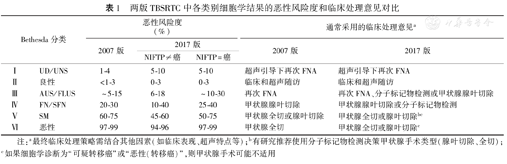
两版TBSRTC中各类别细胞学结果的恶性风险度和临床处理意见对比
两版TBSRTC中各类别细胞学结果的恶性风险度和临床处理意见对比
| Bethesda分类 | 恶性风险度(%) | 通常采用的临床处理意见a | ||||
|---|---|---|---|---|---|---|
| 2007版 | 2017版 | 2007版 | 2017版 | |||
| NIFTP≠癌 | NIFTP=癌 | |||||
| Ⅰ | UD/UNS | 1-4 | 5-10 | 5-10 | 超声引导下再次FNA | 超声引导下再次FNA |
| Ⅱ | 良性 | <1-3 | 0-3 | 0-3 | 临床和超声随访 | 临床和超声随访 |
| Ⅲ | AUS/FLUS | ~5-15 | 6-18 | ~10-30 | 再次FNA | 再次FNA、分子标记物检测或甲状腺腺叶切除 |
| Ⅳ | FN/SFN | 20-30 | 10-40 | 25-40 | 甲状腺腺叶切除 | 甲状腺腺叶切除或分子标记物检测 |
| Ⅴ | SM | 60-75 | 45-60 | 50-75 | 甲状腺全切或腺叶切除 | 甲状腺全切或腺叶切除bc |
| Ⅵ | 恶性 | 97-99 | 94-96 | 97-99 | 甲状腺全切 | 甲状腺全切或腺叶切除c |
注:a最终临床处理策略需结合其他因素(如临床表现、超声特点等);b有研究推荐使用分子标记物检测决策甲状腺手术类型(腺叶切除、全切);c如果细胞学诊断为"可疑转移癌"或"恶性(转移癌)",则甲状腺手术可能不适用
2007版TBSRTC中,满意的FNA标本需至少包含6组良性表现且适宜观察的甲状腺滤泡上皮细胞,每组至少由10个细胞构成。新版中,基于专家共识而非循证证据,对于下述特殊情况不再要求必须满足甲状腺滤泡细胞的数量规定,即可认定为满意的FNA标本:有丰富胶质的少细胞标本,足以得出特定诊断(如淋巴细胞性甲状腺炎)的标本,存在明显细胞异型性的标本[9]。此外,对于仅有囊性成分的FNA标本,需与超声影像结合分析其是否足以代表目标结节的特点、是否是满意的标本。近年来文献报道,该类别甲状腺结节手术后证实的恶性占比为9%~32%。这一比例远高于旧版中的相应数字(1%~4%)。然而,因为74%~93%的Bethesda Ⅰ类结节未行手术,而接受手术治疗的多为重复FNA仍不能得到满意样本、或是临床/超声提示恶性征象者,这种选择性偏倚导致恶性风险被高估[10]。综合考虑后,对于全部UD/UNS结节,新版TBSRTC将其恶性风险度调整为5%~10%。
2007版TBSRTC中,细胞病理学判定为这一类别的甲状腺结节,其恶性风险度为5%~15%。但近10年间发表的文献显示,Bethesda Ⅲ类结节中恶性比率往往高于这一数字,例如:2014年Ho A等和Choi等分别报道26.6%~37.8%和32.4%的AUS/FLUS结节为甲状腺癌[11,12];在3篇分别包含25 445、81 833和145 928例FNA样本的meta分析中,提示AUS/FLUS结节的恶性率分别为16%、27%和34%[13,14,15];我国江苏和山东的单中心数据则分别为45.5%和71.4%[16,17]。但是,准确评估该类结节的恶性风险仍具有挑战性[18]。与Bethesda Ⅱ类结节存在类似问题,即并非所有AUS/FLUS结节患者均选择手术治疗,故仅基于组织病理学随访的恶性风险预测可能因选择性偏倚而高估实际数字;而另一角度,如果把未切除的结节都按良性去推算所有AUS/FLUS结节的恶性风险,显然会低估实际数字;真正的恶性风险应该是介于上述两者之间。在综合考虑了上述情况后,新版TBSRTC中将AUS/FLUS(Bethesda Ⅲ)类别结节的恶性风险度调整为10%~30%。
给Bethesda Ⅲ类细胞病理学结果的恶性风险度估测带来很大影响的另一因素,还是2016年提出的NIFTP概念。研究显示,绝大多数NIFTP的细胞学落在不确定诊断类别,即Bethesda Ⅲ、Ⅳ和Ⅴ类中[19,20,21]。因此,如果不再把NIFTP视作甲状腺癌,依据美国的研究结果,AUS/FLUS结节的恶性风险减少44%~45%[19,20],故新版TBSRTC将"NIFTP≠癌"时该类结节的恶性风险度估测为6%~18%。笔者认为,这里需要注意两点:(1)既往所有PTC中NIFTP所占的比例高低,会导致其改变AUS/FLUS结节恶性风险的程度不一。与美国相比,亚洲人群中NIFTP在PTC中的比例低许多,来自我国山东和无锡的数据表明,该比例仅为0.3%[22,23],因此新版TBSRTC的风险度估测是否适用于我国,很有研究的必要。(2)目前确诊NIFTP主要依赖术后病理而非FNA细胞病理,即NIFTP和甲状腺癌一样,是手术干预为主的疾病,因此,即便细胞病理不能准确区分NIFTP和甲状腺癌,实际上并不影响是否手术的决策。
新版TBSRTC对AUS/FLUS结节的处理意见,除了既往重复穿刺的推荐外,结合分子检测的发展和NIFTP的确诊需求,增加了分子标记物检测和甲状腺腺叶切除(需结合影像学,无明确浸润者不推荐直接行手术治疗)两条选择;并且强调要结合所有临床、影像、细胞病理和分子检测等资料,充分和患者做沟通,做出个体化评估和选择后续处理方案。
对这一类别的界定标准中,旧版TBSRTC指出"具有PTC细胞核特征的样本不属于本类别"。但是,因为NIFTP可以具有乳头状细胞核特征,因此新版将界定标准修改为"只要没有真乳头和核内包涵体,伴有轻度细胞核改变[细胞核增大、细胞核轮廓不规则和(或)透明染色质]的滤泡样细胞样本可被划入FN/SFN类别;在细胞病理学报告中,可注明某些细胞核特征增加了滤泡变异型PTC或NIFTP的可能性"。
与Bethesda Ⅲ类相似,结合新的文献报告和NIFTP的影响[13,14,15,24,25],FN/SFN的恶性风险度调整为25%~40%(仍将NIFTP视作癌)和10%~40%(将NIFTP从癌中剔除)。值得关注的是,我国江苏[16]和山东[17]学者进行的单中心资料总结中,对应数据分别为67%和76%,远高于这一估测值,其中原因值得深入分析。
诊断性腺叶切除术一直以来是Bethesda Ⅳ类结节的推荐处理方式。随着分子诊断技术的进步,ATA最新指南提出可对此类结节进行分子标记物检测[26],新版TBSRTC也采纳了ATA指南的推荐。笔者认为,在美国已有多家商业化分子标记物检测,并有研究支持其有效性和花费效益比,但分子标记物在中国的推广和应用还需考虑检测提供方资质、诊断效能和卫生经济学等问题。
在仍将NIFTP视作癌的情况下,新版TBSRTC对此类别结节的恶性风险度由之前的60%~75%调整为50%~75%。如果将NIFTP从癌中剔除,有此类细胞病理学诊断的结节恶性风险降至45%~60%。
为了避免在细胞病理学上将NIFTP误报为恶性肿瘤,新版TBSRTC提出,此类别诊断仅限用于那些有典型PTC细胞学特征的病例(真乳头、砂砾体、细胞核假包涵体)[27]。由于NIFTP细胞病理学上主要表现为Bethesda Ⅲ、Ⅳ、Ⅴ类,所以对于Bethesda Ⅵ类结节的恶性风险度,NIFTP的影响不大,仅从97%~99%轻度下落至94%~96%。但是和旧版明显不同的是,在对此类结节处理方式的推荐上,新版TBSRTC将唯一的甲状腺全切选项更新为甲状腺全切或腺叶切除。这样的更新,主要是基于ATA最新甲状腺癌诊治指南中,对甲状腺癌的术式推荐进行了调整,允许对低危甲状腺癌(<4 cm、不伴有甲状腺外侵袭,并且没有局部淋巴结转移证据)仅行腺叶切除[26]。
综上所述,新版TBSRTC捕捉了近年来甲状腺细胞病理学和分子标记物诊断等领域的研究动态,体现了ATA甲状腺癌指南修订和NIFTP概念出现后引发的相应变化。甲状腺细胞病理学诊断对诊治甲状腺结节至关重要,且花费少、效能高,但在我国各级医疗机构,TBSRTC的应用还未普及,高质量的数据资料也凤毛麟角,对临床的指导意义尚未充分发挥。借着新版TBSRTC推出的东风,希望更多同仁能够与时俱进地提高对TBSRTC的认识,踏实、规范地开展甲状腺细胞病理学诊断,认真积累、总结我国人群的细胞病理学数据,为实现甲状腺结节的合理诊治提供坚实可靠的基础。































