
探讨多系统萎缩(multiple system atrophy)合并抗利尿激素不适当分泌综合征(syndrome of inappropriate antidiuresis, SIAD)患者的临床特征。回顾性分析本院收治的1例多系统萎缩合并SIAD患者的临床特征及诊治经过。多系统萎缩C型(小脑型)患者,以发热就诊,查有肺部及泌尿系感染。存在持续性等血容量性低钠血症,血渗透压减低、尿钠增高,甲状腺及肾上腺功能无异常,诊断SIAD。肺部及泌尿系感染治愈后发热及SIAD持续存在。患者无汗,体温随室温变化,考虑体温调节中枢受损。经限水治疗,血钠回升至正常低限。结合患者SIAD病程,与感染的相关性,以及患者共存的体温调节受损,考虑SIAD由多系统萎缩导致。尽管多系统萎缩合并SIAD罕见,对多系统萎缩患者水钠平衡仍需关注,而对于多系统萎缩合并肺部感染的患者尤需警惕,须加强水电平衡的管理。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男性,53岁,因"持续发热1个月,腹胀1周"入院。1个月前无明显诱因体温渐升并维持于38℃左右,无其他不适,自服罗红霉素、莫西沙星无好转。于当地医院查白细胞、中性粒细胞、降钙素原均未见明显异常,尿培养提示大肠埃希菌感染,先后给予"左氧氟沙星、阿米卡星、头孢哌酮钠舒巴坦钠、庆大霉素"等抗感染治疗,体温无明显改善,复查尿培养提示念珠菌、真菌感染;胸部计算机断层扫描(CT)示两肺炎症伴右肺下叶局部肺不张,左侧局部胸膜增厚粘连,且近1周来逐渐出现腹胀,无腹痛腹泻、恶心呕吐。治疗上加用抗真菌治疗,体温无下降,最高可达39℃。为求进一步诊治入住本院传染科。既往因性功能减退6年,行走不稳,醉酒状,步基增宽,尿失禁频繁2年,于外院确诊"多系统萎缩",且因"尿潴留"留置尿管。1年前因行走不稳伴头晕不适摔倒致"右侧股骨颈骨折"行手术治疗,术后长期卧床,手术住院期间查电解质提示血钠偏低,给予补钠等对症治疗,院外未监血钠水平,余无特殊。
入院体格检查:体温38.2℃,心率98次/min,血压152/98 mmHg(1 mmHg=0.133 kPa,较既往偏高),神志清,精神可。平车入病房,自主体位,面容无异常,皮肤黏膜颜色正常,皮肤弹性正常。双肺呼吸音粗,双下肺可闻及散在湿性啰音,心、腹未及明显异常,双下肢不肿。神经系统:双眼球无突出,无震颤,无眼球活动受限;角膜透明,角膜反射存在,双侧瞳孔等大等圆,直径约3 mm,对光反射灵敏,辐辏反射正常;听力粗测正常;鼻唇沟对称,伸舌居中,无震颤,口角流涎,声音嘶哑,饮水呛咳;颈项运动自如,无颈抵抗,左上肢肌力2级,右上肢肌力4级,双下肢肌力3级,双侧膝、跟腱反射亢进,双侧Babinski征(+),双侧Rossolimo征(+),扑翼样震颤阴性,左足踝阵挛阳性,左右侧指鼻试验欠稳准,左右侧轮替试验灵活,左右侧跟膝胫实验欠稳准,Romberg征加强实验睁闭眼(+)。入院诊断为发热原因待查、肺部感染、泌尿系感染、多系统萎缩。
入院后先后给予哌拉西林他唑巴坦、莫西沙星抗感染治疗,复查胸部CT感染明显改善,尿培养转阴后体温仍持续增高。监测降钙素原阴性。完善结核菌素试验、结核感染T淋巴细胞检测、结核抗体、真菌检查、呼吸道病毒[嗜肺军团菌、肺炎支原体免疫球蛋白M(immunoglobulin M, IGM)、肺炎衣原体IGM、腺病毒抗体IGM、呼吸道合胞病毒、流感病毒A型、流感病毒B型、副流感病毒抗体IGM]、一组病原微生物包括弓形虫、其他感染性病原体、风疹病毒、巨细胞病毒、单纯疱疹病毒十项检查(弓形体抗体IGM/IgG、风疹病毒抗体IGM/IgG、巨细胞病毒抗体IGM/IgG、单纯疱疹病毒抗体I型IGM/IgG、单纯疱疹病毒抗体II型IGM/IgG)、EB病毒、巨细胞病毒等均阴性。多次复查血、痰、尿细菌及真菌培养均为阴性。脑脊液常规、生化检查未见显著异常,细菌及真菌培养涂片及培养亦为阴性。追问病史,补诉1年余来无汗,体温随环境温度变化。结合患者头颅磁共振成像(MRI)可见脑萎缩、桥脑+字征等表现(图1)。查阅患者既往外院病历,既往立卧位试验示卧位血压129/79 mmHg、心率68次/min,坐位血压99/74 mmHg、心率92次/min。尿流动力学检查:膀胱逼尿肌收缩力弱,尿潴留,充盈性尿失禁,头颅MRI:脑萎缩改变,桥脑可见+字征,肌电图:双下肢颈神经H反射,右下肢F波未见异常,双上肢皮肤交感反应(SSR)潜伏期正常,波幅明显降低,双下肢SSR未引出肯定波形;双下肢体感诱发电位:双下肢H8潜伏期延长,右侧皮层波形分化不良。据Gilman等[1]提出的诊断标准,符合多系统萎缩C型(小脑共济失调为主型)。经影像科、神经内科会诊,考虑多系统萎缩累及下丘脑,导致体温调节中枢受损。调节室内温度后患者体温渐回降至37.5℃,入院第8日关闭室内暖气后体温进一步降至37℃(图2A)。
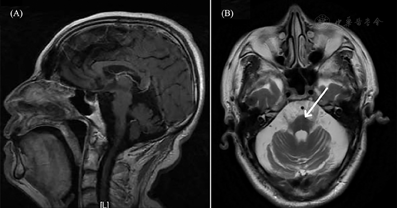

注:(A)矢状位T1加权成像中脑、脑桥、延髓以及下丘脑萎缩;(B)轴位T2加权成像脑桥"十字征"(箭头所指)、T2加权像四脑室扩大
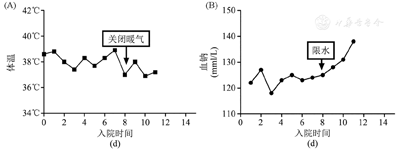

患者入院1周,持续低钠血症(122 mmol/L左右;参考范围135~145 mmol/L,下同),经口服及静脉补钠治疗无明显好转(图2B)。而患者无脱水体貌,实验室检查无血钠浓缩表现,排除脑耗盐综合征等低容量性低钠血症;同时患者无水肿,排除心衰、肾衰、肝硬化等高容量性低钠血症,考虑患者低钠血症为等容性。入院后监测血压较院外增高,结合患者低血浆渗透压(257.89 mOsm/L)、高尿渗透压(945.34 mOsm/L)、低血钠(122 mmol/L左右) 、高尿钠(209 mmol/L),完善甲状腺功能、皮质醇节律、ATCH等测定均未见显著异常,考虑抗利尿激素不适当分泌综合征(syndrome of inappropriate antidiuresis, SIAD)[2]。完善肿瘤标志物监测,各项指标未见异常,胸腹部CT,颅脑MRI未见占位性病变。经限水、补钠治疗后,血钠水平逐渐恢复正常(图2B)。
继续观察3 d后出院,出院时患者体温37.5℃左右,血钠135 mmol/L。出院后院外电话随访半年,外院复查胸部CT示炎症完全吸收,多次查尿常规及尿培养均为阴性。体温仍随环境温度变化波动于38℃上下。坚持限水(每日入量约1 500 ml,尿量2 000 ml)、补钠(每日口服盐胶囊2粒/次,3次/d,每粒盐胶囊约含1g Na)时血钠水平在正常值下限。曾数天未限水,血钠降至120 mmol/L,恢复限水后回升至130 mmol/L左右,一般状况尚可。
SIAD是临床低钠血症的常见病因之一,由于内源性抗利尿激素分泌异常增多或活性增加导致[3]。常见病因包括肿瘤(尤其肺部及纵隔肿瘤)、中枢神经系统异常、药物、肺部疾病等。其中中枢神经系统异常大致可分为占位性病变(肿瘤、颅内脓肿、蛛网膜下腔出血等)、炎症性改变(脑炎、脑膜炎、系统性红斑、急性间歇性卟啉病等)、退行性/脱髓鞘疾病(吉兰巴林综合征、脊髓病变、多发性硬化等),而蛛网膜下腔出血、外伤性脑损伤、急性精神病、脑水肿、垂体柄离断、经蝶鞍腺垂体手术、血管炎、脑血管意外、海绵窦血栓等也可引起SIAD[4]。引起SIAD的感染性肺部疾病主要包括急性病毒或细菌感染、结核、曲霉菌感染、脓胸等,而急性呼吸衰竭、慢性阻塞性肺疾病、正压通气等情况也可引起SIAD。SIAD的诊断目前认为需满足:(1)低血渗透压(<275 mOsm/kg);(2)高尿渗透压(尿渗透性>100 mOsm/ kg);(3)高尿钠(尿钠>30 mmol/L;(4)液体容量为等容量,且无水肿及皮肤黏膜失水征象;(5)排除甲状腺功能减退、继发性肾上腺功能不全等[5]。
多系统萎缩是一组进行性神经系统变性疾病,其病因尚未明确,目前认为是一种少突胶质细胞α-突触核蛋白病,其病理特征为少突胶质细胞胞质内包涵体形成及其内α-突触核蛋白的异常积聚[6]。多系统萎缩主要累及自主神经、锥体外系和小脑三大系统,临床表现为小脑共济失调、帕金森病、自主神经功能障碍及锥体束症状的不同组合。根据Gilman等[1]在2008年修订的诊断标准,多系统萎缩可分为C型(小脑共济失调为主)和P型(帕金森综合征为主)2个亚型。
SIAD合并多系统萎缩相关报告相对罕见,1992年Nagumo等首次报告了SIAD伴Shy-Drager氏直立性低血压综合征(SDS)案例。随后Samukawa等[7]报告了7例相似病例,迄今相关报告仍很少见。在我国,北京协和医院曾报道3例多系统萎缩合并SIAD患者,其中1例考虑为多系统萎缩所致,患者2个月后死亡;2例合并感染,其中1例随其肺部治愈后SIAD得到缓解,考虑其肺部感染为其病因,而另1例经积极抗感染仍存在较长时间低钠血症,考虑多系统萎缩为其参与因素[8]。SIAD常见病因包括肿瘤、中枢神经系统异常、药物、肺部疾病等。本例患者,无恶性肿瘤相关表现,肿瘤标志物各项指标未见异常,胸腹部CT、颅脑MRI未见占位性病变,除外恶性肿瘤所致的SIAD;院外及住院期间未服用可致SIAD的药物,除外药物引起SIAD;而在颅脑疾患中,患者无颅脑外伤、脑血管意外、脑水肿、脑膜炎及精神方面疾病;故结合其多系统萎缩病史,其病因学鉴别主要在多系统萎缩和肺部感染间进行。肺部感染治愈后SIAD持续存在,且肺部感染所致SIAD病程较短(2~5 d)[4]。本例患者肺部感染治愈及随访半年期间SIAD持续存在,结合颅脑MRI及患者体温调节中枢受损,考虑为多系统萎缩累及丘脑,导致SIAD。而文献报道(不包括本研究)的多系统萎缩合并SIAD的4例患者中,3例患者合并肺部感染,故考虑肺部感染可能为多系统萎缩患者发生SIAD的易感因素。既往文献报道(包括此文)的多系统萎缩合并SIAD患者临床特征总结见表1。
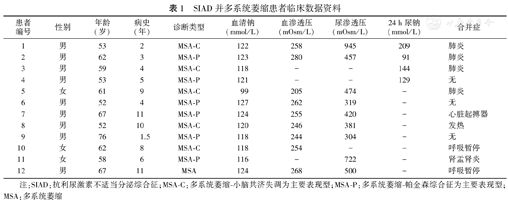
SIAD并多系统萎缩患者临床数据资料
SIAD并多系统萎缩患者临床数据资料
| 患者编号 | 性别 | 年龄(岁) | 病史(年) | 诊断类型 | 血清钠(mmol/L) | 血渗透压(mOsm/L) | 尿渗透压(mOsm/L) | 24 h尿钠(mmol/L) | 合并症 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 男 | 53 | 2 | MSA-C | 122 | 258 | 945 | 209 | 肺炎 |
| 2 | 男 | 62 | 3 | MSA-P | 123 | 280 | 457 | 91 | 肺炎 |
| 3 | 男 | 59 | 4 | MSA-C | 118 | - | - | 144 | 肺炎 |
| 4 | 男 | 53 | 5 | MSA-P | 121 | - | - | 129 | 无 |
| 5 | 女 | 61 | 9 | MSA-C | 99 | 205 | 474 | - | 肺炎 |
| 6 | 男 | 52 | 4 | MSA-P | 127 | 262 | 319 | - | 无 |
| 7 | 男 | 67 | 11 | MSA-P | 124 | 255 | 420 | - | 心脏起搏器 |
| 8 | 男 | 52 | 10 | MSA-C | 120 | 246 | 381 | - | 发热 |
| 9 | 男 | 76 | 1.5 | MSA-P | 118 | 244 | 304 | - | 无 |
| 10 | 女 | 62 | 8 | MSA-C | 118 | 254 | - | - | 呼吸暂停 |
| 11 | 女 | 58 | 6 | MSA-P | 116 | - | 722 | - | 肾盂肾炎 |
| 12 | 男 | 67 | 11 | MSA | 124 | 268 | 500 | - | 呼吸暂停 |
注:SIAD:抗利尿激素不适当分泌综合征;MSA-C:多系统萎缩-小脑共济失调为主要表现型;MSA-P:多系统萎缩-帕金森综合征为主要表现型;MSA:多系统萎缩
多系统萎缩导致SIAD具体机制尚不明确,Sone等[9]通过对1例SIAD伴SDS患者的观察中发现,在给予水负荷及倾斜试验后血清中精氨酸加压素(AVP)浓度无明显变化,提示AVP的低应答反应,考虑可能与脑干对下丘脑的传入刺激减弱有关,从而导致下丘脑抗利尿激素能神经元超敏化,引起抗利尿激素分泌增多。也有相关研究认为SIAD是由于下丘脑细胞受损导致抗利尿激素释放增加所致,该型多见于颅内感染、颅脑损伤等,在感染控制及损伤修复后症状即得到改善。Penney等[10]认为SIAD可能与下丘脑渗透压调定点重置有关,最终导致血清抗利尿激素浓度过高。目前,针对SIAD的治疗主要包括针对SIAD本身的治疗对以及针对原发病的治疗。各指南仍将限水治疗定为SIAD的一线治疗,其他治疗包括地美环素、尿素、加压素拮抗剂托伐普坦等。而国内外关于多系统萎缩的治疗仍缺乏有效措施,主要为对症治疗[11]。Lee等[12]采用血管灌输间充质干细胞治疗多系统萎缩,延缓了疾病进展,取得一定疗效,但是该疗法所导致的无症状出血使得这一治疗存在争议。
SIAD被报道与包括小细胞癌、肝细胞癌、恶性胸膜间皮瘤等多种恶性肿瘤的不良预后相关,而其是否与其他疾病的转归具有相关性尚不明确[4]。在协和报道病例,患者死亡前2年出现SIAD所致顽固性低钠血症,故作者推测SAID出现可能提示多系统萎缩预后不良。本例患者仍在随访中。
综上,尽管多系统萎缩合并SIAD罕见,对多系统萎缩患者水钠平衡仍需关注,而对于多系统萎缩合并肺部感染的患者尤须警惕,须加强水电平衡的管理。
作者声明不存在利益冲突



























