
胰岛素瘤是一种罕见的来源于胰岛β细胞的神经内分泌肿瘤,临床表现为反复发作的低血糖症,典型的Whipple三联征。2型糖尿病合并胰岛素瘤的情况更为稀少,临床上糖尿病患者的低血糖症状通常被考虑为由降糖药物引发,故而胰岛素瘤这一诊断容易被忽略。本文报道1例2型糖尿病患者在确诊糖尿病前已反复出现低血糖症14年,而且在暂停降糖治疗后仍有低血糖表现并伴有高胰岛素血症,胰腺影像学和术后病理支持胰岛素瘤诊断,术后患者血糖水平升高,继续糖尿病治疗。该例患者同时出现胰岛素瘤与2型糖尿病的原因可能与胰岛素瘤所引起的长期高胰岛素血症诱发的胰岛素抵抗有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女性,69岁,因"反复心慌冷汗14年,加重伴口干多饮多尿1年"于2017年4月20日收住本院内分泌代谢科。患者14年前无诱因出现心慌、出冷汗后昏迷,口吐白沫、意识丧失、两眼球上翻,测血糖2.1 mmol/L,至地段医院抢救,予以静脉滴注葡萄糖后意识迅速恢复,复测血糖6 mmol/L,病情稳定后出院,诊断不详,未予特殊治疗措施。出院后仍有无诱因下心慌、出冷汗反复发作4次,多于凌晨发作,进食饼干、糖果后症状迅速缓解,未就诊。2016年出现口干、多饮、多尿,无体重减轻,于当地医院就诊,查空腹血糖2~3 mmol/L、餐后2 h血糖13~14 mmol/L,完善检查后诊断为"2型糖尿病",予磺酰脲类药物治疗(具体不详),口干、多饮、多尿症状稍有好转,出院后规律服药,未监测血糖。2016年11月起患者心慌,出冷汗较前发作频繁,几乎每日凌晨均感上述症状,进食后可缓解,且有记忆力减退,站立不稳,偶有回家迷路,入院随机血糖4.1 mmol/L。患者否认高血压病、慢性肝肾疾病史,无甲状腺功能亢进、甲状腺功能减退史及长期服用糖皮质激素史。
体格检查:身高165 cm,体重73 kg,腰围96 cm,臀围113 cm,体重指数26.8 kg/m2,血压130/70 mmHg(1 mmHg=0.133 kPa)。皮肤无黄染,头颅无畸形;胸廓无畸形,无压痛,触觉语颤对称,叩诊清音;腹软,无压痛,肝脾肋下未及,肝肾区无叩击痛。无胫前斑,针刺觉、音叉震动觉、触痛温度双侧正常。膝反射、踝反射双侧正常,双侧足背动脉搏动正常。无足部溃疡。辅助检查:空腹血糖2.70 mmol/L、餐后2 h血糖10.80 mmol/L、HbA1C 6.50%;游离三碘甲状腺原氨酸(FT3)4.74 pmol/L(参考范围3.10~6.80 pmol/L,下同)、游离甲状腺素(FT4)17.87 pmol/L(12.00~22.00 pmol/L)、促甲状腺激素(TSH)1.79 mU/L(0.27~4.20 mU/L)、甲状腺球蛋白抗体<10 U/ml(0~115.0 U/ml),甲状腺过氧化物酶抗体9.64 U/ml(0~35.0 U/ml)。皮质醇0∶00 am为25.27 μg/dl(7∶00~10∶00 am为6.2~19.4 μg/dl,4∶00~8∶00 pm为2.3~11.9 μg/dl),胰岛素抗体(-)。甲状腺B超提示左侧甲状腺结节,肾上腺超声、垂体核磁共振成像(MRI)增强未见明显异常。胰腺动态电子计算机断层扫描(CT)增强提示胰头钩突区见小结节影,直径约12 mm,边界清,增强后见明显持续性强化,结合临床考虑诊断为"胰岛素瘤"(图1)。术前动态血糖监测(CGMS)提示午餐、晚餐后有低血糖发生,最低3.7 mmol/L(图2A)。
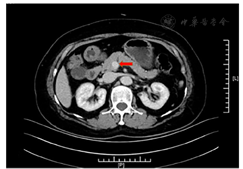

注:红色箭头所指,胰头钩突区小结节影
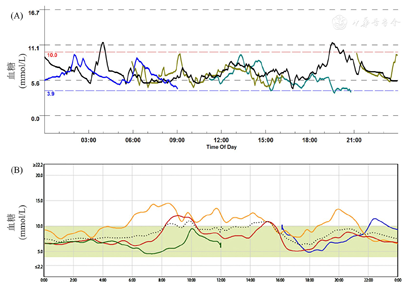

注:(A)术前;(B)术后;CGMS:动态血糖监测
诊疗经过:患者入院前已停用磺脲类降糖药物,入院后经完善相关检查,其肝肾功能、甲状腺功能均未见异常,但仍有低血糖发作,在其低血糖发作时测得胰岛素、C肽水平较高,胰岛素释放指数较高,提示存在高胰岛素血症,考虑"胰岛素瘤"可能。治疗上及时处理低血糖并转入外科行胰腺肿瘤切除术,病理检查结果为胰腺钩突G1级神经内分泌肿瘤。免疫组化结果:Ki67(2%+)、Syn(+)、CgA(部分+)、CD56(+)、胰岛素(+)、胰升糖素(-)、生长抑素(部分+)、5-HT(-)、ACTH(-)。支持"胰岛β细胞瘤"。术后患者未再有低血糖发作表现,定期随访,血糖水平明显升高。2017年9月门诊随访,空腹血糖7.80 mmol/L、餐后2 h血糖11.25 mmol/L左右;2017年11月门诊随访,空腹血糖7.50 mmol/L、餐后2 h血糖12.81 mmol/L;2018年3月住院随访,血糖波动于餐前5.9~10.5 mmol/L、餐后6.2~11.5 mmol/L,予阿卡波糖50 mg tid控制血糖。术后CGMS提示未出现低血糖状态(图2B)。手术前后血糖、胰岛素、C肽检测结果比较见表1,可见术后空腹血糖较术前升高,空腹胰岛素及空腹C肽较术前降低。
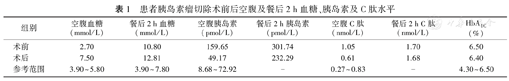
患者胰岛素瘤切除术前后空腹及餐后2 h血糖、胰岛素及C肽水平
患者胰岛素瘤切除术前后空腹及餐后2 h血糖、胰岛素及C肽水平
| 组别 | 空腹血糖(mmol/L) | 餐后2 h血糖(mmol/L) | 空腹胰岛素(pmol/L) | 餐后2 h胰岛素(pmol/L) | 空腹C肽(nmol/L) | 餐后2 h C肽(nmol/L) | HbA1C (%) |
|---|---|---|---|---|---|---|---|
| 术前 | 2.70 | 10.80 | 159.65 | 301.74 | 1.05 | 1.70 | 6.50 |
| 术后 | 7.50 | 12.81 | 49.17 | 232.29 | 0.61 | 1.68 | 6.40 |
| 参考范围 | 3.90~5.80 | 3.90~7.80 | 8.68~72.92 | - | 0.27~0.83 | - | 4.30~6.50 |
胰岛素瘤是一种临床上罕见的来源于胰岛β细胞的神经内分泌肿瘤,90%的胰岛素瘤是良性肿瘤,多位于胰腺之内,胰头、胰体、胰尾分布概率几乎相同。90%的胰岛素瘤为单发,肿瘤直径多<2 cm,5%~10%的肿瘤与多发性内分泌腺瘤病1型(MEN-1)相关[1,2]。胰岛素瘤的临床特点是反复发作的Whipple三联征,包括低血糖症状、发作时血糖低于2.8 mmol/L、供糖后低血糖症状能迅速缓解;发作时的生化指标提示内源性高胰岛素血症。与糖尿病伴发的胰岛素瘤罕见,美国梅奥诊所的一项回顾了1927年至1992年间313例胰岛素瘤患者的研究中,仅有1例同时患有糖尿病[3]。国内外的文献中对糖尿病伴发胰岛素瘤的病例报道也较少[4,5,6]。其机制可能与胰岛素瘤所引发的长期慢性高胰岛素血症诱导进食增加及胰岛素抵抗有关[7]。本例患者以低血糖为首发症状,并在14年内反复发作,但并未明确病因。由于其2016年起接受糖尿病治疗,之后低血糖症表现更为频繁并伴有认知功能下降,因此首先还是需考虑糖尿病用药的原因,当时采用了磺脲类药物可能进一步加重了低血糖的发生。后来尽管停用了磺脲类药物,但仍然反复出现低血糖症并伴有高胰岛素血症,胰岛素释放指数>0.4,在排除了肝肾功能不全等其他器质性疾病的基础上,考虑胰岛素瘤可能性大,后行胰腺动态增强CT,发现胰头钩突区结节灶,证实存在胰岛素瘤。手术后低血糖症状迅速消失,血糖波动亦减少。
胰岛素瘤与2型糖尿病这两种效应相悖的内分泌疾患一同出现的原因,可能与长期慢性的高胰岛素血症所诱发的胰岛素抵抗有关。调节相关组织对胰岛素敏感性的一项重要的分子机制在于通过抑制胰岛素受体酪氨酸激酶活性以调控其自身磷酸化过程[8]。有研究表明,大鼠肝细胞长时间(120 min)暴露在高胰岛素环境下,可诱导胰岛素受体酪氨酸激酶结构域构象变化,从而引起胰岛素受体磷酸化水平下调,进一步实验发现,这些变化即使是在将胰岛素刺激撤除了180 min之后仍持续存在,提示这些胰岛素受体结构域的变化可能具有长期性或"记忆效应"[9]。动物实验发现,给糖耐量正常的小鼠注射过量的甘精胰岛素8周亦可诱发胰岛素抵抗与2型糖尿病[10]。
通过分析回顾此病例的诊治经过,得出以下启示:(1)对于糖尿病患者出现低血糖症尤其是空腹低血糖时,不仅要考虑常见的降糖药物因素,也要考虑一些造成内源性胰岛素分泌过多或者胰岛素拮抗激素缺乏的疾病;(2)应注意患者2型糖尿病诊断时间与低血糖发生的时间顺序,该患者在2型糖尿病诊断前有多年空腹低血糖史,对胰岛素瘤有强烈提示;(3)该患者术前HbA1C尽管在理想范围,但这是长时程低血糖拉低的结果,不能据此认为治疗效果满意;(4)当确诊为胰岛素瘤时,及时联合外科手术切除,这对于改善患者认知功能及远期生活质量意义很重要。
所有作者均声明不存在利益冲突



























