
肝脏是调节体内脂类代谢最重要的器官之一。肝脂肪变性是代谢综合征的主要表现,与脂类物质合成和分解之间的不平衡有关。脂肪肝的患病率存在性别和年龄差异,提示性激素在其中起着至关重要的作用。本文总结了目前有关雌激素和雄激素通过雌激素受体和雄激素受体来调控肝脏脂类代谢机制的文献。于雌性而言,雌二醇与雌激素受体结合降低肝脏脂肪生成及脂肪酸摄取,同时增强脂肪分解和胆固醇分泌。在雄性体内,睾丸激素通过雄激素受体减少脂肪生成并促进脂肪分解。这些研究结果表明,性激素及其受体可以作为预防肝脂肪变性的潜在靶标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脂类是脂肪和类脂的总称,其中脂肪又称甘油三酯或三酰甘油,类脂包括磷脂、胆固醇、胆固醇酯和糖脂等。肝脏是体内调控脂类生成、过氧化、分解和运输的重要脏器之一,维持机体脂类代谢稳态[1]。脂类代谢异常则伴随脂肪肝、肥胖等代谢综合征风险性增加[2,3]。研究发现,雌激素水平减低的绝经后女性以及雄激素水平减低的老年男性更易罹患代谢综合征相关疾病,表明与年龄和性别密切相关的性激素在脂类代谢中发挥重要调节作用。无论性别如何,两种性激素都以不同的数量级同时存在,关键的生物活性物质分别是雌二醇和睾酮,能通过各自的受体发挥应有的功能。了解性激素如何通过其受体调节机体脂类代谢可以为应用药物研究提供基础。本综述在阐述雌激素和雄激素在维持肝脏脂类稳态的基础上,系统探讨雌激素受体(ER)和雄激素受体(AR)在其中的作用。
分为经典核受体和膜结合受体。前者位于细胞核内,包括ERα和ERβ,后者是膜性受体,包括经典核受体的膜性成分以及属于G蛋白偶联受体(GPER)家族的GPER1(GPR30)、Gaq-ER和ER-X[4]。所有这些ER亚型都可表达于人类和啮齿类动物的肝脏,但与生殖器官如子宫、前列腺、睾丸、卵巢和乳腺的ER量相比水平较低。
核受体ERs有6个结构区域A~F。A/B区具有1个非配体依赖的转录激活区(AF-1),该功能区不依赖配体即雌激素的激活,可能参与了调节雌激素与受体的结合以调节雌激素应答基因的转录。C区为DNA结合域(DNA binding domain, DBD),含有相同的外显子。该区含有1个双锌指结构,2个锌指结构协同作用,共同调节此区域与特异DNA的结合,以达到转录靶基因的目的。D区的作用是结合DNA,有时还会影响受体蛋白质的DNA结合位点的结构。E/F区称为配体结合域(ligand binding domain, LBD)。E区作用最多,例如与雌激素的结合、受体二聚化、核定位及与辅助激活因子或辅助抑制因子的结合等。同时,E区还包含有另外1个依赖配体的转录激活区(AF-2),AF-2遇到不同的雌激素会呈现出不同的构像,并决定转录靶基因所需要结合的辅助激活因子和辅助抑制因子。ERβ的AF-1功能微弱而AF-2与ERα的AF-2相似,即转录基因需要AF-1和AF-2时ERβ的功能较ERα弱;在不需要AF-1时2种ER的功能相当。AF-1与AF-2的相互配合,能够使转录因子获得最大的转录活性。当DBD与DNA结合后,AF-1即可激活DNA的转录活性,AF-2与LBD相重叠,当AF-2区与雌激素结合后,即可激活DNA的转录。F区功能尚不明朗。D/E/F统称为配体结合区,2种亚型ERs于此区只有53%的相同氨基酸序列,因此2种受体既有共同的配体,也有各自不同的配体。
无激素存在时核受体ERs以多蛋白的抑制性复合体形式存在于靶细胞中。一旦与雌激素结合,则ERs发生同源二聚化,并与靶基因上的雌激素反应元件(EREs)结合,从而顺式激活靶基因调控区的增强子,促进靶基因的转录。利用由激活的ER控制的ERE萤光素酶报告基因小鼠进行实验,发现在4 d的动情周期期间,肝脏ERα的转录活性会变化,且在动情前期达到峰值,提示ERα的转录活性动力学可能由不同浓度的雌激素调控[5,6]。肝脏ERα能够识别不同阶段的循环雌二醇水平并及时调整其转录活性,以适应各个阶段的能量代谢需求。膜结合型ER介导快速的非基因信号,这比经典基因组信号更快,通常涉及活化细胞内第二信使系统,如蛋白激酶A(PKA)、蛋白激酶C(PKC)和丝裂原活化蛋白激酶/细胞外信号调节激酶(MAPK/ERK)[7]。这一机制似乎在外周雌二醇诱导的细胞反应中发挥了最大的作用,如内皮细胞、某些神经区域和胰腺组织中的反应。使用小鼠模型的研究表明,在具有强基因组ER信号的细胞中,非基因信号本身并不能有效地介导反应。而其他方面,包括心血管反应和男性生殖功能,则主要是由非基因信号介导的[8]。
可以表达于人类和啮齿类动物的肝脏,且对性别依赖。成年雄性大鼠的肝脏基底AR表达水平高于成年雌性大鼠约20倍[9]。同性别时AR表达则与年龄有关,青春期前差异微乎其微,青春期后开始增加,到老龄化时又逐渐降低,约22~24月龄大鼠中已几乎检测不到。
AR蛋白由920个氨基酸组成,分子量为110 kDa,分成4个不同的功能结构域,包括N端结构域(N-terminal domain,NTD)、DBD、Hinge结构域(Hinge domain)以及C端LBD[10]。NTD一般参与募集分子伴侣及调控蛋白,进而调控AR的活性,其中2个核受体结合区域可参与AR形成N/C相互作用进而形成二聚体,AR的二聚化是AR入核及其激活所必须的。DBD包含2个锌指结构,第1个锌指结构包含1个P-BOX(AR第577~581位氨基酸,GSCKV)序列,参与识别DNA,与特异性的应答元件结合;第2个锌指结构包含1个D-BOX(AR第596~600位氨基酸,ASRND)序列,参与AR二聚体的形成,稳定AR与DNA结合。Hinge结构域包含有AR的入核序列,参与调控AR的入核,同时还具有重要的磷酸化、乙酰化位点,参与AR转录后修饰。LBD是高度保守的结构域,具有12个保守的α-螺旋结构和2个β-片层结构,参与识别结合雄激素,同时与蛋白稳定性相关。
AR可以被雄激素激活,包括睾酮和5α-双氢睾酮(5α-dihydrotestosterone, 5-DHT)。雄激素作用下,AR发生二聚体化,进入核内通过与DNA上特异的雄激素识别元件(ARE)结合,募集共调节因子,启动靶基因的转录,这样的经典信号通路也称为基因组AR通路[11]。越来越多的研究发现,AR可以在几分钟内快速应答,而这种快速应答不依赖于其细胞核转移,可以激活磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)、MAPK/ERK、酪氨酸蛋白激酶(Src)等基因表达,这种通路被称为非基因组AR通路。
女性绝经前雌二醇主要在卵巢合成,其浓度高于男性约5倍,而绝经后雌二醇主要在外周组织中由睾酮通过芳香化酶转化而来,例如脂肪组织、肾上腺、骨骼、血管内皮和平滑肌,此时雌二醇的浓度与男性的相近(http://www.hemingways.org/GIDinfo/hrt_ref.htm)。流行病学研究显示,成年白人中非酒精性脂肪性肝病(NAFLD)的男、女性患病率分别为42%和24%,男性明显高于女性[12]。与绝经前女性相比,绝经后女性NAFLD的患病率、血浆中低密度脂蛋白胆固醇(LDL-C)水平较高且高密度脂蛋白胆固醇(HDL-C)水平较低,这意味着低雌激素水平会导致肝脏脂类堆积[13]。对绝经后女性应用外源性雌激素可以降低血浆LDL-C和升高HDL-C,促进胆固醇分泌入胆汁[14]。雌性去势(OVX)大鼠模型出现肥胖、肝脏脂肪变性、血清LDL-C和总胆固醇水平升高的现象[15,16]。雌激素替代治疗用于OVX大鼠模型可以使血浆LDL-C和总胆固醇的水平恢复正常。
雄性体内雌激素来源于芳香化酶对睾酮的转化。实验表明,芳香化酶敲除(ArKO)雄性小鼠出现的肝脂肪化可以采用雌激素治疗恢复正常[20]。对雄性去势大鼠采取雌二醇治疗可以降低其肝脏脂肪酸合成和减少脂肪聚积,预防NAFLD。雌二醇可以通过降低脂蛋白脂酶活性,增加激素敏感性脂肪酶和三酰甘油脂肪酶的表达,从而抑制肝脏中脂类生成和摄取,促进脂肪分解[21]。
关于在雄性生物体内雄激素对NAFLD的作用研究,报道不尽一致,既有减缓疾病发生发展的报道,又有促进疾病发展的结论,可能是由于使用了不同的动物模型和各种处理方式[22,23]。Münzker等[24]研究指出,睾酮/5α-DHT的比值对于NAFLD发生发展的意义比睾酮或5α-DHT的浓度更为重要。一项临床研究显示,男性低血清睾酮水平与脂肪肝的发生密切相关[25]。与正常对照小鼠相比,睾丸女性化(Tfm)小鼠血清睾酮水平极低,采用睾酮替代治疗可以减轻高脂饮食喂养下出现的肝脂肪堆积。在靶细胞中,睾酮通过5α-还原酶转化为活性5α-DHT或通过芳香化酶转化为雌二醇。给予5α-还原酶基因敲除小鼠高脂饮食,发现肝脏中参与脂类存储的基因表达上调而脂肪酸氧化相关基因下调。5α-还原酶的抑制剂诱导雄性肥胖Zucker大鼠肝脏脂肪变性[26]。老年男性雄激素水平降低,面临着更高的血脂异常风险,包括血清总胆固醇及LDL-C升高、HDL-C降低,通常用睾酮替代治疗来逆转[27]。
核ERα是肝细胞中最重要的亚型,不管在雄性还是雌性体内,能介导雌激素调节肝脏脂类代谢的平衡。一项关于绝经前中国汉族女性的流行病学调查显示,ERα基因多态性与代谢综合征相关[28]。细胞实验和动物模型的雌激素及其信号通路的研究结果进一步证实了此观点[29]。例如,与野生型雌性小鼠相比,核ERα敲除的MOER小鼠(只保留膜ERα)出现垂体激素分泌异常、脂肪堆积等现象。雄性和雌性小鼠体内的雌二醇可以通过ERα激活肝细胞内LDLR和3-羟基-3-甲基戊二酰辅酶A还原酶基因的表达。ERα抑制小鼠及ERα/ERβ双敲除小鼠均呈现体脂肪和血清总胆固醇水平增加[30]。雌二醇与EREs结合,激活经典的基因组信号通路,还能够增强高密度脂蛋白受体(HDLR)和清道夫受体B族Ⅰ型(SR-BI)基因的表达[31]。膜ERα介导的快速非基因信号通路通过激活磷酸腺苷(AMP)依赖的蛋白激酶(AMPK)产生AMP,抑制调控肝脏脂类合成的关键转录因子——固醇调节元件结合蛋白(SREBP)-1a的核定位,从而下调SREBP靶基因的表达。一定程度上,胰岛细胞的胰岛素分泌也通过膜ERα和膜ERβ作用进行了正向调节。失去这种调节作用可能是绝经后女性发展为糖耐量受损和糖尿病倾向增加的原因之一。对采取了OVX的Zucker糖尿病大鼠(ZDF大鼠)使用ERβ激动剂,可以明显提高肌肉纤维的增长,改善葡萄糖耐受性[32]。高脂饮食喂养的OVX大鼠使用ERβ激动剂可以提升肝脏过氧化物酶体增殖物激活受体(PPAR)-γ表达,从而提升胰岛素敏感性[33]。体内和体外实验发现,ERβ能增加线粒体功能,利用产热的褐色脂肪组织来增加能量消耗[34]。也有文献报道,ERα和ERβ同时缺失在动物模型上出现的表型与仅有ERα缺失基本相似[4]。因此,ERβ信号机制对于脂类代谢作用到底如何有待进一步研究。
除ERα和ERβ外,雌二醇也通过GPER介导的快速非基因信号通路调节肝脏脂类代谢。一项对北欧人群的队列研究发现,携带功能降低的GPER P16L基因变异体的个体其血清LDL-C水平升高[35,36]。高脂饮食的肝GPER敲除雄性小鼠会出现肝脏脂肪堆积和胰岛素抵抗。与野生型小鼠相比,GPER KO雄性小鼠的血清中总胆固醇、三酰甘油含量以及LDL-C水平均显著增加。其中LDL-C水平提高200%左右,而HDL-C水平无明显变化。与观察结果一致,实验组小鼠的肥胖伴随着炎症标志物肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白1(MCP1)、白细胞介素(IL)-1β和IL-6的增加,以及脂联素(ADPN)水平的降低。这些结果均表明GPER在介导雌二醇的脂类代谢过程中起着重要作用,有利于降低LDL-C水平[37]。
绝经期后女性代谢综合征患者AR基因(CAG)n存在多态性,短于健康女性;老年男性代谢综合征患者睾酮、AR水平均低于健康者,这些研究表明了AR在机体脂类代谢过程中的重要性。
正常喂养和高脂饮食喂养的雄性肝脏AR基因敲除小鼠,均表现出脂肪变性和胰岛素抵抗,其机制是通过上调SREBP-1c、乙酰辅酶A羧化酶(ACC)和PPAR-γ来增加脂类合成,同时下调PPAR-α来降低脂肪酸β-氧化[38,39]。ACC是脂肪酸合成相关的酶,可生成丙二酰辅酶A(malonyl-CoA)。肉碱棕榈酰转移酶1(CPT-1)是β-氧化的限速酶。丙二酰辅酶A反过来可以通过对CPT-1变构抑制调节脂肪酸氧化。蛋白酪氨酸磷酸酶1B(PTP1B)是一种蛋白磷酸酶,负向调节胰岛素和瘦素信号通路。磷酚丙酮酸羧激酶(PEPCK)是肝脏葡萄糖生成的主要调节因子和胰岛素信号通路下游的主要靶点。PI3K蛋白参与细胞增殖、分化、凋亡和葡萄糖转运等多种功能的调节。与对照组相比,雄性肝脏AR基因敲除小鼠肝脏中PTP1B表达升高,抑制了PEPCK和PI3K活性,从而影响了瘦素功能,血清中葡萄糖水平上升。载脂蛋白100(ApoB100)是肝细胞中表达的糖蛋白,与极低密度脂蛋白(VLDL)分泌的脂质外流有关[40]。微粒体三酰甘油转移蛋白(MTP)也是VLDL装配和分泌的关键调节因子。高脂饮食喂养的雄性去势小鼠出现肝脏脂肪变性,其ApoB100和MTP蛋白的表达均显著减少。用睾酮替代治疗后,去势组小鼠ApoB100和MTP蛋白水平得到恢复,促进了VLDL装配和脂质分泌,减轻了肝脏脂肪变性的程度[22]。
可见,AR通过介导脂肪酸氧化基因、脂类合成相关基因和脂类转运相关基因的表达及其信号通路来调节肝脏脂类代谢。
代谢综合征及其相关疾病,如肥胖症和糖尿病,增加了全球的健康问题。肝脏是调节脂类代谢平衡的最大器官。脂肪肝是代谢综合征的主要表现之一。雌激素通过其受体调节肝脏脂类代谢,如抑制脂肪生成和促进脂肪分解,抑制胆固醇合成和促进胆固醇移除,其中经典核ERα及其膜形式发挥着重要作用。本研究组前期通过人群研究和动物实验发现雌二醇与ERα结合,通过下调肝脏脂类合成基因硬脂酰辅酶A1(SCD-1)、脂肪酸合酶(FASN)的表达,并且上调酪氨酸磷酸酶(SHP)基因,抑制下游SREBP-1c表达,使肝脏脂类生成减少(资料未发表)。GPER通过非基因信号通路快速调控脂类代谢。ERβ参与脂类代谢的角色和机制,还需要深入研究。雄激素和AR结合能够增加脂肪分解、促进脂肪转运、减少脂肪生成。而有关AR参与亚型、是经典核受体信号通路还是非基因组信号通路仍需探究。在雄性生物体内活性雄激素缺失会导致肝脏脂类代谢异常,而在雌性生物体内雄激素异常增多也会导致肝脏脂肪过度堆积(图1)。因此后续考虑采用Cre/loxP重组酶系统建立组织特异性、细胞特异性和诱导性的AR条件性敲除小鼠来进一步研究雄激素/AR的性别差异作用及机制。
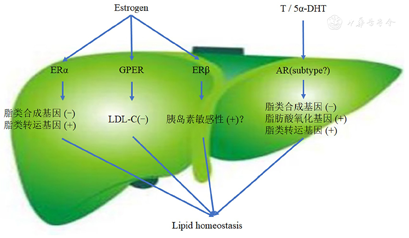

注:Estrogen:雌激素;ERα:雌激素受体α;GPER:G蛋白偶联受体;ERβ:雌激素受体β;LDL-C:低密度脂蛋白胆固醇;T:睾酮;5α-DHT:5α-双氢睾酮;AR:雄激素受体;subtype:亚型;Lipid homeostasis:脂类代谢
总之,性激素如何通过其受体调节机体肝脏脂类代谢,影响肝脏疾病的发生发展,涉及到性别、激素水平、基因缺陷等一系列因素,其机制复杂。继续深入研究,将为今后人类相关疾病的预防、治疗提供新的思路、新的靶点,为个体化差异治疗提供理论和实验依据。
所有作者均声明不存在利益冲突
1.脂肪肝是一种常见的肝脏病理改变,以下哪项对脂肪肝的描述是错误的( )
A.肝内脂肪蓄积超过肝重量的8%或在组织学上肝细胞60%以上有脂肪变性
B.轻度脂肪肝多无明显临床症状,早期诊断并及时治疗常可恢复正常
C.中、重度脂肪肝有类似慢性肝炎的表现,可有食欲不振、疲倦乏力、恶心、呕吐、肝区或右上腹隐痛等
D.肥胖症、脂肪摄入过多、嗜酒、皮质激素应用、脂代谢障碍等都是形成脂肪肝的原因
2.病例摘要:男性,50岁,身高166 cm,体重85 kg,平时偶尔饮酒,量不多,无厌油、纳差等症状。有高血脂病史。现体检提示肝脏右肋下1指,质软,化验示肝功能示丙氨酸转氨酶(ALT)84 U/L,胆红素正常,HBsAg(-)。患者肝功能不良最可能的原因是( )
A.病毒性肝炎 B.药物性肝炎
C.酒精性脂肪肝 D.非酒精性脂肪性肝病
3.有关雌激素及其受体在机体脂肪代谢中的作用,下列说法中不正确的是( )
A.在脂肪组织脂肪代谢调节过程中,雌激素及其受体能影响脂肪细胞分化、促进脂解作用、抑制脂质合成,从而减少脂肪在脂肪组织中的沉积
B.在肝脏脂肪代谢调节过程中,雌激素能改善肝脏代谢,抑制脂质在肝脏中沉积
C.在骨骼肌脂肪代谢调节过程中,雌激素可改善骨骼肌线粒体功能、调节骨骼肌能量供应、改善骨骼肌胰岛素敏感性
D.在下丘脑的调节过程中,雌激素及其受体能够通过影响下丘脑神经元生理活动去调节摄食行为,但不能通过调节下丘脑能量调控相关因子的水平去参与下丘脑能量调节
4.有关雄激素的生理功能,下列说法中不正确的是( )
A.雄激素具有促进雄性器官的生长、精子发生和雄性第二性征的发育以及维持男性性欲等作用
B.雄激素能够调节人体脂肪组织的分布和组成百分比,低雄激素水平会造成男性肥胖、腹部脂肪堆积及其他代谢疾病
C.雄激素有强大的促进蛋白质合成使机体呈氮正平衡的作用,这在青年人表现尤为突出,如促进骨胳肌发育、促进骨胳中钙盐沉着、增加基础代谢、刺激红细胞生成等
D.雄激素可促进RNA聚合酶和氨基酰转移酶,还能促进糖酵解中的己糖激酶、磷酸果糖激酶,也促进线粒体的细胞呼吸酶类,从而供应细胞合成代谢所需要的能量
5.多囊卵巢综合征(PCOS)是育龄期妇女最常见的生殖内分泌性疾病,下列有关PCOS的叙述中不正确的是( )
A.PCOS以月经稀发、高雄激素血症和胰岛素抵抗为主要临床特征,伴发脂类代谢紊乱
B.PCOS患者中,35%~68%合并超重或肥胖,且多为周围型肥胖
C.非酒精性脂肪肝在普通人群中的发病率为6.3%~33%,而在PCOS患者群体中发生率为15%~60%
D.针对PCOS患者的干预措施包括饮食、运动及药物治疗,一线治疗仍为生活方式干预,效果不佳时可联合降糖降脂药物(二甲双胍或他汀类药物)治疗



























