
全世界糖尿病和肥胖等糖脂代谢疾病的患病率在不断升高,而中国人群患病率上升速度尤为迅猛,糖脂代谢疾病已成为我国重大公共卫生问题,一级预防显得尤为迫切。DOHaD(Developmental Origin of Health and Diseases)理论提出生命早期的环境因素如营养会影响某些成人非传染性疾病特别是代谢疾病的发生风险。由于我国经济发展的不平衡,生命周期营养失衡(如生命早期营养不良和成年营养过剩)仍旧是普遍存在的问题。国内外最近有较多学者对饥荒下生命早期营养不良环境和成年后糖脂代谢疾病发生发展的关系进行了多方面和深入的研究,本文对这一领域作一综述,并提出生命早期营养不良成年后营养过剩(两次打击)营养代谢模型。这些研究将为中国、印度等经济快速发展的发展中国家预防糖脂代谢疾病提供科学依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前,中国肥胖、糖尿病、脂肪肝等糖脂代谢疾病的患病率呈逐年上升趋势,降低了国民身体素质的同时,不仅使患者的生活水平下降,也给社会带来了沉重的医疗和经济负担。糖脂代谢病的发生和发展与遗传因素、环境因素以及行为因素等多种因素有关。中国多种代谢性疾病患病率接近甚至超过欧美发达国家却已不能简单地用经济因素单独来解释。近年来,不断有基于DOHaD(Developmental Origin of Health and Diseases)假说的研究发现生命早期的营养状况与成年后糖脂代谢病等慢性疾病的发生存在很大的关联[1,2]。DOHaD假说认为生命早期如胎儿期、新生儿期和儿童期经历营养不良会导致人体代谢和结构改变[3],这种反应可能有利于生命早期的存活,但也会增加成年后患非传染性疾病的风险。因此,生命早期营养不良逐渐被视为后续糖脂代谢疾病发生的重要因素之一。
生命早期营养环境可能与成年肥胖、2型糖尿病和非酒精性脂肪性肝病等存在着千丝万缕的联系。生命早期指的是从受孕开始至2周岁这一时期。由于细胞处于旺盛的分裂、增殖、分化状态,组织、器官也处于开始形成的关键时期,此时的营养状态也影响着机体代谢模式的建立,且这种代谢模式会持续终生,影响儿童期乃至成年期肥胖等代谢性疾病的发生风险[4]。另有研究认为生命早期则纳入了胎儿期和出生的0~9岁(儿童期:体力、行为和认知快速增长和可塑阶段)[5]。
自上个世纪以来,肥胖症已成为一种全球性的流行病,其治疗所造成的经济负担巨大,且容易并发心血管疾病、中风、癌症和糖尿病等多种并发症,严重影响生活质量[6]。对1944至1945年荷兰饥荒人群进行的回顾性流行病学研究是关于生命早期营养对成年肥胖最早的学术资料。该研究发现产前经历饥饿,特别是妊娠后期,与成人肥胖和葡萄糖耐量下降有关。孕妇妊娠期间因经历饥荒而发生生命早期营养不良,成年时发生肥胖和葡萄糖不耐受的危险增加[7]。有学者对国内1959至1961年的3年自然灾害期间出生的人群与灾害前后出生的人群进行流行病学研究,发现早期营养不良增加了女性超重和肥胖的风险。但是无论男性还是女性,早期营养不良的经历都会增加腹部肥胖的风险[8]。内脏肥胖与一般性肥胖相比,它被认为与糖尿病和心血管疾病的关系更为密切[9]。一项包含5 295名受试者的队列研究表明胎儿期和儿童期经历饥荒与成年女性内脏脂肪指数升高(visceral adiposity index, VAI)有关[10],VAI是一种反应内脏脂肪功能的指标。由于早期经历饥荒与成年期肥胖风险的增加存在紧密联系,提示早期预防营养不良可能有助于减少后期肥胖的发病风险。
由于代谢综合征是以肥胖和胰岛素抵抗为核心特征,基于前面的研究,不难想象生命早期营养不良与之的关系。有研究表明儿童中晚期经历饥荒与代谢综合征的风险较高相关,尤其是在农村、男性和严重饥荒地区[11]。还有研究认为是在女性的胎儿期和儿童期经历饥荒导致成年代谢综合征风险更为显著,并且在2014年华东地区流行病学调查中还发现女性代谢综合征的患病率在1959年出生的人群中达到顶峰,并且从1959年至1962年出生的人群中呈现逐渐下降的显著趋势[12]。
国际糖尿病联合会(International Diabetes Federation,IDF)最近的全球估计显示,2017年有4.51亿人患有2型糖尿病;到2045年,这一数字估计将达到6.93亿[13]。中国成年人中糖尿病患病率为11.2%[14],由此可见中国是全球糖尿病流行的中心地带之一。由于中国的快速发展,不健康的生活饮食方式成为了公众所熟知的导致中国2型糖尿病患病率快速增加的原因之一。然而,有研究表明早期营养不良如中国3年自然灾害饥荒可能对成年糖尿病的发生和发展存在着很大的影响[15]。
有研究发现,在胎儿时期经历饥荒的成年个体中,其高血糖而非糖尿病的患病风险显著升高,这可能与调查时间较早而相关人群较为年轻有关[16]。在2014年起,本课题组设计实施中国华东地区代谢性疾病及其危险因素的调查研究(简称SPECT-China研究,注册号ChiCTR-ECS-14005052),发现胎儿期和儿童期经历中国1959至1962年大饥荒(第一次打击)会导致成年后糖尿病风险上升63%和90%,而同时成年后又经历经济快速发展带来的营养过剩(第二次打击)会进一步将糖尿病风险提高56%,因此我们提出了生命周期营养失衡的两次打击学说[17]。这也符合Bhargava等[18]学者的发现,即对成年后糖代谢影响更为严重的情况是生命早期经历饥饿并且儿童期或成年期体重快速增加。进一步在饥荒较轻和严重的代表性地区人群中,通过双重差分模型,发现经历严重程度饥荒较不严重饥荒,胎儿期和儿童期经历饥荒人群较未经历人群的HbA1C分别显著上升0.31%和0.20%,糖尿病风险分别显著升高90%和44%,并且这两个时期经历与饥荒严重程度存在显著交互作用[19]。最新的研究则显示成年后理想的心血管健康指标可以显著改善由于这种经历饥荒而增加的糖尿病风险[20]。这揭示了在经历过胎儿营养不良的个体中,健康的生活方式对于预防2型糖尿病的重要性。近期的孟德尔随机化研究也发现在东亚人群中出生体重(出生体重通常代表宫内营养环境)每下降1个标准差,2型糖尿病风险上升39%[21],进一步证实了以往的发现。
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)已成为我国最常见的慢性肝病。我国成年人非酒精性肝病患病率约为15%[22],有研究预测在2016至2030年期间,非酒精性脂肪肝所导致的死亡率和晚期肝脏疾病将增加1倍以上[23]。非酒精性脂肪肝的发病机制与多靶点理论有关,胰岛素抵抗在非酒精性脂肪肝发病机制中起中心作用[24]。从以上研究得知,由于早期营养不良可能增加成年后胰岛素抵抗,自然也可能增加NAFLD的风险,但是目前该方向的研究并不丰富。
较早的一项涉及该主题的研究是在赫尔辛基出生队列研究中发现儿童早期体型消瘦而成年后肥胖比相应成年不肥胖的人群,其NAFLD评分阳性比例升高了17.5倍[25]。然而与客观诊断工具如超声和自动化成像技术相比,公式法评估NAFLD可能会带来一定程度的诊断不确定性。本课题组发现,在女性中,胎儿期和儿童期经历饥荒营养不良可能是中重度脂肪肝的危险因素;但在男性中,这种相关性不显著[26]。后期的一些中国研究也支持这个观点[27]。
2020年4月在Journal of Hepatology和Gastroenterology发表的国际脂肪肝共识已将NAFLD改为代谢相关脂肪性肝病(metabolic dysfunction-associated fatty liver disease,MAFLD)[28],这可能将使得生命早期营养失衡在MAFLD发病机制中成为一个更为清晰的风险角色。
目前有大量的研究表明生命早期经历饥荒后的结局存在着性别差异,通常在女性中更为明显。在文献中"重男轻女"和生存选择效应是解释这种性别差异的两个可能的主要原因[29]。首先,由于"重男轻女"在当时中国的传统观念中普遍存在,所以在饥荒中女孩所获得的营养支持和资源分配会比男孩少很多,使得女孩更容易受到饥荒的影响[30]。第二,生存选择并非是性别中性的。有研究显示男性在大饥荒等恶劣生存环境中的死亡率更高。男性胎儿生长更迅速,对胎盘提供营养的要求更高,因此更容易被恶劣环境条件影响,大饥荒时期男婴的出生率比例显著下降[30,31]。而在经历过大饥荒的生存选择后,幸存下来的男性可能会更健康。
早在1992年Barker[32]所提出的"胎源假说"便认为当母体摄入营养不足时,胎儿将有限的营养和能源最优化的重新分配,用于重要脏器如脑和肺的发育以保证生存,因而造成肝脏、胰腺及肌肉等的营养不良,这将持续改变机体的生理和代谢。这些适应性改变可通过对基因的表观修饰如DNA甲基化、组蛋白修饰、microRNA等非编码RNA相互作用而导致机体表型发生永久性改变,可导致成年后一些疾病的发生,甚至可遗传给下一代[33]。在产前发育期间经历营养不良的动物模型显示,在解释成年动物表型变异的特定启动子[34]、反转录转座子[35]和印迹区域[36]的DNA甲基化水平上发生了表观遗传变化。与动物一样,早期经历饥荒以后,人基因中调节新陈代谢相关基因的启动子和印迹区域也出现差异DNA甲基化等表观遗传改变[37]。有研究指出差异甲基化与出生体重和血清LDL胆固醇相关,并且影响的通路涉及发育和代谢途径[38]。产前营养不良对表观遗传调节可引起差异性甲基化并在以后的生命中促进不利的代谢表型(如葡萄糖处理不佳、体重指数较高、总胆固醇和低密度脂蛋白胆固醇升高)的发展[39]。生命早期营养不良也可通过microRNA和lncRNA等表观遗传修饰影响成年糖脂代谢异常的风险[40],有研究发现低出生体重和正常出生体重的新生儿其microRNA存在显著差异,特别是miR-454-3p上调,涉及了TGF-beta等多条代谢相关的通路[41]。
然而生长发育中的基因编程是一个复杂的研究模型。表观遗传起源对代谢病理学的脆弱性可能会在后代中表达,也可能不会表达,从前面的流行病学和以下的动物研究可以看出其表达及表型严重程度取决于风险环境的存在与否。
胰岛素不仅是人体内唯一的降血糖激素,同时也是影响胎儿生长的重要因素。生命早期是胰岛结构和功能发育的重要时期,有研究表明生命早期营养不良可导致胰腺结构和血管分布,可以使胰岛β细胞的质量和功能下降,从而影响其胰岛素的分泌功能[42]。胰岛素的分泌还受其他众多激素(如肠促胰素等)的影响。虽然目前还尚未见有直接研究生命早期营养不良是否导致成年后肠促胰素分泌改变,但基于已有研究可以推测生命早期营养不良可能通过改变肠道菌群进而调节肠促胰素[43]。
另一方面生命早期营养不良还能使组织对胰岛素的敏感性降低,发生胰岛素抵抗。从之前的流行病学研究可以看到肥胖、2型糖尿病和NAFLD的共同病生机制均是胰岛素抵抗,可见生命早期营养不良与胰岛素抵抗可能存在比胰岛素分泌更为核心的关系。有动物实验表明生命早期给予50%能量摄入的SD大鼠成年后易发生胰岛素抵抗和高体脂率,特别是生命早期营养不良后期高脂饮食(两次打击)的大鼠其胰岛素抵抗程度甚至显著高于长期高脂组[44]。同时经历两次打击的大鼠极易发生肝脂肪变性,这可能与肝脏中从头脂肪生成的上调和从肌肉到从头脂肪生成的葡萄糖流量的增加有关[44]。通过同位素示踪技术发现生命早期营养不良的大鼠肝糖异生增加和肌肉葡萄糖摄取下降[44]。
因此,结合以往的研究,我们提出了生命早期营养不良成年后营养过剩(两次打击)营养代谢理论和示意图(图1)。健康人能量摄入和消耗处于平衡状态。西方人多见的肥胖胰岛素抵抗,成年营养过剩导致能量摄入增加,超过能量消耗,导致三酰甘油生成超过脂肪储存能力,造成异位脂肪沉积。而经历生命早期营养不良和成年营养过剩(两次打击)后,脂肪储存代谢能力下降,能量摄入增加且超过能量消耗,导致更严重的异位脂肪沉积,造成中国人中较为多见的非肥胖性胰岛素抵抗(BMI相对较低,而内脏肥胖严重)。
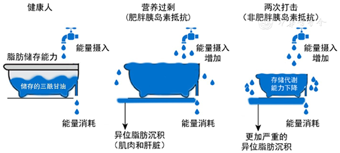

注:健康人群其脂肪储存能力正常,能量摄入正常且与能量消耗大致平衡,三酰甘油的存储没有超过脂肪的储存能力,因此不会发生异位脂肪沉积,也不会有显著的胰岛素抵抗。在没有经历生命早期营养不良但经历成年营养过剩的人群中,其脂肪储存能力正常,能量摄入增加且超过能量消耗,导致三酰甘油的存储超过脂肪储存能力,导致异位脂肪沉积,最终导致肥胖胰岛素抵抗。在经历生命早期营养不良和成年营养过剩(两次打击)的人群中,其脂肪储存代谢能力下降,能量摄入增加且超过能量消耗,导致更严重的异位脂肪沉积,造成非肥胖性胰岛素抵抗,通常表现是BMI较低而内脏肥胖严重
免疫和代谢息息相关,共同影响着疾病的发生与发展。在胆固醇和三羧酸循环的代谢过程中,某些特定的产物对免疫存在影响[45],相反生命早期感染性疾病也可增加糖脂代谢性疾病发生的风险[46]。早期营养失衡通过感染和炎症等免疫途径影响着成年糖脂代谢性疾病的发生,有研究指出炎症记忆与高血糖存在着密切的关系[47],并且这些炎性记忆是受表观遗传调节的[48]。
脂肪组织巨噬细胞可参与导致脂肪组织炎症和胰岛素抵抗。有研究发现经历两次打击之后的大鼠其内脏脂肪组织的单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1,可导致巨噬细胞浸润)表达显著升高,并且即使在生命早期营养不良但成年正常平衡饮食的大鼠中也不能完全缓解这一改变[49]。另一项研究则在内脏脂肪组织巨噬细胞表型方面做了更为细致的研究,发现两次打击模型的CD11c+CD206+脂肪组织巨噬细胞的比例和白介素6水平发生改变[50]。目前直接研究生命早期营养不良与免疫炎症改变的研究尚不多见,尤其在其他主要代谢器官如肝脏和肌肉,意味着可能有广泛的研究前景。
在生命早期随着肠道的发育,人类肠道微生物群经历了一个生态衍替的过程,最终导致了一个相对稳定的复杂群落的建立。早期营养可以参与肠道微生物群形成这一过程,有研究显示肠道微生物群的改变与儿童期炎性疾病风险的增加有关,并会增加肥胖和其他糖脂代谢疾病发生的风险[51]。早期营养失衡会导致新生儿肠道微生物群落的破坏,这被证明与儿童炎症疾病、非酒精性脂肪肝和肥胖风险增加有关[52]。同时早期营养是成年人肠道发育和宿主代谢发育的重要长期因素[53],有动物实验表明早期营养失衡所导致的低出生体重会损害小肠和大肠的发育[54]。通过对肠道发育的影响和肠道菌群的破坏,早期营养失衡增加动物对胃肠功能障碍和脂质代谢综合征的易感性[55],可能会增加成年糖脂代谢疾病发生的风险。
以上研究提示加强公民全生命周期营养教育,以减少胎儿及新生儿营养失衡的发生,降低成年后营养过剩导致的肥胖问题。同时即使在生命早期经历不利的生活因素的情况下,我们也强调成年后健康生活方式在预防糖脂代谢性疾病方面的重要性。这对于人类特别是发展中国家预防代谢性疾病可能具有战略性意义。
所有作者均声明不存在利益冲突



























