
2型糖尿病(type 2 diabetes mellitus, T2DM)与心力衰竭(heart failure, HF)相互影响,T2DM是HF的重要危险因素,两者合并则预后差,死亡率高。本文结合美国心脏病学会(American College of Cardiology, ACC)第70届科学年会相关热点和最新临床试验,从T2DM和HF的流行病学现状、T2DM与HF的关系,T2DM管理的心血管获益及循证证据基础上的指南推荐等多维度探讨HF患者糖尿病管理的重要性及优化管理策略,以期为HF合并糖尿病患者的临床干预提供理论依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
心力衰竭(heart failure, HF)是世界范围内的主要健康负担。全球HF患者超6 400万,发达国家成年人HF患病率约1%~2%[1]。根据中国2019年发表的HF流行病学调查数据,年龄≥35岁居民HF患病率为1.3%,即约有1 370万HF患者,其患病率在过去15年间增加了44%[2]。糖尿病业已成为全球重要的疾病负担之一。国际糖尿病联盟(International Diabetes Federation, IDF)最新数据[3]显示,2019年全球20~79岁成人糖尿病患者约4.63亿,预计至2045年将增加51%(达7.0亿)。T2DM和HF并存的情况常见,T2DM和HF均彼此增加了疾病风险[4,5]。HF患者中糖尿病患病率为10%~47%,住院HF患者糖尿病患病率达40%以上;随访期间,HF患者新发T2DM患病率也显著高于非HF患者[4,5]。中国HF登记研究[6]显示约1/5的HF患者同时患有糖尿病。糖尿病是HF的独立危险因素,糖尿病患者中HF患病率约为9%~22%,比普通人群高4倍,60岁及以上糖尿病患者HF患病率更高[5]。
糖尿病是HF的主要危险因素,T2DM患者基线糖化血红蛋白(HbA1C)每增加1%,HF发生风险增加23%[风险比(hazard ratio,HR)=1.23,95%置信区间(confidence interval,CI)1.10~1.37,P<0.001][7]。除此之外,一项基于英国生物数据库的研究发现糖尿病前期亦增加了HF风险(校正HR=1.07,95%CI 1.01~1.14,P=0.03)[8]。
糖尿病增加HF风险,美国心脏病学会(American College of Cardiology, ACC)大会公布的社区动脉粥样硬化发病危险(atherosclerosis risk in communities, ARIC)研究进一步分析了糖尿病危险因素(如糖尿病发病时间和糖尿病病程)与HF之间的相关性[9]。对纳入的无HF或冠心病患者共9 734例共进行4次随访研究。在前4次ARIC随访时,根据是否合并糖尿病进行分组[访视1(1987年至1989年),访视2(1990年至1992年),访视3(1993年至1995年)和访视4(1996年至1999年)]。在随访超20.5年间,共发生1 878起HF事件;与访视4时无糖尿病患者相比,HF风险随糖尿病诊断时间和糖尿病病程延长而升高,访视1(HR=2.30,95%CI 1.98~2.68)患者和糖尿病病程≥15年(HR=2.85,95%CI 2.25~3.63)的患者HF风险最高。
对于T2DM与HF住院患者全因死亡和HF再住院之间关联性,一项多中心、前瞻性队列研究通过纳入2008年至2011年因失代偿性HF入院患者,随访1年发现合并T2DM的HF患者较非糖尿病患者全因死亡率(HR=1.54,95%CI 1.20~1.97,P=0.001)和HF再住院率显著增加(HR=1.46,95%CI 1.18~1.80,P<0.001)[10]。除此之外,合并糖尿病还增加了住院和门诊HF患者的死亡风险,糖尿病和HF患者的健康相关生活质量也较单纯HF患者差[4]。
糖尿病致HF的确切病理生理机制尚未完全清楚,可能涉及以下机制。(1)高血糖及高胰岛素血症通过血管平滑肌细胞增殖和慢性炎症促进动脉粥样硬化发生,糖尿病还与血脂异常和内皮功能障碍相关,通过增加白细胞和血小板黏附、血栓形成、炎症和冠状动脉斑块溃疡形成,促进动脉粥样硬化发生。(2)糖尿病也可直接引起心肌病发生,即糖尿病性心肌病。高糖条件下糖基化终末产物的产生及胶原分子交联,可导致心肌纤维化及舒张功能受损;钙稳态失衡和内质网损伤也在心肌纤维化和舒张功能中发挥作用。另外,高血糖可激活局部肾素-血管紧张素醛固酮系统,使血管紧张素Ⅱ和醛固酮的过量产生,导致心脏肥大和纤维化,加剧舒张功能障碍[5,11]。
2007年《新英格兰医学杂志》曾发表1篇报告,搜集了相关临床研究文献116篇,对符合其入选标准的42项临床试验分析发现,服用罗格列酮组的T2DM患者心肌梗死风险显著增加[比值比(odds ratio,OR)=1.43,P=0.03],心血管死亡风险亦增加(OR=1.64,P=0.06)[12]。因此2008年美国食品药品监督管理局(FDA)规定降糖新药申办方须提供药物心血管安全性证据[13]。自此,后续所有新药上市前均进行了包括心衰结果在内的心血管结局研究(Cardiovascular Outcome Trial,CVOT)。下面将分别介绍各类降糖药物对心衰的影响。
在RECORD[14]和PROactive[15]研究中,分别随机接受罗格列酮和吡格列酮治疗的患者发生HF事件的风险显著高于安慰剂组。在SAVOR-TIMI 53试验[16]中,接受DPP-4抑制剂沙格列汀治疗的患者,HF住院风险增加(HR=1.27,P=0.007)。基于此,罗格列酮、吡格列酮和沙格列汀禁用于HF患者或有HF风险的患者[3]。
目前,磺酰脲类药物和胰岛素可用于伴有HF的T2DM患者(通常作为二线或三线治疗),但其在HF中的安全性目前仍不确定[3]。其中胰岛素可引起水钠潴留,可能会增加发生HF的风险。而在一项评估甘精胰岛素对糖尿病前期及新发糖尿病患者治疗有效性与安全性的大型国际多中心临床研究中(ORIGIN研究),相比标准治疗组,并未发现两组人群任何心血管结局的差异,包括因心衰住院(hospitalization for heart failure,HHF)[17]。
基于回顾性、非随机化队列研究,发现使用二甲双胍的患者HF死亡率和HF住院率低于胰岛素和磺酰脲类药物[14,18]。多项CVOT也证实胰升糖素样肽1受体激动剂(glucagon-like peptide-1 receptor agonist, GLP-1RA)的使用与多种动脉粥样硬化事件风险降低相关,而对HHF风险则多数呈中性结果[19,20,21,22](表1)。
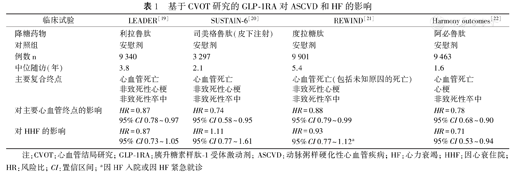
基于CVOT研究的GLP-1RA对ASCVD和HF的影响
基于CVOT研究的GLP-1RA对ASCVD和HF的影响
| 临床试验 | LEADER[19] | SUSTAIN-6[20] | REWIND[21] | Harmony outcomes[22] |
|---|---|---|---|---|
| 降糖药物 | 利拉鲁肽 | 司美格鲁肽(皮下注射) | 度拉糖肽 | 阿必鲁肽 |
| 对照组 | 安慰剂 | 安慰剂 | 安慰剂 | 安慰剂 |
| 例数n | 9 340 | 3 297 | 9 901 | 9 463 |
| 中位随访(年) | 3.8 | 2.1 | 5.4 | 1.6 |
| 主要复合终点 | 心血管死亡 | 心血管死亡 | 心血管死亡(包括未知原因的死亡) | 心血管死亡 |
| 非致死性心梗 | 非致死性心梗 | 非致死性心梗 | 心梗 | |
| 非致死性卒中 | 非致死性卒中 | 非致死性卒中 | 非致死性卒中 | |
| 对主要心血管终点的影响 | HR=0.87 | HR=0.74 | HR=0.88 | HR=0.78 |
| 95%CI 0.78~0.97 | 95%CI 0.58~0.95 | 95%CI 0.79~0.99 | 95%CI 0.68~0.90 | |
| 对HHF的影响 | HR=0.87 | HR=1.11 | HR=0.93 | HR=0.71 |
| 95%CI 0.73~1.05 | 95%CI 0.77~1.61 | 95%CI 0.77~1.12a | 95%CI 0.53~0.94 |
注:CVOT:心血管结局研究;GLP-1RA:胰升糖素样肽-1受体激动剂;ASCVD:动脉粥样硬化性心血管疾病;HF:心力衰竭;HHF:因心衰住院;HR:风险比;CI:置信区间;a因HF入院或因HF紧急就诊
钠-葡萄糖共转运蛋白2抑制剂(sodium-glucose cotransporter-2 inhibitors,SGLT-2i)的多项大型CVOT研究结果显示,SGLT-2i类药物可一致、显著地改善糖尿病患者HF住院风险[23,24,25,26](表2),这与其降糖机制可能无关。除此之外,多项在HF患者中开展的大型研究亦显示了SGLT-2i在改善HF结局方面的优势。
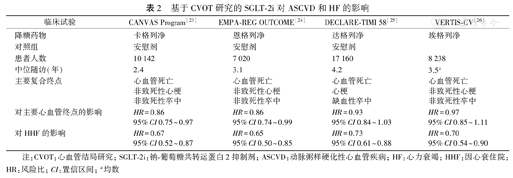
基于CVOT研究的SGLT-2i对ASCVD和HF的影响
基于CVOT研究的SGLT-2i对ASCVD和HF的影响
| 临床试验 | CANVAS Program[23] | EMPA-REG OUTCOME[24] | DECLARE-TIMI 58[25] | VERTIS-CV[26] |
|---|---|---|---|---|
| 降糖药物 | 卡格列净 | 恩格列净 | 达格列净 | 埃格列净 |
| 对照组 | 安慰剂 | 安慰剂 | 安慰剂 | |
| 患者人数 | 10 142 | 7 020 | 17 160 | 8 238 |
| 中位随访(年) | 2.4 | 3.1 | 4.2 | 3.5a |
| 主要复合终点 | 心血管死亡 | 心血管死亡 | 心血管死亡 | 心血管死亡 |
| 非致死性心梗 | 非致死性心梗 | 心梗 | 非致死性心梗 | |
| 非致死性卒中 | 非致死性卒中 | 缺血性卒中 | 非致死性卒中 | |
| 对主要心血管终点的影响 | HR=0.86 | HR=0.86 | HR=0.93 | HR=0.97 |
| 95%CI 0.75~0.97 | 95%CI 0.74~0.99 | 95%CI 0.84~1.03 | 95%CI 0.85~1.11 | |
| 对HHF的影响 | HR=0.67 | HR=0.65 | HR=0.73 | HR=0.70 |
| 95%CI 0.52~0.87 | 95%CI 0.50~0.85 | 95%CI 0.61~0.88 | 95%CI 0.54~0.90 |
注:CVOT:心血管结局研究;SGLT-2i:钠-葡萄糖共转运蛋白2抑制剂;ASCVD:动脉粥样硬化性心血管疾病;HF:心力衰竭;HHF:因心衰住院;HR:风险比;CI:置信区间;a均数
(1) SGLT-2i改善射血分数降低型心衰(heart failure with reduced ejection fraction, HFrEF)研究:DAPA-HF[27]和EMPEROR-Reduced两项研究[28],分别评估了SGLT-2i达格列净(dapagliflozin)及恩格列净(Empagliflozin)在HFrEF患者中的疗效和安全性。其中DAPA-HF研究[27]显示,在标准抗HF药物治疗基础上,使用达格列净组患者发生HF恶化的风险显著降低(HR=0.70,95%CI 0.59~0.83),并且与基线是否合并T2DM无关。EMPEROR-Reduced研究[28,29,30]中位随访16个月,证实无论患者是否合并糖尿病,恩格列净(10 mg)在标准抗HF药物治疗基础上仍可进一步降低HHF的风险(HR=0.70,95%CI 0.58~0.85)。
(2) SGLT-2i改善射血分数保留型心衰(heart failure with preserved ejection fraction,HFpEF)研究:SGLT-2i对于HfpEF患者的结局影响,来自下面两项最新研究数据:SOLOIST-WHF研究,评估了在糖尿病合并HF加重患者中,索格列净(sotagliflozin)对预防心血管死亡以及HHF或紧急就诊的影响。研究共纳入1 222例患者,随机分配接受索格列净或安慰剂治疗。中位随访9个月,与安慰剂相比,索格列净降低主要终点(心血管死亡或HHF或紧急就诊)风险达33%。另一项SCORED研究,纳入人群与之有所不同,为T2DM合并CKD患者,共10 584例,随机分配接受索格列净或安慰剂治疗,中位随访16个月。结果显示,与安慰剂相比,索格列净治疗组显著减少心血管事件26%。在2021年ACC科学年会上,哈佛医学院、布莱根妇女医院Bhatt教授[31]公布了对这两项研究的汇总分析结果,探讨索格列净对包括HFpEF在内的全射血分数心衰患者的疗效。研究结果表明:与安慰剂组相比,接受索格列净治疗的患者心血管死亡或心衰住院/紧急就诊风险显著降低(15.5%对21.1%,HR=0.72,95%CI 0.63~0.82,P=0.000 002),而且无论患者基线射血分数(ejection fracture,EF)值如何,风险均显著降低(EF<40%:HR=0.78,95%CI 0.63~0.96,P=0.02;EF 40%~50%组:HR=0.61,95%CI 0.44~0.84,P=0.003;EF≥50%组:HR=0.70,95%CI 0.57~0.86,P=0.000 8)。另一项EMPEROR-Preserved研究[32]亦旨在探讨恩格列净对HFpEF成人患者(伴/不伴T2DM)心血管死亡或HHF的影响。主要终点设置为心血管死亡或HHF风险。该研究临床试验概要结果公布,中位随访38个月,研究主要终点达成,恩格列净成为一个可显著降低伴或不伴T2DM的HFpEF成人患者心血管死亡或HHF影响的药物。
(3) SGLT-2i对HF改善的作用机制:确切机制尚不十分清楚,可能机制包括以下方面。①改善心肌能量代谢:在T2DM或HF患者中,由于脂肪酸氧化失调及葡萄糖摄取或氧化受损而导致心肌功能障碍。在此情况下,酮体相比葡萄糖或游离脂肪酸可更有效地合成ATP。SGLT-2i治疗的心血管获益或与心脏代谢从脂肪酸和葡萄糖氧化转为更高效的酮体,从而提高心脏效率有关[33]。②改善心肌离子稳态:T2DM和HF患者钠氢交换体1(sodium-hydrogen exchanger,NHE-1)和SGLT-1表达均上调,导致胞内钠含量显著增加。在此情况下,通过膜钠钙交换蛋白的钙内流和通过线粒体钠钙交换蛋白钙外流进入胞质相应增加[34]。基线细胞内钙含量升高会进一步导致钙瞬变减少、心肌细胞肌浆网钙存储降低,从而抑制收缩功能[35]。SGLT-2i可通过抑制糖尿病鼠类心肌细胞中NHE-1和SGLT-1转运蛋白,降低心肌细胞内钠含量,从而逆转钙超载[36]。③诱导自噬:SGLT-2i可上调自噬启动途径中的腺苷一磷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)、sirtuin-1(SIRT1)和缺氧诱导因子表达,降低氧化应激和炎症[33]。④调节脂肪因子:HF患者血清瘦素浓度升高,SGLT-2i可降低血清瘦素浓度,增加具有心脏保护作用的脂联素浓度,从而改善心血管健康[33,37]。
(4)关注SGLT-2i的安全性:①糖尿病酮症酸中毒(diabetic ketoacidosis,DKA)[38,39,40]:使用SGLT-2i发生DKA的病例少见,症状不典型,患者可能为正常血糖的DKA。SGLT-2i与DKA间是否存在因果关系目前尚不确定。当出现疑似DKA症状时(如多尿、腹痛、恶心/呕吐、神志不清等),应及时监测和明确诊断,无论血糖升高与否,一旦确诊立即停药。②泌尿生殖道感染[39,40]:多为轻中度感染。为避免SGLT-2i治疗后感染的发生,不推荐半年内反复发生泌尿生殖道感染的患者使用SGLT-2i;对使用期间发生感染且需抗感染治疗的患者,建议暂停使用。另外,使用SGLT-2i的患者,为减少发生感染,建议注意会阴部卫生、适量饮水、保持小便通畅。③骨折与下肢截肢风险[38]:SGLT-2i是否增加骨折、截肢风险尚存争议。但值得注意的是,美国FDA至今尚未撤去对卡格列净骨折风险的警告。对于骨折高危人群(如绝经后妇女或骨质疏松症等)或出现并发症的患者(如明显足部感染或皮肤溃疡等),应谨慎使用或考虑停用卡格列净。④急性肾损伤(acute kidney injure,AKI)[38]:SGLT-2i是否引起AKI风险目前证据不足,但在使用SGLT-2i前仍需考虑患者是否具有AKI易发因素(如血容量不足、慢性肾功能不全、充血性心力衰竭及合并用药等)。在SGLT-2i起始治疗前,需检测肾功能,如估算肾小球滤过率(estimated glomerular filtration rate,eGFR);SGLT-2i使用期间应监测肾功能,如患者出现AKI体征和症状,应立即停药并开始治疗。
基于HFrEF的大型随机试验,2021ACC指南更新了优化HF治疗的专家决策路径[41],简化了HFrEF治疗流程,并将SGLT-2i推荐为治疗HFrEF患者一线治疗药物,不论是否合并糖尿病。其中达格列净治疗需满足eGFR≥30 mL·min-1·(1.73 m2)-1,恩格列净治疗eGFR下限为20 mL·min-1·(1.73 m2)-1。在2021版ADA《糖尿病医学诊疗标准》[42]中,对于合并HF患者,特别是HFrEF患者(LVEF<40%),亦推荐优先联合有降低HF风险证据的SGLT-2i以改善患者临床结局。除此之外,中华医学会糖尿病学分会(Chinese Diabetes Society,CDS)在2021年初发布的《中国T2DM防治指南(2020版)》[43]也进一步指出对于合并HF的T2DM患者,不论患者HbA1C是否达标,只要无禁忌证均应在二甲双胍治疗基础上加用SGLT-2i。
随着CVOT试验到专注于HF结局试验的陆续开展,降糖药物的HF获益得到了进一步的验证,尤其是恩格列净已显示出对于HFrEF和HFpEF患者均有改善。但就糖尿病和HF的流行病学、病理生理学、最佳药物治疗及共病管理策略而言,目前仍存在诸多尚未回答的问题,如新型药物治疗下,糖尿病和HF的流行病学特征是否正发生变化?如何优化糖尿病合并HF的管理?如何进行远程管理?未来可根据HF分期和严重程度来调整血糖控制强度,以密切监测糖尿病治疗的安全性和疗效。同样,降糖药物在HF患者中是否可安全使用,仍需更多关于降糖治疗对HF发生率和进展影响的数据。
T2DM是HF的重要危险因素,相比非糖尿病患者,糖尿病增加了HF发生和死亡风险,降低了患者生存率。不同于大多数降糖药物对HF的影响(无改善甚至加重HF),SGLT-2i可以显著改善患者的HF结局,不论是否合并有糖尿病,此类药物的HF获益得到多项国内外指南的共同推荐。随着新型降糖药物与HF相关证据不断披露,相关指南也随之不断更新,这将有助于糖尿病管理理念的转化,不仅局限于控糖本身,而是采用多学科共同管理的方式并将之用于临床实践。
所有作者均声明不存在利益冲突



























