
原发性低镁血症伴继发性低钙血症(HSH)是甲状旁腺功能减退的罕见病因之一。现报道近期本科诊治的1例原发性HSH患者,并在此基础上探讨该病的诊治策略。患者为26岁男性,以反复四肢麻木、抽搐为主要表现,生化检测提示存在低镁血症、低钙血症、低钾血症及甲状旁腺功能减退,后经基因检测证实存在瞬时受体电位阳离子通道-M亚家族-成员6(TRPM6)基因突变。经规律口服补镁治疗后,患者症状明显缓解。随访患者症状无再发,血电解质正常。原发性HSH多呈常染色体隐性遗传,因TRPM6基因突变导致肠道及肾脏的镁吸收障碍,进而引起系列临床表现,经补镁治疗通常可明显缓解相关症状。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
低镁血症是临床常见疾病,各种消化道疾病是导致血清镁浓度降低的最常见病因[1]。然而,某些罕见疾病所致低镁血症鉴别困难,临床漏诊风险高。原发性低镁血症伴继发性低钙血症(hypomagnesemia with secondary hypocalcemia, HSH)又称遗传性低镁血症伴继发低钙血症(hereditary hypomagnesaemia with secondary hypocalcemia),是由基因突变所致镁离子转运蛋白异常进而诱发镁离子肠道及肾脏吸收障碍所导致一种疾病[2]。随着病情进展,原发性HSH常伴发低钾和低钙血症,低钾血症主要与ATP依赖性钾离子通道功能降低以及继发性醛固酮增多所致肾性失钾有关,而低钙血症则主要与甲状旁腺激素(parathyroid hormone, PTH)分泌减少及终末器官对PTH的抵抗有关[3,4]。原发性HSH是低镁血症的罕见病因,目前国内外仅有数十例报道。我国原发性HSH均为个案报道且集中于10岁以下儿童,相关患儿多以中枢神经系统症状及发育迟缓就诊,经基因检测明确瞬时受体电位阳离子通道-M亚家族-成员6(transient receptor potential melastatin-6, TRPM6)基因突变后,多数患儿经补镁治疗后临床症状可明显改善,但个别延迟诊断者亦可遗留脑部损伤及发育停滞[5,6,7]。为加强临床医生对该病的重视,减少误诊、漏诊,原发性HSH已纳入我国第一批罕见病病种。临床上对此类低镁血症,应在肯定合并其他电解质紊乱及PTH异常基础上完善基因检测以明确该病的诊断。结合国内外相关报道,本文通过对近期本科诊治的1例TRPM6基因突变所致原发性HSH的成年患者进行回顾性分析,以期为该病的临床诊治提供参考。
患者为26岁男性,因"反复四肢麻木、抽搐1个月"于2019年10月入院。患者1个月前无明诱因出现发作性四肢麻木、伴抽搐,以双上肢明显,持续约3 min后症状可自行缓解,期间偶有恶心、呕吐,无伴肢体活动障碍等不适。后至当地医院住院治疗,期间查血钾2.56 mmol/L、血钠138 mmol/L、血钙0.66 mmol/L,予补钾、补钙后上述症状缓解。出院后患者自行停用补钾及补钙药物,约半个月后上述症状再发。为进一步诊治就诊于本科。否认既往消化系统等疾病。无手术、输血及药物过敏史。否认长期质子泵抑制剂、利尿剂及保健品服用史。否认接触化学品及有毒物质。足月顺产,生长发育无异常。父母非近亲结婚,有一哥哥,否认家族中存在类似症状患者。否认其他家族性遗传病病史。入院体格检查:血压137/64 mmHg(1 mmHg=0.133 kPa),体重53.5 kg,身高156 cm,体重指数22 kg/m2,腰围73 cm,臀围86 cm,腰臀比0.85。神清,心肺腹体格检查未见明显异常,束臂加压试验及面神经叩击征阴性。四肢肌力Ⅴ级,肌张力正常。生理反射存在,病理反射未引出,脑膜刺激征阴性。
入院后查血常规:白细胞4.92×109/L(参考范围4.3×109/L~5.8×109/L,下同)、血红蛋白146 g/L(130~175 g/L)。尿常规:尿比重1.024(1.015~1.025)、尿酸碱度6.0(5.5~6.5),粪便常规无异常。血生化:肌酐73 μmol/L(44~133 μmol/L)、碱性磷酸酶91 U/L(45~125 U/L)、白蛋白42.5 g/L(35~50 g/L)、空腹血糖4.3 mmol/L(3.9~5.6 mmol/L)、二氧化碳结合力26 mmol/L(22~31 mmol/L)。25-羟维生素D为84.3 nmol/L(75~250 nmol/L)。甲状腺功能:促甲状腺素(TSH)1.548 mU/L(0.55~4.78 mU/L)、游离三碘甲状腺原氨酸(FT3)5.81 pmol/L(3.5~6.5 pmol/L)、游离甲状腺素(FT4)14.85 pmol/L(11.50~22.70 pmol/L)。醛固酮(卧位)89.0 ng/L、肾素活性(卧位)2.23 ng·mL-1·h-1、醛固酮肾素活性比值(ARR)为4.0;醛固酮(立位)130.0 ng/L、肾素活性(立位)6.47 ng·mL-1·h-1、ARR为2.0。甲状腺旁腺彩超:双侧甲状旁腺区未见明显占位病变。头颅计算机断层扫描(CT):颅内未见明显异常,左侧筛窦炎症。心电图:窦性心律,正常心电图。泌尿系彩超:肾脏、输尿管、膀胱未见明显结石或占位。
低镁血症是临床常见疾病,相关统计数据表明住院患者中低镁血症的发生率约为12%[8]。机体镁的主要储存器官位于骨骼[9,10]。然而,骨骼中镁离子无法在短期内动员至血循环。因此,轻微的肠道及肾脏镁丢失即可导致低镁血症。低镁血症通常定义为血清镁离子小于0.66 mmol/L,而原发性HSH患者血清镁浓度可低至0.2 mmol/L以下。
低镁血症的病因可分为非遗传性疾病、药物及遗传性疾病三大类[11,12,13,14,15]。非遗传疾病多由经胃肠道或肾脏的镁丢失引起,相关疾病包括急慢性腹泻、营养吸收不良、急性胰腺炎、小肠旁路手术、酗酒、高钙血症、获得性肾小管功能障碍等。某些药物在治疗期间可导致血镁浓度减低,常见药物包括利尿剂(呋塞米、噻嗪类)、表皮生长因子受体抗体(西妥昔单抗)、质子泵抑制剂、免疫抑制剂(环孢菌素A、他克莫司)、铂衍生物(顺铂,卡铂)、抗菌素(氨基糖苷类、雷帕霉素、两性霉素B、膦甲酸)。通过测定24 h尿镁排泄量或随机尿标本计算尿镁排泄分数(FEMg)可以鉴别消化道失镁与肾性失镁。肾功能正常者24 h尿镁超过10 mg或随机尿标本的镁排泄分数超过3%,提示肾脏镁离子不恰当丢失。遗传性疾病所致低镁血症的病因较为复杂,根据致病基因的不同,大致可分为4组:(1)高血钙性低镁血症,包括CLDN16、CLDN19、CASR及CLCNKB基因突变等。(2)Gitelman样低镁血症,包括CLCNKB、SLC12A3、BSND、KCNJ10、FYXD2、HNF1B及PCBD1基因突变等。(3)线粒体低镁血症,包括SARS2、MT-TI基因突变及Kearns-Sayre综合征。(4)其他基因突变所致低镁血症,包括TRPM6、CNMM2、EGF、EGFR、KCNA1及FAM111A基因突变等[15]。临床可参考以下流程对低镁血症行病因进行鉴别诊断(图1)。
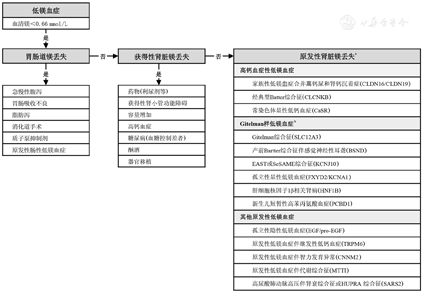

注:a:原发性肾脏镁丢失相关突变基因;b:Gitelman样低镁血症是指低镁伴有血钙减低、容量扩张、低血压及肾素-血管紧张素-醛固酮系统激活的相关表现
成人原发性HSH患者大多无明显临床症状,部分可出现非特异性表现如疲劳、肌肉痉挛及肌无力等。需要注意的是,伴随疾病进展,部分患者常因合并如低钙、低钾血症等其他电解质紊乱,从而引发系列较为明显的临床症状。相关症状与镁缺失的严重程度无明显相关性,可仅有纤维震颤、抽搐、束臂加压试验或面神经叩击征阳性,少数严重患者也可表现为明显的痛性腕足痉挛、抽搐及心律失常,上述症状可单独或者同时存在。心律失常可能由于低镁血症引起,也可能由甲状旁腺功能减退所致低钙血症引起[16]。此外,出现类似癫痫、肌肉痉挛等表现的婴幼儿也应注意有无原发性HSH导致低镁血症的可能,如原发病得不到及时治疗,可能导致持续性中枢神经系统损伤,甚至致命[17,18]。
原发性HSH是一种常染色体隐性遗传病,确诊依赖于基因检测。该病是由于染色体9q21的TRPM6基因突变所致,该基因编码蛋白功能的正常行使对于人体镁平衡的建立至关重要[19]。肠黏膜和肾脏均有TRPM6基因的表达,该基因编码具有多重功能的蛋白,包括蛋白激酶及镁离子通道等[20]。目前认为,TRPM6具有诸如点突变、框移突变、剪接突变及终止突变等30余种突变形式。突变后TRPM6编码蛋白功能异常,进而导致肠道及肾脏的镁吸收障碍并出现严重低镁血症,血清镁离子浓度明显降低影响甲状旁腺功能,通过抑制PTH分泌等机制导致继发性低钙血症。
原发性HSH需与其他导致血清镁浓度减低的疾病相鉴别,诊治过程中需注重询问既往药物服用史、胃肠道或甲状腺手术史及类似疾病家族史,观察患者有无腹泻、呕吐等消化道症状。经仔细问诊结合相关实验室检查,可明确大部分低镁血症的原因。但由于原发性HSH与Gitelman综合征的临床表现及生化检查结果存在重叠,临床鉴别这两种疾病有时较为棘手。首先,虽然两种疾病均有尿钙排泄减少,但原发性HSH多伴有甲状旁腺功能减退及低钙血症。其次,Gitelman综合征患者因肾素血管紧张素系统过度激活,其低钾碱中毒通常更为严重,而原发性HSH患者的肾素血管紧张素系统通常无明显激活,其临床血镁降低则更为明显。此外,经补镁治疗后,原发性HSH患者症状可明显缓解,而Gitelman综合征患者往往不能通过单纯纠正低镁血症而获得临床症状及生化指标的缓解。Gitelman综合征是由SLC12A3基因突变所致肾小管疾病,对于诊断存疑的相关患者,建议采取基因检测协助鉴别。
原发性HSH是一种潜在的致死性疾病,需结合患者症状及电解质紊乱的严重程度进行个体化治疗。目前,口服或静脉补镁是该病唯一的治疗方法,且镁的补充需长期维持。对严重有症状(如惊厥、心律紊乱等)的患者,建议优先选择静脉补镁,待患者症状消失,血镁恢复正常时可过渡为口服补镁治疗。此外,由于原发性HSH患者常需终身补充镁剂,部分患者可能因此出现严重腹泻,从而使患者依从性降低。所以,在整个治疗过程中需注意对患者进行随访并结合其临床症状的缓解程度以及对镁剂不良反应的耐受程度进行个体化补镁治疗。对于血镁接近正常但仍反复出现四肢麻木及抽搐等症状的患者应注意监测血钙浓度以便及时纠正低钙血症。对于无症状低镁血症的患者,口服补镁方便、安全且有效[21]。然而,尽管对原发性HSH患者进行了充分的补镁治疗,其血清镁水平通常仍接近正常低值[22]。因此,临床对于相关疾病的治疗目标应以患者症状的缓解作为主要评估指标,而不是单纯将血镁控制在绝对正常范围。
本例患者以低钙抽搐为主要症状,院外经补钙及补钾后抽搐可缓解,但症状仍反复发作。相关检查提示患者低钾血症、低钙血症、低镁血症及甲状旁腺功能减退症。此外,患者血白蛋白、血肌酐、血25-羟维生素D及醛固酮-肾素活性水平均在正常范围。先后予氯化钾溶液、门冬氨酸钾镁及碳酸钙D3片口服治疗纠正患者电解质紊乱。经上述治疗后患者四肢麻木症状稍减轻,复查血钾正常,血镁及血钙仍持续性降低。后予联合25%硫酸镁注射液静脉补镁治疗。
本例患者存在甲状旁腺功能减退及低钙血症,血镁明显降低但血钾仅轻度减低,且经单纯补镁治疗后上述电解质紊乱明显纠正,临床不支持Gitelman综合征。结合患者低血钙时PTH水平无明显升高,在排除白蛋白、维生素D缺乏及肾功能不全等常见病因后,考虑低钙抽搐主要由于严重低镁血症致甲状旁腺功能减退进而导致继发低钙可能性大。经静脉补镁治疗并逐渐过渡为单纯口服补镁及补钾治疗后,患者无再发肢体抽搐,且四肢麻木等其他症状明显好转,血镁、PTH、血钾及血钙恢复正常。院内患者生化指标及治疗情况见汇总表(表1)。综合分析患者病史及检查,考虑存在原发性HSH可能。
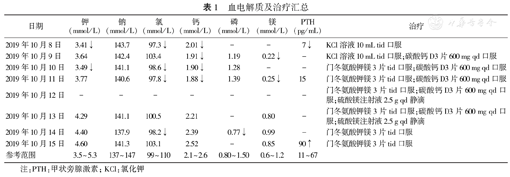
血电解质及治疗汇总
血电解质及治疗汇总
| 日期 | 钾(mmol/L) | 钠(mmol/L) | 氯(mmol/L) | 钙(mmol/L) | 磷(mmol/L) | 镁(mmol/L) | PTH(pg/mL) | 治疗 |
|---|---|---|---|---|---|---|---|---|
| 2019年10月8日 | 3.41↓ | 143.7 | 97.3↓ | 2.01↓ | - | - | 7↓ | KCl溶液10 mL tid口服 |
| 2019年10月9日 | 3.64 | 142.4 | 103.4 | 1.91↓ | 1.19 | 0.22↓ | - | KCl溶液10 mL tid口服;碳酸钙D3片600 mg qd口服 |
| 2019年10月10日 | 3.49↓ | 141.1 | 98.6↓ | 1.90↓ | 1.28 | - | - | 门冬氨酸钾镁3片tid口服;碳酸钙D3片600 mg qd口服 |
| 2019年10月11日 | 3.77 | 140.6 | 97.8↓ | 1.88↓ | 1.39 | 0.25↓ | 15 | 门冬氨酸钾镁3片tid口服;碳酸钙D3片600 mg qd口服 |
| 2019年10月12日 | - | - | - | - | - | - | - | 门冬氨酸钾镁3片tid口服;碳酸钙D3片600 mg qd口服;硫酸镁注射液2.5 g qd静滴 |
| 2019年10月13日 | 4.29 | 141.1 | 100.5 | 2.21 | - | 0.80 | - | 门冬氨酸钾镁3片tid口服;碳酸钙D3片600 mg qd口服;硫酸镁注射液2.5 g qd静滴 |
| 2019年10月14日 | 4.40 | 137.9 | 98.2↓ | 2.39 | 0.77↓ | 0.99 | - | 门冬氨酸钾镁3片tid口服 |
| 2019年10月15日 | 4.60 | 141.3 | 103.1 | 2.52 | - | 0.85 | 90↑ | 门冬氨酸钾镁3片tid口服 |
| 参考范围 | 3.5~5.3 | 137~147 | 99~110 | 2.1~2.6 | 0.80~1.50 | 0.6~1.2 | 11~67 |
注:PTH:甲状旁腺激素;KCl:氯化钾
基因检测证实本例患者携带2个TRPM6基因杂合变异,明确其原发性HSH诊断。(1)TRPM6(9q21.13|NM_017662.4) Intron34 C.5487+1G>A p.?。该位点变异为剪接突变,通过改变mRNA剪接位点使所编码的蛋白质丧失正常功能,相关生信分析认为该变异为致病性变异。(2)TRPM6(9q21.13|NM_017662.4)Exon21 c.2854C>T p.(Arg952Trp)。该变异为错义突变,通过将翻译产物的第952位氨基酸残基由Arg变为Trp而导致蛋白质功能丧失,相关生物信息学分析提示该变异为可疑致病性变异。再次完善其父母血电解质及TRPM6基因检测,结果示患者父母电解质正常范围,杂合携带患者相关TRPM6基因变异位点(图2)。
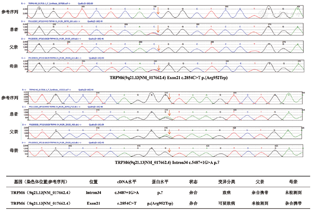

注:TRPM6:瞬时受体电位阳离子通道-M亚家族-成员6
出院后患者继续规律口服门冬氨酸钾镁3片,3次/d。1个月后随访患者无再发抽搐及四肢麻木,复查血钾3.75 mmol/L、血钙2.30 mmol/L、血镁0.34 mmol/L、PTH 16.4 pg/mL。嘱其规律服药,后随诊1年,均无上述症状再发,2021年1月复查血钾3.65 mmol/L、血钠140.9 mmol/L、血钙2.09 mmol/L、血镁1.07 mmol/L。
此外,本例患者由于本院未开展尿镁检测而未能实现肾性失镁的定量评估,后续病例应结合具体情况,考虑完善相关检测。
原发性HSH为内分泌罕见疾病,目前世界范围内报道的病例不足百例[23]。成人期发病的患者其早期临床表现多样且隐匿,晚期因合并其他电解质紊乱而出现麻木、抽搐甚至癫痫发作等系列症状。对于血镁减低的患者在排除胃肠道疾病、肾脏疾病及相关药物服用后,需注意排查此病。原发性HSH的诊断主要是排除检验误差后,完善TRPM6基因检测进行确诊。该病目前尚无特效的治疗方法,多以补充镁剂及对症治疗为主,贻误诊治有可能造成患者不可逆性中枢神经系统损害。
所有作者均声明不存在利益冲突



























