
本文报道1例以高雄激素血症为临床表现,术后病理证实为卵巢非特异性类固醇细胞瘤的病例。患者为绝经后女性,临床表现为"胡须生长、头发稀疏、皮疹、阴蒂增大"。生化提示血睾酮、硫酸脱氢表雄酮、雌二醇升高,黄体生成素、卵泡刺激素降低。影像学见左侧肾上腺低密度小结节及左侧附件区实质占位。完善ACTH兴奋试验、hCG兴奋试验、双侧肾上腺及卵巢静脉采血后,考虑过多的雄激素来源于卵巢。注射促性腺激素释放激素类似物(GnRHa)后,睾酮水平下降至正常范围。后行腹腔镜双附件切除术,病理提示左附件非特异性类固醇细胞瘤。本例报道旨在提高对具有高雄激素临床表现的卵巢非特异性类固醇细胞瘤的认识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
卵巢类固醇细胞瘤(steroid cell tumors, SCTs)来源于卵巢性索-间质,发病率低,约占卵巢肿瘤的0.1%[1]。卵巢类固醇细胞瘤分为Leydig细胞瘤和非特异性类固醇细胞瘤(steroid cell tumor, not otherwise specified,SCT-NOS,以下简称NOS)[2]。NOS可分泌雄激素、雌激素及其他类固醇激素。本文报道1例以高雄激素血症为主要表现的NOS,具体报告如下。
患者,女,55岁,未育,已绝经7年。因"阴蒂增大2年,胡须生长1年"于2020年8月27日收治复旦大学附属中山医院内分泌科。1998年及2010年行2次巧克力囊肿剥离术、2010年行子宫肌瘤切除术。查体:体温36.4℃,脉搏102次/min,呼吸20次/min,血压135/85 mmHg(1 mmHg=0.133 kPa),体重指数(BMI)20 kg/m2,头发稀疏、头皮油腻性红斑,面部可见胡须生长,双上肢皮肤有散在暗红色皮疹,腹壁、颈部及背部可见散在浅褐色皮疹,阴毛较密,呈菱形分布,阴蒂肥大,阴蒂处可见长约3.0 cm组织突起,余无阳性体征。
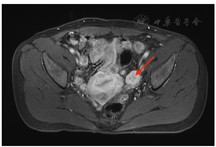
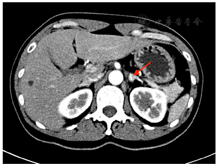
辅助检查:LH 1.7 IU/L(正常参考范围7.7~58.5,下同)、FSH 4.1 IU/L(25.8~134.8)、催乳素544.0 mIU/L(131~647)、雌二醇137.0 pmol/L(<505)、孕激素0.9 nmol/L(<0.401)、睾酮(T)6.4 nmol/L(0.101~1.42)、硫酸脱氢表雄酮(DHEAS) 6.27 μmol/L(0.101~1.42)、质谱法T 4.713 ng/mL(0.02~0.45)、质谱法DHEAS 4.3 ng/mL(4.30~6)、质谱法雄烯二酮1.218 ng/mL(0.2~0.75);餐后2 h血糖9.5 mmol/L(<7.8)、餐后2 h胰岛素97.4 μU/mL、餐后2 h C肽12.5 ng/mL;三酰甘油1.95 mmol/L(<1.7);红细胞5.52×1012/L(3.8~5.10)、血红蛋白182 g/L(115~150);余尿粪常规、肝肾功能、电解质、离子浓度、出凝血、空腹血糖、糖化血红蛋白、骨密度、肿瘤标志物、甲状腺激素、生长激素、肾素-血管紧张素-醛固酮、肾上腺素、去甲肾上腺素、促肾上腺皮质激素及皮质醇昼夜节律等未见明显异常。骨密度提示骨质疏松(腰椎T-1.9、髋关节股骨颈T-2.5);经阴道及腹部超声及盆腔增强MRI均提示子宫多发肌瘤、左侧附件区实质占位,大小约2.8 cm×1.9 cm(图1);肾上腺增强CT提示左侧肾上腺小结节,大小约1.1 cm×0.9 cm,腺瘤机会大(图2)。


诊疗经过:根据现有检查结果,初步诊断为高雄激素血症、左侧卵巢占位、左侧肾上腺占位、子宫肌瘤、骨质疏松。为探究雄激素来源,予完善ACTH兴奋试验、hCG兴奋试验。同时为了激素水平结果的准确性,加用质谱法验证。ACTH兴奋试验:
ACTH激发后血清睾酮水平轻度增加,根据质谱法甚至降低(表1)。hCG兴奋试验:2种检验方法均提示hCG激发后血清睾酮水平及倍增明显(表2)。根据ACTH及hCG兴奋试验结果,考虑雄激素来源于卵巢可能大,来源于肾上腺不能除外。故为进一步明确其来源,排除禁忌后行双侧肾上腺及卵巢静脉采血,结果示双侧肾上腺静脉测血清皮质醇水平较外周升高10倍以上,提示双侧肾上腺静脉插管成功。双侧肾上腺静脉睾酮可测出、低于下腔静脉,提示睾酮并非来源于肾上腺。双侧卵巢静脉插管未成功(表3)。综合患者病史及检查结果,考虑雄激素来源于卵巢。结合文献报道,考虑为卵泡膜细胞增生症或卵巢肿瘤。建议患者尽快切除双侧附件,明确病理,但患者拒绝。在取得患者充分知情同意后,于2020年9月9日皮下注射促性腺激素释放激素类似物(GnRHa)醋酸亮丙瑞林3.75 mg。2020年10月9日复查激素水平,T 0.8 nmol/L、DHEAS 6.04 μmol/L、LH 0.6 IU/L、FSH 2.8 IU/L,雄激素抑制明显,于当日行第二次醋酸亮丙瑞林治疗,1个月后查T 0.8 nmol/L、DHEAS未测、LH 0.4 IU/L、FSH 6.1 IU/L。患者后自行就诊于我院妇产科,结合妇产科医生建议决定行手术治疗,于2020年11月30日行腹腔镜双侧附件切除术,术后病理提示(左附件)巨检卵巢病变区镜下见上皮样细胞增生,弥漫分布,排列呈小巢状,胞质丰富呈空泡状,核分裂相偶见,未见坏死。免疫组化:Ki-67(2%阳性),P53(30%阳性),CK{pan}(-),CK7(-),AR(70%+),ER(60%),PR(10%+),Calretinin(-),α-inhibin(局灶+), CD68(组织细胞+),AFP(-),CD117(-),SMA(-),Des(-),S-100(-),A103(部分+),CD56(+),Syn(-),CgA(-),CD99(+),SF1(弥漫阳性)。结合病史及免疫组化结果,提示非特异性类固醇细胞瘤。术后患者恢复良好。术后2个月复查血清T 0.5 nmol/L、DHEAS 6.23 μmol/L、LH 29.7 IU/L,FSH 43.5 IU/L,子宫附件彩超无异常。现术后7个月,复查血清T 0.9 nmol/L、DHEAS 5.87 μmol/L、LH 51.6 IU/L,FSH 65.5 IU/L,患者男性化表现较前减轻,目前仍在随访中。
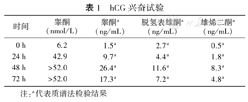
hCG兴奋试验
hCG兴奋试验
| 时间 | 睾酮(nmol/L) | 睾酮a(ng/mL) | 脱氢表雄酮a(ng/mL) | 雄烯二酮a(ng/mL) |
|---|---|---|---|---|
| 0 h | 6.2 | 1.5a | 2.7a | 0.5a |
| 24 h | 42.9 | 9.7a | 4.4a | 1.8a |
| 48 h | >52.0 | 26.4a | 11.6a | 8.3a |
| 72 h | >52.0 | 17.3a | 7.2a | 4.8a |
注:a代表质谱法检验结果
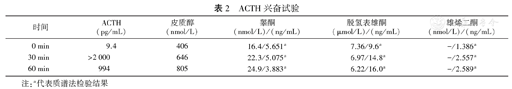
ACTH兴奋试验
ACTH兴奋试验
| 时间 | ACTH(pg/mL) | 皮质醇(nmol/L) | 睾酮(nmol/L)/(ng/mL) | 脱氢表雄酮(μmol/L)/(ng/mL) | 雄烯二酮(nmol/L)/(ng/mL) |
|---|---|---|---|---|---|
| 0 min | 9.4 | 406 | 16.4/5.651a | 7.36/9.6a | -/1.386a |
| 30 min | >2 000 | 646 | 22.3/5.075a | 6.97/14.8a | -/2.557a |
| 60 min | 994 | 805 | 24.9/3.883a | 6.22/16.0a | -/2.589a |
注:a代表质谱法检验结果
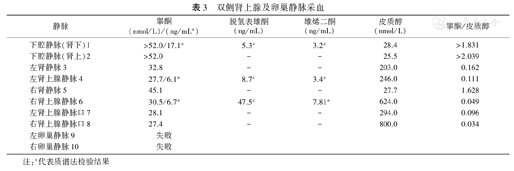
双侧肾上腺及卵巢静脉采血
双侧肾上腺及卵巢静脉采血
| 静脉 | 睾酮(nmol/L)/(ng/mLa) | 脱氢表雄酮(ng/mL) | 雄烯二酮(ng/mL) | 皮质醇(nmol/L) | 睾酮/皮质醇 |
|---|---|---|---|---|---|
| 下腔静脉(肾下)1 | >52.0/17.1a | 5.3a | 3.2a | 28.4 | >1.831 |
| 下腔静脉(肾上)2 | >52.0 | - | - | 25.5 | >2.039 |
| 左肾静脉3 | 32.8 | - | - | 203.0 | 0.162 |
| 左肾上腺静脉4 | 27.7/6.1a | 8.7a | 3.4a | 246.0 | 0.111 |
| 右肾静脉5 | 45.1 | - | - | 27.7 | 1.628 |
| 右肾上腺静脉6 | 30.5/6.7a | 47.5a | 7.81a | 624.0 | 0.049 |
| 左肾上腺静脉口7 | 28.1 | - | - | 294.0 | 0.096 |
| 右肾上腺静脉口8 | 27.4 | - | - | 800.0 | 0.034 |
| 左卵巢静脉9 | 失败 | ||||
| 右卵巢静脉10 | 失败 |
注:a代表质谱法检验结果
卵巢类固醇细胞瘤是一种罕见的性索间质肿瘤,发病率不到卵巢肿瘤的0.1%[1]。根据2014年WHO卵巢肿瘤分类标准,可分为2种亚型:Leydig细胞瘤和NOS。对于缺少Leydig细胞瘤典型特征的类固醇细胞瘤统称为NOS,约占卵巢类固醇细胞瘤的80%[2]。
大多数NOS分泌激素,如雄激素、雌激素、皮质醇、醛固酮等[3],导致患者体内激素功能紊乱从而表现出相应的临床症状。55%~77%NOS分泌雄激素,此类患者常具有男性化特征,如多毛、痤疮、脱发、声音变粗、阴蒂肥大、闭经和不孕等[4]。大约6%~23%患者雌二醇分泌增多,表现为子宫内膜不规则出血和子宫内膜息肉,甚至一些患者还发展为子宫内膜癌[3,4]。也有患者出现皮质激素升高,如库欣综合征。还有少数患者可以表现为难治性高血压[5]、大量腹水及CA125升高[6]。NOS常呈单侧、实性肿块[4]且可以发生在各个年龄段[7]。本例患者为中老年女性,病灶为卵巢单侧实性肿块,以高雄激素血症为主要临床表现,具体表现为脱发、阴蒂肥大、痤疮等,符合文献报道。
NOS的诊断依赖于临床表现、影像学检查、激素水平、病理等多方面,其中病理是金标准。大体可表现为边界清楚的实性肿块,伴有变性及出血时可呈囊性。镜下为空泡状圆形或多角型细胞,可伴有嗜酸性或透明胞质,呈弥漫、巢状或条索状排列。细胞核一般位于中心,25%细胞可有核分裂相,具有中重度不典型增生[8]。卵巢非特异性类固醇细胞瘤的免疫组化通常是通过几种指标组合进行诊断及鉴别,其中α-inhibin、calretinin、Melan-A、CD99、SF1是敏感性指标[2,9,10]。本例患者病理镜下表现为空泡状细胞呈巢状分布,偶见核分裂相,未见Reinke结晶(图3①),免疫组化α-inhibin(局灶+)(图3②)、CD99(+)(图3③)、Melan-A(部分+)(图3④)、SF1呈弥漫阳性(图3⑤)、calretinin呈(-)(图3⑥),符合病理诊断。
文献报道大多数NOS为良性,当出现以下表现时常提示肿瘤为恶性:肿瘤直径≥7 cm、出血、坏死、核分裂相>2/HPF、中重度核异型性[2]。此外,有文献称GnRHa治疗是否能完全抑制睾酮助于鉴别卵巢病灶良恶性,良性病变能被抑制而恶性病变无法被抑制[11,12,13]。本例患者肿瘤大小为2.8 cm×1.9 cm、未见出血坏死、核分裂相偶见、Ki-67指数较低且GnRHa治疗能抑制睾酮至正常,考虑为良性病变。无论良恶性,均首选手术治疗,手术方案需结合病理、分期、患者是否需要保留生育功能等[14]方面。对于良性肿瘤,年轻患者可以选择患侧附件切除术或肿瘤切除术,绝经女性可行全子宫及双附件切除术[15]。对于恶性肿瘤,应行肿瘤减灭术,辅以放疗及化疗[16],GnRHa可作为辅助治疗[15]。本例考虑到患者自身诉求及肿瘤的生物行为,予行双侧附件切除,建议术后密切随访。
本例患者因血清睾酮升高而呈男性化表现就诊,探究雄激素来源十分重要。女性睾酮主要来源于卵巢及肾上腺,本例患者卵巢及肾上腺均有占位,通过hCG及ACTH兴奋试验、双侧肾上腺及卵巢静脉采血,确定雄激素来源于卵巢。而卵巢产生过多的雄激素病因可分为非肿瘤性及肿瘤性。非肿瘤性病变主要考虑多囊卵巢综合征及卵泡膜细胞增生症[13]。肿瘤性病变主要有支持-间质细胞瘤、脂质细胞瘤、卵巢内膜腺癌等[17]。多囊卵巢综合征主要发生于育龄期女性,且有特异性影像学表现,与本例不符,故对于本例患者,应注重卵泡膜细胞增多症及肿瘤的鉴别诊断。有文献报道,上述两种疾病的鉴别有以下几点,肿瘤患者的男性化表现更为严重、具有更高睾酮水平(睾酮≥11.0 nmol/L诊断肿瘤的灵敏度和特异度分别为77%和91%)、更低FSH水平(FSH≤35 U/L对诊断肿瘤的灵敏度和特异度分别为90%和92%)、单侧卵巢体积增大[13,18,19]。本例患者为左侧卵巢病变,有胡须生长、阴蒂肥大等明显的男性化表现、FSH小于35 U/L,卵巢肿瘤指向性大。术后病理也证实了我们的诊断。故对于以胡须生长、阴蒂肥大等男性化症状为主诉就诊于内科的女性患者,内科医师除进行激素检查,也应完善肾上腺、卵巢影像学检查,明确雄激素来源,提高该病的诊断率。
感谢复旦大学附属中山医院病理科、妇产科提供的帮助
所有作者均声明不存在利益冲突































