
血糖检测在糖尿病治疗中具有重要意义,目前的血糖检测多为有创和微创的方法,降低了患者长期监测血糖的依从性。无创血糖测量技术可降低患者血糖检测时的不适,患者遵循指南长期监测血糖的意愿提高,有利于更加良好地控制血糖,进而减少糖尿病急慢性并发症的发生和发展。无创检测如能实现数据精准且成本可控,则有望实现临床大规模应用。本文介绍了目前无创血糖检测技术的准确度及优劣性,同时也讨论了目前临床应用方面所面临的一些问题。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
糖尿病是严重影响人类健康的慢性疾病,长期血糖控制不佳会导致各种急慢性并发症[1]。血糖监测是糖尿病患者综合管理的重要手段之一,可用以评估降糖效果并指导临床调整治疗方案。血糖监测对于低血糖高风险的患者、妊娠期高血糖、1型糖尿病、脆性糖尿病人群更为重要[1]。目前临床上常用的血糖检测方法为有创检查,长期反复取血带来的疼痛、皮肤创伤及感染风险增加使得患者依从性较差。相比之下,无创及微创血糖检测可随时随地进行,并可通过互联网实现智能化远程化管理,提高了糖尿病患者血糖监测的依从性,是近年来临床医疗机构、糖尿病患者及家属、相关企业共同关注的热点之一。
无创血糖检测技术不同于常规指尖血及静脉血的有创测量,多采用无创的手段获取人体体液成分相关数据,通过光学或者其他方法测定人体体液葡萄糖浓度,再将一定数量的有创血糖值联合与之一一对应的无创血糖值通过算法进行建模,用于后续血糖值推断,从而实现无创测量。常见的原理主要包括光学法(中/近红外光谱法[2]、拉曼光谱法、偏振光旋光法)、反离子电渗法、电磁波、电化学法、代谢热整合法等[2]。目前光学法应用最多,主要技术路线如下:入射光束射入靶组织后,人体成分等特性致使传出光信息被修改,光信号强度、相位、偏振角以及频率等发生改变,通过算法分析上述变量与葡萄糖浓度之间的相关性来实现无创测量,其中中/近红外光方法在无创血糖检测发展最快,也是目前应用最为广泛的技术之一。
常见的无创技术通过对血液中葡萄糖浓度进行直接测量,或是通过尿液、泪液、眼房水、唾液、呼出气体等实现间接测量。其优劣性由技术原理、检测人群、以及测量部位共同决定。
无创测量方法降低了反复有创取血所致的感染风险以及心理负担,提高了糖尿病患者血糖监测的依从性,从长远来看对糖尿病并发症的防控有着重大的社会成本效益。相较于有创血糖检测,无创测量技术多采用非酶法检测,尽管设备更为昂贵,但是节省了大量传统血糖仪所需的一次性试纸。此外,无创血糖检测能够实现快速实时检测,相比传统静脉血测定,其对于一些紧急情况需要进行血糖检测时,出结果耗时相对较短。对于需要连续测量的患者,无创设备既可以随时获得数据,也可借助云端传输功能直接获得连续型数据,方便临床医生判断血糖变化趋势。
光学法测量时,穿透能力较弱,并不能穿透甲床血管,大多只能测量间质液葡萄糖浓度,而不是直接测量深部血管中血糖。这种间接的测量方法,在急性血糖波动情况下会存在延迟现象而导致测量偏差[3,4,5],与血液葡萄糖浓度之间潜在滞后时间约为5~10 min。为增加传感器检测的灵敏度,设备的体积会相应增加,影响到携带的方便性,同时也增加了设备的成本。
为避免侵入性的检查方法,有些检查者尝试检测尿液推导血糖数据。该方法局限性较大:由于个体肾糖阈值不同,只有高于该阈值尿糖浓度才能被检测到[6];钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂类药物通过增加尿液葡萄糖的排泄来降低血糖,使用该类药物的人群无法通过测定尿液葡萄糖来实时评估血糖;此外,尿液易稀释、易受患者饮水量而改变等特性也限制了该技术的应用[7]。
汗液作为一种容易获得的体液,受环境温度、体表温度、生理状态等剧烈变化影响明显,准确度受限[8]。部分经眼前房间接测量房水/泪液葡萄糖浓度的设备,由于眼睛的特殊性,入射光强可选范围受限[5],隐形眼镜不规范佩戴会造成角膜创伤,泪液隐血阳性对血糖的测定也存在一定的影响[9]。用反离子电渗法获得表皮组织液是目前最常见的间接测量部位,严格意义来讲该技术属于微创而不是无创,电流持续施加在皮肤抽吸组织液上会造成局部皮肤刺痛、刺激性皮疹及红斑;与血液相比,间质液几乎没有缓冲分子来调节pH[8],波动较大,测量精确度极易受外界环境如温度、湿度、汗液等影响[2]。
与常规的有创血糖检测如静脉血、指尖血等方式相比,无创血糖检测设备的准确度和可重复性决定其能否广泛应用于临床。通常用于评估无创设备检测的参数如下:(1)克拉克共识误差网格分析(consensus error gridanalysis,CEG):国际标准化组织ISO15197中2013规定,要求总体99%的测量值落在CEG网格A(对临床操作无效应)和B区(对临床结局略有效应或无效应),且至少95%位于A区[10]。(2)平均绝对相对差值(mean absolute relative difference,MARD):MARD值来量化血糖检测的准确度,通过与Yellow Springs Instrument(YSI)2300化学分析仪进行对比得出,MARD值越小代表准确度越高[8]。准确度=(100-MARD)%。(3)其他:我国最新公布的GBT 19634-2021国家标准指出,当测量值<100 mg/dL(5.55 mmol/L)时,允许偏差不超过±15 mg/dL(0.83 mmol/L);当测量值≥100 mg/dL,允许误差范围不超过±15%;该国标预计将于2023年实施[11]。该国标的要求更加严格,因此它的实施将致使微创/无创血糖检测领域面临全面"洗牌"。
下文将以CEG网格和(或)MARD值来量化与传统静脉血/指尖血相比,现有无创设备血糖检测的准确度。常见的无创血糖测量设备参数见表1。
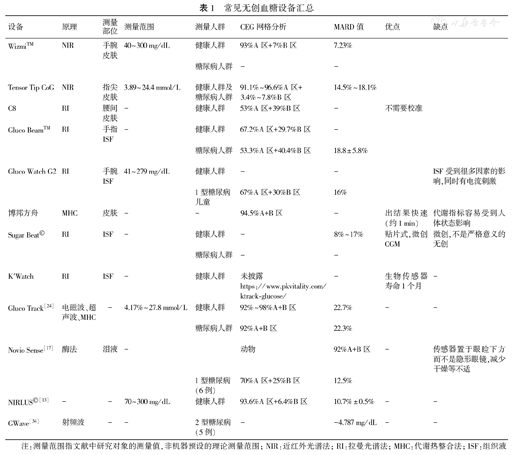
常见无创血糖设备汇总
常见无创血糖设备汇总
| 设备 | 原理 | 测量部位 | 测量范围 | 测量人群 | CEG网格分析 | MARD值 | 优点 | 缺点 |
|---|---|---|---|---|---|---|---|---|
| Wizmi™ | NIR | 手腕皮肤 | 40~300 mg/dL | 健康人群 | 93%A区+7%B区 | 7.23% | ||
| 糖尿病人群 | - | - | ||||||
| Tensor Tip CoG | NIR | 指尖皮肤 | 3.89~24.4 mmol/L | 健康人群及糖尿病人群 | 91.1%~96.6%A区+3.4%~7.8%B区 | 14.5%~18.1% | ||
| C8 | RI | 腰间皮肤 | - | 健康人群 | 53%A区+39%B区 | - | 不需要校准 | |
| Gluco Beam™ | RI | 手指ISF | - | 健康人群 | 67.2%A区+29.7%B区 | - | ||
| 糖尿病人群 | 53.3%A区+40.4%B区 | 18.8±5.8% | ||||||
| Gluco Watch G2 | RI | 手腕ISF | 41~279 mg/dL | 健康人群 | - | - | ISF受到很多因素的影响,同时有电流刺激 | |
| 1型糖尿病儿童 | 67%A区+30%B区 | 16% | ||||||
| 博邦方舟 | MHC | 皮肤 | - | - | 94.5%A+B区 | - | 出结果快速(约1 min) | 代谢指标容易受到人体状态影响 |
| Sugar Beat© | RI | ISF | - | 健康人群 | - | 8%~17% | 贴片式,微创CGM | 微创,不是严格意义的无创 |
| 糖尿病人群 | - | - | ||||||
| K′Watch | RI | ISF | - | 健康人群 | 未披露https://www.pkvitality.com/ktrack-glucose/ | - | 生物传感器寿命1个月 | - |
| Gluco Track[24] | 电磁波、超声波、MHC | - | 4.17%~27.8 mmol/L | 健康人群 | 92%~98%A+B区 | 22.7% | - | - |
| 糖尿病人群 | 92%A+B区 | 22.3% | ||||||
| Novio Sense[17] | 酶法 | 泪液 | - | 动物 | 92%A+B区 | - | 传感器置于眼睑下方而不是隐形眼镜,减少干燥等不适 | |
| 1型糖尿病(6例) | 70%A区+25%B区 | 12.5% | ||||||
| NIRLUS©[13] | - | - | 70~300 mg/dL | 健康人群 | 93.6%A区+6.4%B区 | 10.7%±0.5% | - | - |
| GWave[34] | 射频波 | - | - | 2型糖尿病(5例) | - | -4.787 mg/dL | - | - |
注:测量范围指文献中研究对象的测量值,非机器预设的理论测量范围;NIR:近红外光谱法;RI:拉曼光谱法;MHC:代谢热整合法;ISF:组织液
现今无创血糖测量技术相关研究数量与日俱增,大多在实验室葡萄糖溶液或是动物体内可获得良好的准确度和安全性,但是在临床大规模应用仍需提高检测准确度以及大规模临床试验的验证。无创血糖检测技术实现了从无创血糖的单次测量,到算法预测过高/低血糖风险发生趋势,再到辅助闭环人工胰岛的发展。目前无创设备临床应用主要涉及以下层面。
据报道,GlucoBeam™在健康人群中进行的一项真实世界研究结果显示CEG网格A区67.2%,B区29.7%,满足ISO15197:2013的规定[12]。德国NIRLUS Engineering AG公司基于近红外光和超声波原理研发的NIRLUS©设备在健康成年男性试验数据同样显示CEG分析数据可观(93.6%A+6.4%B)[13]。而在糖尿病人群中,由于患者血糖偏高/偏低或是波动较大,开展的多项临床试验中无创设备的准确度均欠佳。BICO Inc.公司基于MIR/NIR原理研发的Diasensor血糖检测仪,在糖尿病患者体内进行临床试验,提示其与传统生化法测量误差达25%[14]。我国博邦方舟公司临床试验显示其检测结果与静脉血检测结果相比,94.5%测量值落在CEG网格A和B区,与指尖血一致性为94.4%[15]。Sugar Beat©无创CGM设备即采用RI原理,据悉该设备已在欧盟获上市许可,在糖尿病人群中其MARD值约为8%~17%,可达到微创CGM水平[16]。与常规指尖血糖相比,NovioSense设备在6例1型糖尿病患者数据示共计95%CEG落在A和B区,其中A区占70%[17]。有毫米波微波传感器设备在20例1型糖尿病人群中进行测试,与指尖血相比,CEG网格中仅有87.5%测量数据落在A区和B区,其中A区仅占35.2%[18],远不及ISO 2013标准的规定。
临床上糖尿病的诊断是通过有无典型临床症状及静脉血浆血糖或标化的HbA1C来进行诊断,均为有创采血手段。非侵入性无创血糖测量手段在人群中大规模筛查高血糖似乎有着一定的应用前景。联合易于采集的体液、非侵入性的检测方式、非酶法测量节约一次性耗材成本等特点,人群中筛查高血糖高危人群有着较大的发展空间。
近年来无创设备的临床研究大多在健康人群中进行,为在人体环境内测试不同血糖范围下无创技术测量的准确度,多采用葡萄糖钳夹技术和口服葡萄糖耐量试验(OGTT)进行测定。应用TensorTip设备选用标准餐OGTT,对健康受试者及1型糖尿病、2型糖尿病进行血糖测定得到可观的结果[19]:100%的数据(96.6%A区+3.4%B区)位于CEG网格A和B区,该无创设备的MARD值约为14.4%。此外,也有研究在健康人群中开展OGTT,CEG网格A+B区比例可达到97%~100%[20,21]。Wizmi™设备在32名健康孕妇中开展了一项前瞻性临床试验[22],其OGTT结果显示,与静脉血浆血糖相比CEG网格100%数据可满足临床需要(93%A+7%B区),MARD值为7.23%或9.66 mg/dL。同时,当血糖超过180 mg/dL(即10 mmol/L)时,94.7%的测量值均在±15%或15 mg/dL范围内,而在整体测量范围40~300 mg/dL区间内,该比例仅为86.6%;提示其在检测高血糖时准确度较高。
相比高血糖,血糖的剧烈波动以及严重的低血糖事件危害更大。及时发现低血糖的重要性不言而喻。在一项纳入35例糖尿病患者为期60 d的临床试验中,使用基于拉曼光谱技术测量间质液葡萄糖浓度,结果显示MARD为25.8%,CEG网格A+B区共93%[23],其性能接近当前侵入式血糖检测设备,同时校准周期>10 d,可以在无需监督、无人校准的情况下稳定运行。有研究表明在检测精度范围为3.89~24.4 mmol/L时CEG可实现100%落于A+B区,但是在低血糖范围内准确度明显降低[19]。此外,GlucoTrack在糖尿病人群中进行的临床试验数据显示,CEG网格A区和B区测量值约98%,MARD值约22.3%[24,25],但是该设备在病程长(病程≥15年)以及血糖控制较差(HbA1C>7.5%)的患者中检测一致性略下降。现今随着临床试验从健康受试者扩展到糖尿病人群,发现同样存在低血糖情况下检测不准确这一问题[26],距离实际应用相差甚远。
无创血糖检测基于交叉学科的迅猛发展,为未来糖尿病管理模式提供了更多的可能。对于临床医生,云端传输为医疗提供更全面、连续的血糖数据,更好地参考院外患者血糖自我血糖监测结果调整降糖方案。对于患者而言,无创能极大限度地帮助患者克服反复有创采血的的心理负担,提高血糖监测的依从性。对于医疗卫生系统,未来无创联合人工智能有助于院内院外血糖管理一体化,提高血糖达标率,降低糖尿病并发症,减少医疗经济成本。现今无创血糖检测原理日趋成熟,但仍未见商业化生产的仪器在糖尿病患者身上得到满意的临床试验结果。主要原因包括人体结构的特殊性、糖尿病患者病变特点以及实验原理的限制等,实现大规模临床应用仍需把握以下几个方面:测量精度、可重复性、仪器成本及体积。
在特定范围内仪器测量血糖值准确性较高,例如正常空腹血糖水平介于3.9~6.1 mmol/L(约70~110 mg/dL),在该范围内无创血糖检测值与静脉血糖检测值之间偏差较小。但是在测量极端值时误差较大,特别是低血糖情况下,而且糖尿病患者低血糖的及时发现极为重要。最新一项meta分析显示,现今微创/无创血糖检测与毛细血管血糖或静脉血糖相比,不足以准确检测低血糖以及准确反映血糖变化的趋势。在体外80~500 mg/dL范围内,若浓度波动较小,无创设备也可能测量精确度较差乃至无法检测到[27],在人体复杂环境内检测精度则更难达标。
(1)慢性改变:糖尿病患者病程长者会出现血管微循环障碍,外周神经病变严重。例如糖尿病患者皮肤胶原蛋白纤维结构会发生改变,上述改变与HbA1C值相关[28],而这些结构的差异可能会引起反射光线的不同[3],光学法测量血糖受皮肤状态、环境条件的变化如温度等改变影响较大,精确度难以满足临床需要[29]。因此对测量设备光源的选择及光谱采集系统要求极高。(2)急性血糖波动:急性高胰岛素血症或急性高血糖患者虽然内皮功能及血管通透性正常,但血管舒张,全身血流动力学会发生急剧变化[30],血管舒张导致的局部血流量增加。血流灌注情况会导致光吸收增加从而导致测得的血糖值偏高[3]。目前大多无创技术选择间接测量组织液、泪液、房水等方法来反映血糖值,上述体液与血糖之间存在一定的延迟,特别是在急性血糖波动情况下需考虑是否会导致测量偏差[3]。
人体属于复杂的生命体,心脏搏动、血液循环等生理现象将会引起血流容积的周期性波动,血流容积这种时变性特征将引发人体近红外光谱中吸光度的改变,并对测量结果产生明显影响[5]。人体血糖测量不同于单质葡萄糖溶液浓度的测量,成分的复杂性会对检测造成干扰。不同个体之间组织特征存在较大差异,即使血液成分完全相同,也会对透射光谱造成很大的差异,这将增加从人体光谱中提取血液成分信息的难度。
设备的便携性在实现糖尿病患者院内外信息整合,提高血糖控制达标率起到重要作用。无创设备在实验室研发阶段增加仪器测量准确度是体积不受限制,但是在临床应用角度,可穿戴设备实现便携和数据传输、交互至关重要。现今大多血糖测量设备都是通过对比有创血糖值数据,后期算法等建模完成无创血糖值的实时测量,对于人工智能建模能否满足血糖急剧变化下的测量精度有待进一步验证。此外,考虑到个体生理状态改变对血糖值的影响,测量设备应考虑建模的周期以及单次建模所需有创值数量。若建模需大量有创血糖值,前期通过大量的有创数值建立合适的算法用于后续无创测量,特别是检测频率较低的人群,此种类型的"无创"则意义不大。
无创血糖测量若基于单一技术原理,其血糖检测灵敏度和准确性受限,但是多技术原理组合会增加成本以及设备体积。目前大部分较为成熟的无创设备可以很好地筛查出高血糖人群,但是在精确测量极端血糖值以及实现实时反映血糖变化趋势方面难度较大[31];现今可穿戴设备在健康人群中CEG网格分析及MARD结果均理想,但是缺乏在糖尿病人群的测量数据,或是糖尿病人群中检测的灵敏度及准确度并不能达到临床应用需要。
随着人工智能及传感器领域蓬勃发展,微创CGM商业化设备已上市,大多通过实时测量组织间液葡萄糖浓度,并联合远程血糖检测系统实现了糖尿病患者血糖的实时跟踪、院内院外一体化高效管理,增加了血糖控制达标率,降低其并发症的发生率[32,33,34]。目前更多的研究致力于开发无创可穿戴设备,并联合机器学习以实现糖尿病患者多参数实时测量及预测功能。
糖尿病人群数量庞大且不断增长,未来无创血糖检测领域研究及应用任务重大。尽管基础研究已取得很大的突破,也有研发设备在健康人群体内表现出良好的性能满足临床需求,但是仍缺乏大样本糖尿病人群的临床试验数据。临床实际应用受到传感器成本、使用寿命;测量准确度及检测部位相较于血液测量是否存在滞后性等限制。红外光谱法及微创CGM也是目前投入研究最多的检测技术。开发可满足糖尿病人群特征性改变的可穿戴设备仍面临巨大挑战,随着光学、计算机、传感器和医学等学科领域的不断深入与融合,相信未来可开发出满足临床需求的无创血糖测量设备,这将提高糖尿病患者的生活质量。
所有作者均声明不存在利益冲突



























