
Léri-Weill软骨骨发育不良(Léri-Weill dyschondrosteosis,LWD)是由于SHOX基因的单倍体不足导致,具有典型的三联征:肢体中部短小、身材矮小和手腕部马德隆畸形,还包括体重指数增高等临床特点。而身材矮小和体重指数增高既是代谢综合征、2型糖尿病、心血管疾病的危险因素,也是自身免疫性甲状腺疾病的危险因素。但成人LWD患者的代谢紊乱以及甲状腺疾病尚未得到充分关注。本文报道2例成年就诊于内分泌代谢科的LWD患者,通过介绍其临床特点,基因类型,诊断方法和治疗过程,加深临床医生对LWD的认识,提高识别和诊断能力,并关注患者的代谢性疾病和甲状腺疾病的伴随情况,以期达到早期预防和治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Léri-Weill软骨骨发育不良(Léri-Weill dyschondrosteosis,LWD,OMIM#127300)以"肢中部(mesomelic)"短小、身材矮小和手腕部马德隆(Madelung)畸形的三联征为特征表现,通常由位于性染色体拟常染色体区域1(PAR1)的矮小同源盒基因(short stature homeobox-containing,SHOX)单倍体不足引起[1,2]。SHOX单倍体不足的程度不同会使患者表现为单纯特发性身材矮小(Idiopathic short stature, ISS;程度较轻),LWD(程度中等),以及Langer肢中骨发育不良(Langer mesomelic dysplasia,LMD,OMIM#249700;程度严重)这样一个连续的疾病谱[2]。LWD患者尚存在其他临床表现,如小腿腓肠肌肥大、第四掌骨缩短、肘提携角变大、高拱腭、脊柱侧弯和体重指数增加。而身材矮小和高体重指数是2型糖尿病(T2DM)和心血管疾病(CVD)的危险因素[3,4]。我们曾报道过1例合并代谢综合征和自身免疫性甲状腺病(AITD)的成人LWD患者,当时认为成人LWD患者可能是代谢综合征的高危人群,而合并AITD仅是一种偶然[5]。但身材矮小和高体重指数同时也是AITD的危险因素[6],那么,成人LWD患者是否也是AITD的高危人群很值得进一步探讨。
最近我们科室又诊断了1例成人LWD患者,这2例患者都是由于存在内分泌代谢疾病而就诊,因存在LWD的三联征而进一步进行基因检测,最终明确了LWD的诊断。我们对这2例成人LWD患者进行报道,旨在提高临床医师对于此疾病的认识,学会应用Rappold评分对LWD进行鉴别[2],并知晓患者同时可能为代谢性疾病和/或AITD的高危人群,并在临床中对更多的病例进行观察、诊断和早期治疗。
病例1,50岁女性,因2型糖尿病和甲状腺功能减退在内分泌科进行定期随诊。既往儿童时发育正常,虽身材一直偏矮但未予特殊注意,于42岁时诊断为2型糖尿病和甲状腺功能减退,后逐渐发现了血脂异常和高血压。42岁确诊糖尿病时的体重指数为30.7 kg/m2。这次就诊时因前臂及手腕存在着比较明显的马德隆畸形(图1)和身材偏矮而引起了我们的注意。家族中母亲具有类似的体型特征,女儿则身材完全正常。查体:身高151 cm,坐高/身高比值0.556,指间距离133 cm,臂展/身高比值0.88,体重74 kg,体重指数32.45 kg/m2,血压140/90 mmHg(1 mmHg=0.133 kPa)。实验室检查见表1。前臂DR显示马德隆畸形,表现为双侧桡骨缩短和弯曲、尺骨远端脱位(图1E)、腕骨紧凑和腕骨角减小(图1D)。彩色多普勒超声显示甲状腺稍小,左叶结节为0.59 cm×0.45 cm(TI-RADS 4a)。颈动脉彩色多普勒超声显示动脉粥样硬化改变,左侧颈动脉内膜中层厚度为1.5 mm,右侧颈动脉内膜中层厚度为1.1 mm。
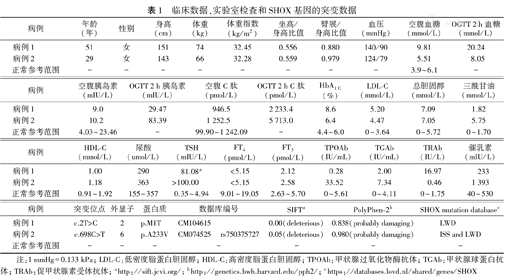
临床数据、实验室检查和SHOX基因的突变数据
临床数据、实验室检查和SHOX基因的突变数据
| 病例 | 年龄(年) | 性别 | 身高(cm) | 体重(kg) | 体重指数(kg/m2) | 坐高/身高比值 | 臂展/身高比值 | 血压(mmHg) | 空腹血糖(mmol/L) | OGTT 2 h血糖(mmol/L) |
|---|---|---|---|---|---|---|---|---|---|---|
| 病例1 | 51 | 女 | 151 | 74 | 32.45 | 0.556 | 0.880 | 140/90 | 9.81 | 20.24 |
| 病例2 | 29 | 女 | 143 | 66 | 32.28 | 0.559 | 0.979 | 124/79 | 5.51 | 8.05 |
| 正常参考范围 | - | - | - | - | - | - | - | - | 3.9~6.1 | - |
| 病例 | 空腹胰岛素(mIU/L) | OGTT 2 h胰岛素(mIU/L) | 空腹C肽(pmol/L) | OGTT 2 h C肽(pmol/L) | HbA1C(%) | LDL-C(mmol/L) | 总胆固醇(mmol/L) | 三酰甘油(mmol/L) |
|---|---|---|---|---|---|---|---|---|
| 病例1 | 9.0 | 29.47 | 946.5 | 2 233.4 | 8.6 | 5.20 | 7.09 | 1.82 |
| 病例2 | 10.2 | 83.39 | 1 252.5 | 5 713.0 | 6.4 | 4.47 | 7.05 | 5.75 |
| 正常参考范围 | 4.03~23.46 | - | 99.90~1 242.09 | - | 4.4~6.0 | 0~3.64 | 0~5.72 | 0~1.70 |
| 病例 | HDL-C(mmol/L) | 尿酸(umol/L) | TSH(mIU/L) | FT4(pmol/L) | FT3(pmol/L) | TPOAb(IU/mL) | TGAb(IU/mL) | TRAb(IU/L) | 催乳素(mIU/L) |
|---|---|---|---|---|---|---|---|---|---|
| 病例1 | 1.00 | 290 | 81.08a | <5.15 | 2.12 | 0.28 | 2.00 | 16.97 | 233 |
| 病例2 | 1.18 | 363 | >100.00 | <5.15 | 2.58 | 33.52 | 7.34 | 0.46 | 1 393 |
| 正常参考范围 | 0.91~1.92 | 155~357 | 0.35~4.94 | 9.01~19.05 | 2.63~5.70 | 0~5.61 | 0~4.11 | 0~1.75 | 40~530 |
| 病例 | 突变位点 | 外显子 | 蛋白质 | 数据库编号 | SIFTa | PolyPhen-2b | SHOX mutation databasec | |
|---|---|---|---|---|---|---|---|---|
| 病例1 | c.2T>C | 2 | p.M1T | CM104615 | 0.00(deleterious) | 0.838(probably damaging) | LWD | |
| 病例2 | c.698C>T | 6 | p.A233V | CM074525 | rs750375727 | 0.05(deleterious) | 0.980(probably damaging) | ISS and LWD |
| 正常参考范围 | - | - | - | - | - | - | - | |
注:1 mmHg=0.133 kPa; LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;TPOAb:甲状腺过氧化物酶抗体;TGAb:甲状腺球蛋白抗体;TRAb:促甲状腺素受体抗体;ahttp://sift.jcvi.org/; bhttp://genetics.bwh.harvard.edu/pph2/; chttps://databases.lovd.nl/shared/genes/SHOX
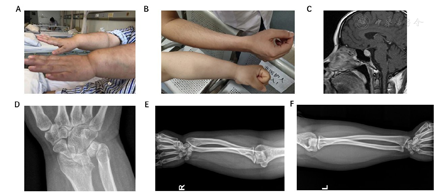

注:A:病例1手腕马德隆畸形;B:病例2的手臂外观;C:病例2垂体增大,视交叉轻微受压;D:病例1腕骨紧凑和腕骨角减小;E:病例1桡骨缩短和弯曲、尺骨远端脱位;F:病例2手臂的X线片
治疗上以饮食、运动等生活方式改善作为基础,药物治疗方案调整为:二甲双胍0.5 g每日3次、阿卡波糖50 mg每日3次、卡格列净100 mg每日1次、苯磺酸氨氯地平2.5 mg每日1次、阿托伐他汀20 mg每日1次和阿司匹林100 mg每日1次用于2型糖尿病、高血压、血脂异常、抗血小板治疗。对于甲状腺功能减退症给予左旋甲状腺素75 μg,每日1次。
病例2,29岁女性,因有3年月经紊乱史而就诊于内分泌科。自幼身材偏矮但未予特殊注意,本次入院后发现有明显的甲状腺功能减退,糖耐量受损。患者母亲62岁,有2型糖尿病和甲状腺功能减退病史。母亲身高140 cm,体重指数为35.16 kg/m2。查体:身高143 cm,体重指数32.28 kg/m2。肢体中部短小和马德隆畸形的特征不如病例1典型(图1B,图1F)。Rappold评分为8分,其中坐高/身高比值为0.559。查体数据和实验室检查也显示在表1中。垂体磁共振成像显示1.4 cm×1.6 cm×1.1 cm的垂体增大,视交叉轻微受压(图1C),这可能与未经治疗的甲状腺功能减退有关。确定诊断为AITD、甲状腺功能减退、高催乳素血症和代谢综合征,包括糖耐量受损(IGT)、血脂异常、脂肪肝和高尿酸血症。
治疗上给予非诺贝特200 mg每日1次和左旋甲状腺素50 μg每日1次,用于治疗血脂异常和甲状腺功能减退症。通过控制饮食和增加运动来改善代谢综合征。1个月后,根据复查结果,将左旋甲状腺素的剂量调整为每日75 μg,第2个月TSH和催乳素水平恢复正常。
基因检测方法和结果:从先证者及其家庭成员的外周血中提取基因组DNA。使用SALSA MLPA P018-E1 SHOX试剂盒(MRC-Holland, Amsterdam, the Netherlands)进行多重连接依赖性探针扩增(MLPA)判断基因片段缺失。用Sanger测序对SHOX基因1-6外显子和外显子-内含子交接区测序。
2例都未发现基因片段缺失。病例1在外显子2中发现杂合错义突变c.2T>c,影响起始密码子(图2B)。在其他3个家庭成员中发现了相同的变异。病例1的女儿未携带突变。病例2在外显子6中发现杂合错义突变c.698C>T,造成p.A233V。病例2的母亲62岁,身材相同,携带相同突变(图2D)。
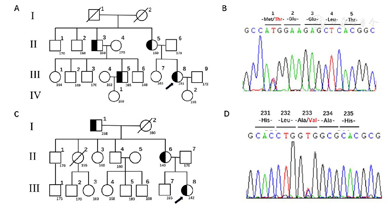

注:A:病例1家系图;B:病例1测序图;C:病例2家系图;D:病例2测序图
SHOX基因是人类生长发育过程中的重要基因之一,其单倍体不足与身材矮小密切相关,如果存在纯合子缺失则可导致具有更严重表型的Langer肢中骨发育不良(LMD),另外Turner综合征(TS)存在X染色体结构异常时也会导致SHOX单倍体不足的相关表型。截止到2021年9月,SHOX基因变异数据库(http://www.shox.uni-hd.de)共收集了519例SHOX基因突变患者信息,包括特发性身材矮小(51.6%)、LWD(38.9%)、LMD(2.1%)、TS(1%)和其他不明确(6.1%)。SHOX缺陷的相关表型在男女比例为1∶4,女性中更为常见和严重。具有典型三联症的LWD患者可在儿童时期被识别,但如果三联征不典型,或临床医师对此缺乏足够认识时,LWD往往会被漏诊。比如本报告中的2例患者,虽然病例1的三联征已较为明显,但确诊年龄仍较晚。由于生长激素治疗可以改善LWD个体的终身高和骨骼畸形,因此在儿童早期识别LWD非常重要。关于提高早期诊断的方法目前推荐使用Rappold评分,尤其是其中坐高/身高比值,臂展/身高的降低反映了中轴骨缩短的特点(表2)。Rappold评分超过5分可以很好地预测SHOX基因缺陷引起的LWD[2]。
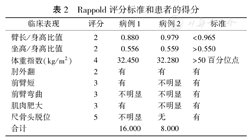
Rappold评分标准和患者的得分
Rappold评分标准和患者的得分
| 临床表现 | 评分 | 病例1 | 病例2 | 标准 |
|---|---|---|---|---|
| 臂长/身高比值 | 2 | 0.880 | 0.979 | <0.965 |
| 坐高/身高比值 | 2 | 0.556 | 0.559 | >0.550 |
| 体重指数(kg/m2) | 4 | 32.450 | 32.280 | >50百分位点 |
| 肘外翻 | 2 | 有 | 有 | 有 |
| 前臂短 | 3 | 有 | 不明显 | 有 |
| 前臂弯曲 | 3 | 不明显 | 不明显 | 有 |
| 肌肉肥大 | 3 | 有 | 不明显 | 有 |
| 尺骨头脱位 | 5 | 不明显 | 无 | 有 |
| 合计 | 16.000 | 8.000 |
SHOX单倍体不足是由SHOX基因杂合缺失(80%~90%的受影响个体)或SHOX基因杂合性突变(10%~20%的受影响个体)引起因此基因检测要同时进行MLPA和SHOX单基因的一代测序。病例1的SHOX基因突变M1T位于外显子2的起始密码子中,ATG(蛋氨酸)被ACG(苏氨酸)取代。根据Kozak规则(GCCAUGG),推测ACG仍然可以启动SHOX蛋白质翻译,但它大大降低了翻译效率,导致SHOX单倍体不足。M1T突变(CM104615)曾在1名意大利(Calabrian地区)女孩中被报道,该患者在6.9岁时因具有明显的身材矮小,腕部马德隆畸形而就诊,在排除了其他造成身材矮小的疾病,如Turner综合征,生长激素缺乏后,经基因检测确诊为SHOX基因缺陷导致的LWD[7]。病例2的A233V突变(CM074525,rs750375727)位于外显子6,该突变曾在1名日本特发性矮小(ISS)患者中被报道,该患者就诊时9.8岁,男性,仅存在身材矮小,没有典型的三联征中的特殊表型,推测其致病性较轻[8]。
成人身材矮小和体重指数增高是胰岛β细胞功能受损、胰岛素抵抗、2型糖尿病和CVD的危险因素。我们报道的这2例患者都存在明显代谢综合征的表现,提示在正确识别LWD患者后,要对其代谢指标进行评价和随访。目前尚无针对成人LWD患者的代谢性疾病进行干预的前瞻性研究,推测与糖尿病前期的人群类似,经过生活方式调整、均衡饮食和适当运动,以及口服二甲双胍进行干预,可能会减轻胰岛素抵抗,延缓发展为2型糖尿病的概率。
2名患者和病例2的母亲都存在AITD,甲状腺功能减退,我们认为并非是SHOX基因突变会直接导致AITD。这是由于SHOX基因的缺陷不会影响X染色体的其余区域,因此与自身免疫性疾病的发生相关性较低(这与Turner综合征影响X染色体范围较大,从而自身免疫性疾病发生率较高不同)。另外由于AITD在人群中非常常见,比如在女性甲状腺自身抗体的阳性率约为10.3%(TPOAb)和3%(TGAb),并且有1.8%患有甲状腺功能减退[9],我们研究所公布的来自中国31个省份的流行病学调查数据也表明,在中国人群中,甲状腺自身抗体阳性的患病率高达20.35%[10]。但LWD和AITD同时存在仅仅是一种巧合吗?有研究表明,显性甲状腺功能减退的危险因素包括年龄、性别、甲状腺疾病家族史和高体重指数,此外,肥胖时的瘦素过量可能增加AITD的易感性[11]。因此,推测LWD患者更有可能因体重指数增加而增加了患AITD和AITD引起的甲状腺功能减退症的概率,但尚需在更多成人LWD患者中进行观察。
由于LWD为先天性疾病,早期诊断并应用生长激素治疗可以显著改善患者终身高[12]。在儿童LWD患者使用生长激素治疗后,他们的代谢性疾病的进展状况尚需进一步的研究。
综上,我们报告了2例因SHOX基因杂合突变而患有代谢综合征、AITD的成人LWD患者。临床医生应根据LWD的三联征和Rappold评分及时识别和诊断LWD患者,并注意成人LWD患者是否因身材矮小和体重指数增高增加代谢综合征、T2DM、CVD和AITD的风险,并及时开展预防和治疗。
所有作者均声明不存在利益冲突































