
2019冠状病毒病已成为全球流行的传染病,2019新型冠状病毒不断出现的突变株则引起了极大的关注。现对各种突变株持续出现的原因及其在人群中的适应过程,以及对疫苗的影响进行阐述。对于突变株,需要阻断其传播和流行,继续加强病毒株监测,在接种疫苗的同时做好公共卫生干预措施。虽然病毒会持续发生变异,但尚未对当前的免疫策略造成明显的突破,疫苗屏障仍是世界开放的关键措施。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2019冠状病毒病(coronavirus disease 2019,COVID-19)是由2019新型冠状病毒(2019 novel coronavirus, 2019-nCoV)感染引起的疾病[1],全球感染者已超过1亿[2]。2019-nCoV为正链单股RNA病毒,属于β冠状病毒属,与严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)的基因组相似性为79%[3]。
病毒感染人群后可能发生变异,传染力强的突变毒株将更有利于在人群中传播。从2020年3月起,2019-nCoV D614G突变株开始不断扩散,传播至北美洲、大洋洲、南美洲和亚洲,截至6月底其在传播毒株中所占比例已超过90%[4],携带D614G突变的病毒株已成为传播的主要基因型。2020年10月底开始出现了几种引起关注的突变体,主要有需关注的变异株(variants of concern,VOC),包括B.1.1.7、B.1.351、P.1系突变株和美国加利福尼亚州流行的B.1.427/429系突变株;有意义的变异株(variants of interest,VOI)是指美国纽约地区流行的B.1.526、B.1.526.1系变异株,尼日利亚首次发现的B.1.525系突变株和巴西发现的P.2系突变株,以及印度首次报道的B.1.617、B.1.617.1、B.1.617.2和B.1.617.3系突变株[5]。这些变种对后续传播的影响和免疫屏障的突破还在进一步研究中。
RNA病毒进入细胞后会快速复制且易出错,而且冠状病毒广泛的宿主性和自身基因组的结构特征使其在进化过程中易发生突变或基因重组,呈现遗传多样性,从而使其中一些突变体可免疫逃逸,甚至难以用疫苗阻断[6]。冠状病毒因RNA依赖性RNA聚合酶的校对功能,故其突变速度可能比其他RNA病毒慢,但S抗原的突变和碱基缺失发生迅速[7]。
D614G突变株的出现被认为来自奠基者效应,在病毒早期进化过程中发生了遗传漂变[8]。VOC和VOI变异的进化来源尚不清楚,但突变株的不断产生表明病毒株仍在人群中广泛存在和传播。B.1.1.7突变株在英国所有病毒株中的占比已超过90%,并且在欧洲多个国家超过50%[9,10],在美国占32%[11]。
不论是动物实验还是人体内的变异都表明,在体内环境下尤其在扩大群体免疫、抗病毒治疗和公共卫生干预策略的选择压力下,病毒能产生适应性突变[12,13]。预测病毒变异进化的轨迹固然重要,但是阻断病毒持续变异的方式,究其根本,仍是阻断病毒传播和流行的手段。
病毒的毒性和传播性是由多个突变积累所带来的,但是B.1.1.7突变株的17个非同义突变是如何进化而来,目前还不清楚。既往在HIV的研究中显示,病毒的流行与人类白细胞抗原有关,各大洲的流行株存在不同突变[14]。2019-nCoV虽然出现了地区性的流行株,但目前看来都存在广泛散播的能力,因此并未发现单一地区或人种特异性的突变特征。
病毒适应性的增加经常会带来传播力的增加,D164G突变株已被报道增强了毒株的传染性[4]。B.1.1.7突变株使传染性增加43%~90%[15],而且其与感染者死亡风险增加61%~64%有关[16,17]。P.1突变株可能增加1.4~2.2倍的传播性[18],B.1.351突变株可能与传染性增加有关[19]。据统计,VOI中的B.1.427/429突变株传染性较其他病毒株高20%左右[20]。B.1.617系变异株的传染性和致病性还有待进一步研究明确。
然而,病毒的适应性并非在任何情况下都代表传染性的增强或致病性的减弱,其与突变本身的作用和功能有关,变异可能会改变病毒的稳定性、传播能力和毒力。经大规模人群分析,D614G突变株感染患者的病死率和临床严重性无明显增加[4];关于B.1.351突变株的研究显示其致死率无明显改变[21];P.1突变株在巴西的致病性尚未明确;B.1.427/429和B.1.526变异株也还未见明确数据。
同时,已有多项研究进行了体内病毒准种和进化的报道。在COVID-19患者使用康复血清治疗后,其体内S抗原迅速出现突变[9]。通常体内变异和免疫逃逸的情况在免疫缺陷患者中更为常见。尽管在固有免疫和适应性免疫的作用下能观测到体内的病毒准种,但是由于强烈的瓶颈效应,大部分准种会在传播中消失[22]。
截至2021年3月,多项研究评价了不同突变株对各种疫苗的抵抗情况。
基于真实世界评价的疫苗保护情况目前已在多个国家进行。对于B.1.1.7突变株,AZD1222疫苗的保护率为70%;对于非B.1.1.7突变株,其保护率为81.5%[23]。在南非2 000多名HIV阴性人群中AZD1222的疫苗保护率为21.9%;但对于B.1.351突变株,其保护率仅为10.4%[24]。对于B.1.1.7突变株,NVX-CoV2373疫苗的保护率为85.6%,但在南非人群中其保护率仅为49.4%[25]。BNT162b2疫苗在南非的试验表明,对于B.1.351突变株,其保护率为100%, 6例B.1.351突变株感染患者均发生在安慰剂组[26]。CoronaVac疫苗在巴西的试验显示疫苗保护率为50.7%;中和抗体转阳数据显示在检测的45名疫苗接种者中,32名(71.1%)对B.1.1.28野生型有中和活性,31名(68.9%)对巴西突变株P.1有中和活性,36名(80.0%)对P.2有中和活性[27]。
利用接种者血清评估假病毒或活病毒的中和活性试验研究较多,见表1。总体而言,对D164G单一突变病毒株的中和活性无明显变化。各类疫苗对B.1.1.7突变株的中和活性比野生株总体下降1~4倍左右,但仍有保护力[23,25,28,29,30,31,32,33,34]。相较于野生株,BNT162b2和mRNA-1273疫苗对B.1.1.351突变株的中和活性下降[30,31,33,34],BBIBP-CorV疫苗和重组疫苗RBD ZF2001对该变异株的中和活性下降1.6倍左右,在8例CoronaVac疫苗接种者血清中基本无中和活性[35]。对于P.1系突变株,BNT162b2、mRNA-1273和ConoraVac疫苗的中和活性下降4~7倍左右[33,34,36]。对于B.1.617突变株,BBV152和BNT162b2疫苗的中和活性分别下降2倍和4倍左右[37,38]。这些研究样本量都较小,一些疫苗还需在更大样本量的研究或真实世界的感染队列中继续验证,还需要继续监测,以评估疫苗保护率。
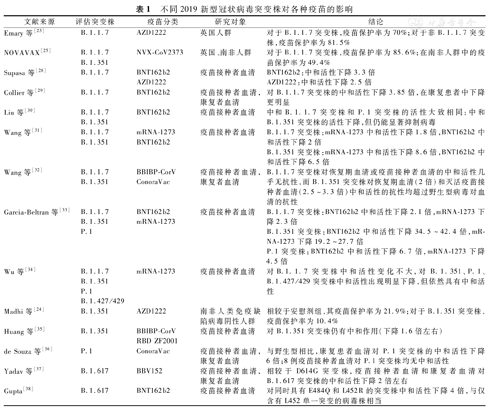
不同2019新型冠状病毒突变株对各种疫苗的影响
不同2019新型冠状病毒突变株对各种疫苗的影响
| 文献来源 | 评估突变株 | 疫苗分类 | 研究对象 | 结论 |
|---|---|---|---|---|
| Emary等[23] | B.1.1.7 | AZD1222 | 英国人群 | 对于B.1.1.7突变株,疫苗保护率为70%;对于非B.1.1.7突变株,疫苗保护率为81.5% |
| NOVAVAX[25] | B.1.1.7B.1.351 | NVX-CoV2373 | 英国、南非人群 | 对于B.1.1.7突变株,疫苗保护率为85.6%;在南非人群中的疫苗保护率为49.4% |
| Supasa等[28] | B.1.1.7 | BNT162b2AZD1222 | 疫苗接种者血清 | BNT162b2:中和活性下降3.3倍AZD1222:中和活性下降2.5倍 |
| Collier等[29] | B.1.1.7 | BNT162b2 | 疫苗接种者血清,康复者血清 | 对B.1.1.7突变株的中和活性下降3.85倍,在康复患者中下降更明显 |
| Liu等[30] | B.1.1.7B.1.351 | BNT162b2 | 疫苗接种者血清 | 中和B.1.1.7突变株和P.1突变株的活性大致相同;中和B.1.351突变株的活性下降,但仍能显著抑制病毒 |
| Wang等[31] | B.1.1.7B.1.351 | mRNA-1273BNT162b2 | 疫苗接种者血清 | B.1.1.7突变株:mRNA-1273中和活性下降1.8倍,BNT162b2中和活性下降2倍B.1.351突变株:mRNA-1273中和活性下降8.6倍,BNT162b2中和活性下降6.5倍 |
| Wang等[32] | B.1.1.7B.1.351 | BBIBP-CorVConoraVac | 疫苗接种者血清,康复者血清 | B.1.1.7突变株对恢复期血清或疫苗接种者血清的中和活性几乎无抗性,而B.1.351突变株对恢复期血清(2倍)和灭活疫苗接种者血清(2.5~3.3倍)中和活性的抗性均超过野生型病毒对血清的抗性 |
| Garcia-Beltran等[33] | B.1.1.7B.1.351P.1 | BNT162b2mRNA-1273 | 疫苗接种者血清 | B.1.1.7突变株:BNT162b2中和活性下降2.1倍,mRNA-1273下降2.3倍B.1.351突变株:BNT162b2中和活性下降34.5~42.4倍,mRNA-1273下降19.2~27.7倍P.1突变株:BNT162b2中和活性下降6.7倍,mRNA-1273下降4.5倍 |
| Wu等[34] | B.1.1.7B.1.351P.1B.1.427/429 | mRNA-1273 | 疫苗接种者血清 | 对B.1.1.7突变株中和活性变化不大,对B.1.351、P.1、B.1.427/429突变株中和活性出现明显下降,但依然具有中和活性 |
| Madhi等[24] | B.1.351 | AZD1222 | 南非人类免疫缺陷病毒阴性人群 | 相较于安慰剂组,其疫苗保护率为21.9%;对于B.1.351突变株,疫苗保护率为10.4% |
| Huang等[35] | B.1.351 | BBIBP-CorVRBD ZF2001 | 疫苗接种者血清 | 对B.1.351突变株仍有中和作用(下降1.6倍左右) |
| de Souza等[36] | P.1 | ConoraVac | 疫苗接种者血清,康复者血清 | 与野生型相比,康复患者血清对P.1突变株的中和活性下降6倍;8例疫苗接种者血清对P.1突变株均无中和活性 |
| Yadav等[37] | B.1.617 | BBV152 | 疫苗接种者血清,康复者血清 | 相较于D614G突变株,疫苗接种者血清和康复者血清对B.1.617突变株的中和活性下降2倍左右 |
| Gupta[38] | B.1.617 | BNT162b2 | 疫苗接种者血清 | 对同时具有E484Q和L452R的突变株中和活性下降4倍,与仅含有L452单一突变的病毒株相当 |
目前,我国在国内防控稳定的基础上对境外输入性病例也有着良好且完善的防控体系,至今流行的突变株均未在我国造成传播。
在国家大力推广疫苗接种的基础上,如果后续出现疫情传播,或有免疫逃逸的突变株使疫苗失去了保护力,则非药物干预措施(non-pharmaceutical interventions, NPI)包括保持社交距离、自我隔离、关闭学校和旅行限制等需加强执行,而且在此之前需完成针对突变株的疫苗改造。英国的模型研究也表明,若仅依赖于疫苗接种,仍无法将R值降至1以下,还是需要NPI的干预[39]。但关于更换疫苗的频率和时间等问题,使疫苗的后续推广变得比其他疫苗复杂[40]。Moderna[41]针对B.1.351突变株设计的mRNA-1273.351疫苗正在美国进行Ⅰ期临床试验。
同时,全球还要继续进行病毒基因组数据的主动监测。在这次疫情中,线上监测和数据共享在疫情防控、预测和候选疫苗设计上发挥了重要作用,如国内中国科学院北京基因组研究所的监测网络(https:∥bigd.big.ac.cn/ncov#progress),美国约翰霍普金斯大学的全球疫情地图(https:∥coronavirus.jhu.edu/map.html),全球共享流行性感冒数据倡议组织(Global Initiative of Sharing All Influenza Data,GISAID)关于病毒株的共享(https:∥www.gisaid.org/),Nextstrain平台(https:∥nextstrain.org/sars-cov-2/)上的进化分析和谱系关系。现阶段研发的疫苗在广泛人群接种后会对病毒施加进化压力,当变异毒株获得适应性之后,会通过免疫逃逸入侵人体的免疫系统。
关于病毒株突变情况下是否需继续接种疫苗,存在很多讨论。目前中和抗体的效价常被用来评估疫苗的效果,但这只是评估疫苗保护力的临时替代终点,关于抗体效价和疫苗保护力关系的重要数据仍在研究之中。中和抗体的下降不代表没有保护力。群体免疫屏障的建立需要疫苗的支持和保护,这一点毫无疑问,而一旦变异株突破成功,则疫苗屏障构建需要再行调整,仍然需要继续接种疫苗。
综上所述,在新发传染病的应对上,虽然不断吸取流行性感冒和严重急性呼吸综合征的历史经验,但还有很多挑战,如病毒会持续变异,不过在防御措施的加强与疫苗的不断更新和保护作用下,世界的开放和恢复仍指日可待。
所有作者均声明不存在利益冲突



























