
甲胎蛋白是诊断原发性肝癌和判断其预后的特异性指标。胃癌中出现甲胎蛋白升高较为少见,在合并乙型肝炎肝硬化的患者中则更为鲜见。本例乙型肝炎肝硬化患者出现甲胎蛋白升高,通过胃活组织检查及免疫组织化学染色最终确诊为胃癌。本例报道为提高临床医师对该疾病的认识,减少误诊、漏诊提供经验参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
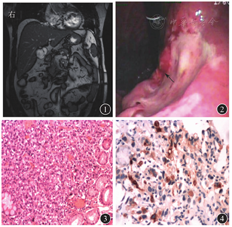
患者男,51岁,因"反复肝区不适12年,加重10 d"于2017年1月17日就诊于山东省泰安市解放军联勤保障部队第九六〇医院(原解放军第八十八医院)。2010年3月16日患者于解放军联勤保障部队第九六〇医院行肝穿刺活组织检查,病理检查结果示:CHB伴肝硬化形成(G2,S4),坚持口服恩替卡韦片(0.5 mg,1次/d)抗病毒治疗7年。患者10 d前无明显诱因下再次出现肝区不适,无食欲不振、乏力,无恶心、呕吐,无腹胀、腹痛。个人史及既往史无特殊。体格检查示:慢性肝病面容,可见肝掌,肝区轻度叩击痛,其他体格检查均未见阳性体征。实验室检查:白细胞计数为6.71×109/L,红细胞计数为6.03×1012/L,血红蛋白为178 g/L,血小板计数为220×109/L;血清HBsAg为阳性,抗-HBs为阴性,HBeAg为阴性,抗-HBe为阴性,抗-HBc为阳性,HBV DNA<5.00×102 IU/mL;ALT为86 U/L,AST为93 U/L,γ-GT为64 U/L,AFP轻度升高(52.56 μg/L)。肝脏超声检查显示:肝脏大小尚可,肝包膜不光滑,肝内光点明显增粗、回声增强,肝实质回声不均质,可见数个结节状高回声散在分布,门脉主干内径约为1.2 cm,提示肝硬化。肝脏MRI检查显示:肝右叶体积略增大,左叶略缩小,肝裂增宽,肝实质内未见异常信号,动态增强扫描肝实质内未见异常强化灶,未发现肝脏占位性病变(图1)。基于上述结果,考虑AFP升高为活动性肝炎所致。住院后经恩替卡韦片(口服,0.5 mg/d)抗病毒,抗乙型肝炎胎盘转移因子注射液(肌内注射,2 mg/d)调节免疫,复方甘草酸苷(静脉滴注,160 mg/d)、多烯磷脂酰胆碱(静脉滴注,10 mL/d)抗炎、保肝等综合治疗15 d后,肝区不适症状缓解,复查肝功能示转氨酶恢复正常,ALT为15 U/L,AST为17 U/L,但AFP水平进一步升高至83.78 μg/L。进一步完善检查,胃镜检查示:胃小弯侧可见3.0 cm×3.0 cm大小的凹陷溃疡,附黄白苔,周围黏膜隆起、充血,考虑胃体癌(图2)。胃活组织病理检查提示:胃体低分化腺癌(图3)。胃癌区免疫组织化学染色AFP呈阳性表达(图4)。随后患者行胃癌切除及周围淋巴结切除清扫术,术后给予2周期XE-LOX方案进行化学治疗,即予奥沙利铂130 mg(第1天)+卡培他滨1 000 mg,2次/d(第1~14天)。术后2周复查AFP水平恢复正常。随访3年余,肿瘤未再复发,AFP水平持续正常。

AFP主要来自胚胎的肝细胞,当肝细胞发生癌变时,血清AFP含量会急剧增加,临床上常规将其作为诊断原发性肝癌的特异性指标。但是,1970年Bourreille等[1]报道了1例胃癌患者出现血清AFP升高,尸检发现患者合并肝转移,由此提出了产甲胎蛋白胃癌(alpha-fetoprotein producing gastric carcinoma,AFPGC)的概念。
AFPGC是指患者血清和癌组织中含大量AFP的胃癌亚型[2],常见于中老年男性,多发生于胃窦部。根据其组织学特点可分为肝样型、胚胎胃肠道型、卵黄囊肿瘤型和混合型,病理结果多为低分化腺癌[3]。关于AFPGC导致AFP升高的机制尚未明确。有观点认为AFPGC是消化系统胚胎发育的重演,在胚胎发育过程中胃和肝脏均由原始的前肠部分衍化而来,胃细胞在基因层面上与肝细胞有着类似的基因表型,在肿瘤发生、发展过程中,某些胃癌可能向肝样分化,使其组织形态可类似HCC[4]。还有观点认为胃癌发生肝转移后,在引起病灶周围肝细胞增殖再生过程中可以产生AFP[5,6]。另有观点认为,AFPGC是一种特殊类型的髓样肿瘤,可自行产生AFP[7]。AFPGC具有高度侵袭性,易发生肝脏和淋巴结转移,易形成脉管癌栓。因此,AFPGC具有生存时间短、预后差的特点,特别是对于肝转移患者[8,9]。目前,世界各地的AFPGC发病率报道不一,日本研究报道为1.6%[9],我国研究报道为7.1%[10]。合并肝病的AFPGC的发病率低,乙型肝炎肝硬化患者合并AFPGC则更少,通过检索万方数据库和PubMed数据库后仅检索到1例相关报道[11]。本例患者既往有乙型肝炎肝硬化病史,主要以肝区不适症状就诊,故收入肝病科诊治,经抗炎保肝、抗病毒等治疗后患者肝区不适症状缓解,复查转氨酶恢复正常,但AFP水平仍升高,与临床不符,进一步行胃镜检查和病理组织检查后及时诊断为胃癌,手术切除后预后良好,进一步支持AFPGC诊断。AFPGC的早期诊断有一定难度,患者确诊时多已处于中晚期,特别是发生肝转移后,诊断难度进一步增大。目前,根治性切除是AFPGC的主要治疗方式,而姑息性切除主要用于远处转移的患者。此外,辅助化学治疗可提高手术效果,但目前尚未建立标准的化学治疗方案。
当临床上遇到AFP升高的乙型肝炎肝硬化患者时,如不支持肝癌诊断,即使患者无明显胃部不适症状,也需要考虑到AFPGC的可能。在无禁忌证的情况下,应尽早行胃镜检查,及早诊治,避免漏诊和误诊。
所有作者均声明不存在利益冲突



























