
败毒梭菌感染引起的自发性气性坏疽少见,但进展迅速,病死率高。现报告1例曾有大肠埃希菌致肝脓肿病史的患者,因败毒梭菌感染致肝脓肿并自发性气性坏疽而迅速出现组织坏死和脓毒血症,虽经积极治疗,仍进展迅猛,最终不治。通过报告本病例以加深临床对致命性气性坏疽的认识,强调早期的识别与治疗,尽可能改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,60岁,因"上腹部疼痛1 d"于2022年6月30日收入盐城市第三人民医院。患者5个月前因"右上腹疼痛1周"在盐城市第三人民医院诊断为"肝脓肿(大肠埃希菌感染)、迟缓埃特菌菌血症"并行肝脓肿引流术,同时发现"升结肠管壁稍增厚,周围渗出",查癌胚抗原为3.10 μg/L,糖类抗原72-4为2.89 U/mL,白细胞计数为15.14×109/L,中性粒细胞计数为14.48×109/L。予抗感染、抗炎、肝素抗凝、足量补液等对症治疗,患者症状好转出院。其余既往史无特殊。患者1 d前无明显诱因出现右上腹部持续性胀痛,无畏寒、发热、恶心、呕吐,就诊于江苏省盐城市第三人民医院。入院体格检查:体温为36.2 ℃,脉搏为116次/min,呼吸频率为18次/min,血压为102/68 mmHg(1 mmHg=0.133 kPa);神志清楚,痛苦面容,皮肤、巩膜黄染,无出血点及皮疹,无肝掌、蜘蛛痣,全身浅表淋巴结未触及肿大;颈软,无抵抗;心、肺未见异常;腹软,右上腹压痛,无反跳痛、肌紧张,墨菲征阴性,肝脾肋下未触及,腹部无包块,移动性浊音阴性。双侧巴宾斯基征阴性。6月29日急诊查上腹部CT示肝右后叶下段占位,肿瘤待排;肝囊肿;结肠肝曲管壁增厚且灶周淋巴结肿大,结肠肿瘤待排(图1A)。入院当天查白细胞计数为2.28×109/L,中性粒细胞计数为2.14×109/L,血红蛋白为80.0 g/L,血小板计数为107×109/L,超敏CRP为229.54 mg/L,降钙素原为18.59 μg/L,纤维蛋白原为5.08 g/L,血肌酐为136.4 μmol/L,血尿素氮为9.03 mmol/L,随机血糖为7.5 mmol/L,总胆红素为10.1 μmol/L。
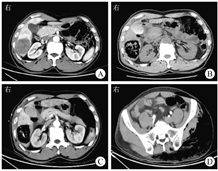

注:CT为计算机断层扫描
为明确肝脓肿病因,于入院当天急诊行肝脓肿穿刺术,复查上腹部CT示肝脓肿并产气进展(图1B)。继续予注射用头孢吡肟(2.0 g,每12 h 1次)静脉滴注,替硝唑氯化钠注射液(200 mL,每天1次)静脉滴注治疗。入院第2天,患者出现左髋部红肿热痛,复查CT示肝脓肿穿刺引流中,左侧臀部、盆部、肌群多发积气,升结肠管壁增厚,周围渗出,腹盆腔少量积液(图1C、图1D)。入院第2天查白细胞计数为5.18×109/L,血红蛋白为75.0 g/L,血小板计数为113×109/L,超敏CRP为229.98 mg/L,纤维蛋白原为6.39 g/L,血肌酐为195.9 μmol/L,血尿素氮为11.47 mmol/L,肌红蛋白>2 000 μg/L,肌酸激酶>12 800 U/L,总胆红素为46.1 μmol/L,癌胚抗原为7.98 μg/L,糖类抗原72-4为8.67 U/mL。考虑产气荚膜梭菌感染可能,给予亚胺培南西司他丁钠(1.0 g,每8 h 1次)静脉滴注、利奈唑胺(0.6 g,每12 h 1次)静脉滴注抗感染等治疗。
患者病情仍快速恶化,7月1日左臀部红肿热痛加重,局部有捻发感,经骨科会诊后立即行左髋部切开引流+负压封闭引流术,术中见左臀部肌肉深部大量坏死液体伴有恶臭气体弥漫,予大量0.9%氯化钠溶液冲洗、负压封闭引流敷料覆盖,并持续负压吸引。左臀部坏死组织涂片革兰染色见革兰阳性芽孢杆菌(图2A),考虑肝脓肿、左髋部气性坏疽、坏死性筋膜炎、急性肾损伤。术后复查白细胞计数为3.41×109/L,血红蛋白为83.0 g/L,血小板计数为41×109/L,超敏CRP为139.91 mg/L,纤维蛋白原为68.60 g/L,血肌酐为174.5 μmol/L,血尿素氮为9.63 mmol/L,肌红蛋白>2 000 μg/L,肌酸激酶>6 400 U/L,降钙素原为58.83 μg/L,脑钠肽前体为21 200 ng/L,IL-6为1 286.21 ng/L,IL-8为149.64 ng/L;血气分析示血钾为6.87 mmol/L,pH值为7.011。考虑感染引起细胞因子风暴,病情迅速发展可能,立即予红细胞4 U、血浆850 mL输注和连续性肾脏替代治疗。患者左臀部红肿仍持续加重并且蔓延至左下肢、阴囊,红肿部位逐渐青紫、散发恶臭。患者于7月2日出现多脏器功能衰竭、血压维持困难,很快出现意识障碍,家属放弃治疗,自动出院,出院后24 h内死亡。
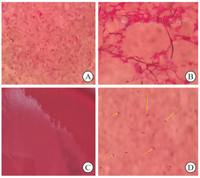

血培养(7月1日采集)双侧双瓶中的2瓶厌氧瓶分别在1.85、1.88 d回报有菌生长。培养物革兰染色涂片见大的细丝状菌(图2B),规范转种于2份血平板,其中1块血平板置于厌氧产气袋中,在35 ℃孵箱培养;另1块置于体积分数为0.05的二氧化碳、35 ℃孵箱中培养。48 h后仅厌氧条件下的血平板薄层迁移生长菌落(图2C),菌落涂片革兰染色见阴阳性杆菌并存,芽孢位于中间或次极端,成"柠檬"形(图2D)。血培养与坏死组织厌氧检出的败毒梭菌均经VITEK2 Compact全自动微生物分析系统(法国梅里埃公司)与VITEKMS全自动快速微生物质谱检测系统(法国梅里埃公司)质谱鉴定,结果一致。
化脓性肝脓肿是一种相对罕见的疾病,常见致病菌有大肠埃希菌、肺炎克雷伯菌、金黄色葡萄球菌和链球菌属[1,2]。败毒梭菌所致肝脓肿非常罕见,Manwani等[1]研究发现86%的败毒梭菌肝脓肿患者合并结肠直肠肿瘤,可能机制是病原菌通过受损的肠黏膜进入血液并播散。Kwon等[3]报道了10例败毒梭菌肝脓肿合并肝脏肿瘤患者,猜测发病机制可能是具有厌氧糖酵解的快速生长的肿瘤为梭菌孢子的萌发提供了相对缺氧和酸性的环境。迟缓埃格特菌是一种专性厌氧革兰阳性杆菌,菌血症的来源主要是胃肠道,其中阑尾炎、憩室炎、结肠癌和腹腔脓肿最常见[4]。本例患者第1次肝脓肿为大肠埃希菌感染所致,血培养结果为迟缓埃格特菌,5个月后第2次肝脓肿为败毒梭菌感染合并败毒梭菌菌血症所致,可能存在共同的诱发因素,而2次腹部CT检查均发现结肠病变且恶性肿瘤可能性大,由此推测:①隐匿性结肠肿瘤导致肠黏膜破坏,定植在肠道的大肠埃希菌、迟缓埃格特菌、败毒梭菌进入肝脏局部或血流,形成肝脓肿。②患者血清肿瘤标志物发生变化,入院5个月前大肠埃希菌致脓肿时,癌胚抗原和糖类抗原均无异常;而发生败毒梭菌致肝脓肿时,两者均呈上升趋势,进一步考虑患者存在隐匿性结肠肿瘤,因感染太过凶险迅猛,病程中未进行活体组织检查,结直肠肿瘤无法明确。此外,非外伤性的败毒梭菌菌血症与不同原因的中性粒细胞减少相关,尤其是累及末端回肠或盲肠的粒细胞减少。通过与患者入院当天的中性粒细胞计数比较,患者此次败毒梭菌感染时,白细胞计数明显低下,而患者首次肝脓肿(大肠埃希菌感染)时中性粒细胞计数明显增高,两者差异非常明显。
败毒梭菌感染临床表现独特,暴发性非常典型,与其自身的各种毒素和酶密不可分。败毒梭菌广泛存在于土壤和动物中,创伤后感染败毒梭菌所致下肢坏疽最常见[5,6]。研究发现,人体内败毒梭菌定植在阑尾部位的比例为10%~67%,正常人粪便中败毒梭菌的检出率为2.8%[7]。本例患者肝脓肿引流后发现左髋部红肿,很快呈现皮肤发黑发紫,躯干部肌肉组织坏死,有捻发感伴恶臭,虽经积极抗感染及切开引流+负压封闭引流+连续性肾脏替代治疗,但病情仍急剧恶化,很快出现多器官功能衰竭,由于感染涉及躯干与内脏器官,难以清创,并伴菌血症和血管内溶血,气性坏疽很快进展为休克、多脏器功能衰竭,并于24 h内死亡,其临床表现与Lee等[8]报道一致。发病机制可能是败毒梭菌产生多种外毒素和酶(胶原酶、透明质酸酶、纤维蛋白溶解酶和脱氧核糖核酸酶等),其中α外毒素是主要的致命毒素,可造成溶血、肌肉坏死、组织水肿;而酶具有强烈的促进糖和蛋白质分解作用,可导致机体产生大量的不溶性气体,使组织积气。机体吸收大量外毒素可引起严重的毒血症,直接侵犯心、肝、肾等脏器,造成多脏器功能衰竭[5]。
通过本病例资料观察到败毒梭菌致肝脓肿、自发性气性坏疽及感染性休克恶化、进展迅速,对厌氧菌菌血症进行积极的病因彻查及各种标本的培养与涂片检查对其精准诊疗非常重要。临床疑有气性坏疽时,一旦发现革兰阳性芽孢杆菌,应立即启动抗感染治疗,治疗应首选大剂量青霉素(180万~240万U/d)和克林霉素,如对青霉素过敏可选择甲硝唑、多西环素和万古霉素[5]。多种抗菌药物联用以同时覆盖革兰阴性菌,直至获得病原微生物结果后再行调整,必要时切除坏疽部位并进行彻底清创和高压氧治疗。
所有作者均声明不存在利益冲突



























