
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌(colorectal cancer, CRC)是我国常见的恶性肿瘤。在西方发达国家,CRC的发病率居恶性肿瘤的第2~3位。随着国人生活水平的不断提高和饮食习惯的变化,我国CRC发病率亦逐年升高,已跃居第3~5位,特别是大城市的增幅更快。结直肠腺瘤(colorectal adenoma, CRA)是CRC最主要的癌前疾病[1,2,3]。通常认为结直肠肿瘤主要包括CRC和CRA。
国内外学者和医师十分重视对结直肠肿瘤的筛查,后者为结直肠肿瘤的早期诊断提供了基础和保证。一般主要依靠粪便隐血试验(fecal occult blood test, FOBT)、内镜(包括全结肠镜和乙状结肠镜)以及一些影像学和实验室检查。随着共聚焦激光内镜、窄带内镜(narrow band imaging, NBI)、放大内镜和色素内镜等技术的发展,内镜下识别扁平腺瘤的水平不断提高。而内镜下黏膜切除术(endoscopic mucosal resection, EMR)和内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)的开展,亦为结直肠肿瘤的早期治疗带来了极大的方便。内镜摘除腺瘤可有效预防CRC的发生,但摘除后腺瘤的高再发率(recurrence),亦给临床随访工作带来了诸多不便,且使预防效果变得不容乐观。由此要求我们分析影响再发的因素,制订随访方式和相应的间歇期,并探讨应用各种化学预防手段的可行性与具体时机。
目前国际通用的针对结直肠肿瘤的相关共识包括美国消化病学会和内镜学会(AGA/ASGE)共同制订的指南[4]和亚太胃肠病学会共识指南[5,6],国内尚缺乏相应涵盖筛查、早期诊治和综合预防等内容的共识意见。为此,由中华医学会消化病学分会肿瘤协作组主办、上海交通大学医学院附属仁济医院消化学科暨上海市消化疾病研究所承办的《中国结直肠肿瘤筛查、早诊早治和综合预防共识意见》研讨会于2011年10月14~15日在上海召开。来自全国各地的消化病学专家对共识意见草案进行了反复讨论和修改,并以不记名投票形式通过了《中国结直肠肿瘤筛查、早诊早治和综合预防共识意见》(表决选择:1,完全同意;2,同意,但有一定保留;3,同意,但有较大保留;4,不同意,但有保留;5,完全不同意。如果通过1的人数>2/3,或通过1+2的人数>85%,为通过条款)。全文如下:
随着国人饮食结构的改变,CRC新发病例日益增多。资料显示,2007年全国肿瘤登记地区CRC发病率(粗率)较2003年升高,男性由25.6/10万升至32.5/10万,女性由22.7/10万升至26.7/10万。CRC死亡率亦明显升高,男性由12.3/10万升至15.6/10万,女性由11.1/10万升至12.7/10万[7]。
国际上,不少学者对CRC和CRA的流行病学情况进行了调查。欧洲学者曾以全结肠镜筛检917名50~75岁平均风险人群,结果示CRA、进展性CRA(定义详后)和CRC的发生率分别为21.3%、6.7%和1.2%;对183名40~49岁人群的筛查结果分别为9.8%、1.1%和0%[8]。对有腹部症状的3121例50~75岁美国患者的全结肠镜检查发现,7.9%的患者为>1 cm的绒毛状CRA,1.6%为伴高级别上皮内瘤变的进展性CRA,1%为侵袭性CRC[3,9]。另一组学者对1256例肠镜检查无息肉者随访5.3年后发现,16%的患者出现CRA,1.3%出现进展性CRA,但未发现CRC[10]。国内多中心回顾性研究证实,20年来我国城市居民有腹部症状而行全结肠镜检查者(共157 943名,其中1991~2000年26 026名;2001~2010年131 917名)中,进展性腺瘤的检出率呈明显上升趋势(P<0.01),较前增长了1.88倍;同期CRC检出率虽有所增长,但仅较前增长了66%[11]。有研究报道,>50岁者的腺瘤发生率明显增加[11,12]。
进展性腺瘤或称高危腺瘤(advanced adenoma)的危险性较高。具备以下3项条件之一者即为进展性腺瘤[8,9]:①息肉或病变直径≥10 mm;②绒毛状腺瘤,或混合性腺瘤中绒毛样结构>25%;③伴高级别上皮内瘤变者。
CRC是发生于黏膜上皮的恶性肿瘤,包括原位癌、浸润癌和转移癌。
根据最新的世界卫生组织(WHO)定义,CRC是指穿透黏膜肌层且浸润至黏膜下层及其以下的结直肠上皮性肿瘤。该定义强调了CRC诊断须有解剖学证据。尽管在形态学上己确定为恶性,但如尚未突破黏膜肌层则不能采用"癌"或应避免使用诸如"癌"一类的术语[13]。鉴于目前我国临床工作中仍沿用原位癌等概念,故建议暂不使用、但需逐渐过渡为WHO的最新概念。
CRC分为5个组织学亚型,即腺癌、腺鳞癌、梭形细胞癌、鳞状细胞癌和未分化癌;对黏膜活检标本而言,主要是判断良恶性病变。
腺癌包括筛状粉刺型腺癌、髓样癌、微乳头癌、黏液腺癌、锯齿状腺癌和印戒细胞癌6种变型。其他类型癌包括富含潘氏细胞的乳头状腺癌、绒癌和透明细胞癌等,均十分罕见[13,14]。在观察病理组织学方面,应注意侵袭与转移迹象,即血管、淋巴管和神经侵犯以及环周切缘情况。"肿瘤芽"的出现与侵袭性有关,应予以描述[15,16,17,18]。淋巴结一般检出不能少于12枚[18,19]。
需结合形态学和分子学特征确定CRC的组织学分级,一般分为3个级别。
既往分类方法中将未分化癌划分为第4级,是指肿瘤具有上皮样形态特征但无明显腺管形成、黏液产生或鳞状分化、神经内分泌分化和肉瘤样分化,其中部分属高频微卫星不稳定(MSI-H),生物学行为上应属于低级别[13](表1)。
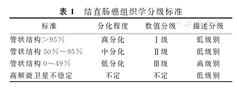
结直肠癌组织学分级标准
结直肠癌组织学分级标准
| 标准 | 分化程度 | 数值分级 | 描述分级 |
|---|---|---|---|
| 管状结构>95% | 高分化 | Ⅰ级 | 低级别 |
| 管状结构50%~95% | 中分化 | Ⅱ级 | 低级别 |
| 管状结构0~49% | 低分化 | Ⅲ级 | 高级别 |
| 高频微卫星不稳定 | 不定 | 不定 | 低级别 |
有条件的单位,可考虑将肿瘤增殖相关指标或蛋白分析和微卫星不稳定(MSI)筛选列入备选检查。
前者包括Ki67、p53、p21ras、EGFR、BRAF和PTEN,后者包括MLH1、MSH2、MSH6和PMS2免疫组织化学检测。在CRC靶向治疗中,应用EGFR单克隆抗体类药物须检测是否存在K-ras突变[13,19]。
建议应用美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)CRC TNM分期系统(2009年第7版)对CRC行病理学分期(表2)。

结直肠癌临床分期
结直肠癌临床分期
| 期别 | T | N | M | |
|---|---|---|---|---|
| 0 | Tis | N0 | M0 | |
| Ⅰ | T1, T2 | N0 | M0 | |
| Ⅱ | T3,T4 | N0 | M0 | |
| ⅡA | T3 | N0 | M0 | |
| ⅡB | T4a | N0 | M0 | |
| ⅡC | T4b | N0 | M0 | |
| Ⅲ | 任何T | N1,N2 | M0 | |
| ⅢA | T1-2 | N1 | M0 | |
| T1 | N2a | M0 | ||
| ⅢB | T3-4a | N1 | M0 | |
| T2-3 | N2a | M0 | ||
| T1-2 | N2b | M0 | ||
| ⅢC | T4a | N2a | M0 | |
| T3-4a | N2b | M0 | ||
| T4b | N1-2 | M0 | ||
| ⅣA | 任何T | 任何N | M1a | |
| ⅣB | 任何T | 任何N | M1b | |
注:早期结直肠癌是指原发灶限于黏膜层和黏膜下层者。其中限于黏膜层者为黏膜内癌(包括原位癌),限于黏膜下层但未侵及肌层者为黏膜下层癌。因此TNM分级中的Tis(原位癌)和T1(黏膜下层癌)均属于早期结直肠癌。
原发肿瘤(T): Tx,原发肿瘤无法评价;T0,无原发肿瘤证据;Tis,原位癌,即肿瘤局限于上皮内或侵犯黏膜固有层;T1,肿瘤侵犯黏膜下层;T2,肿瘤侵犯固有肌层;T3,肿瘤穿透固有肌层到达浆膜下层,或侵犯无腹膜覆盖的结直肠旁组织;T4,肿瘤穿透腹膜脏层,或直接侵犯或黏连于其他脏器或结构,其中T4a指肿瘤穿透腹膜脏层,T4b指肿瘤直接侵犯或黏连于其他脏器或结构。
区域淋巴结(N): Nx,区域淋巴结无法评价;N0,无区域淋巴结转移;N1,1~3枚区域淋巴结转移,其中N1a为1枚区域淋巴结转移,N1b为2~3枚区域淋巴结转移,N1c为浆膜下、肠系膜、结肠/直肠周围或周围软组织内有肿瘤卫星结节,无区域淋巴结转移;N2为4枚以上区域淋巴结转移,其中N2a为4~6枚淋巴结转移,N2b为7枚及其以上淋巴结转移。
远处转移(M): M0,无远处转移;M1,有远处转移,其中M1a为远处转移局限于1个脏器,M1b为远处转移至1个以上脏器/部位或腹膜。
结直肠息肉分为肿瘤性和非肿瘤性息肉,前者为腺瘤,属上皮内瘤变范畴。
非肿瘤性息肉包括增生性息肉、错构瘤性息肉(幼年性息肉和黑色素斑-胃肠多发息肉综合征即Peutz-Jeghers综合征)、炎性息肉、淋巴性息肉和黏膜脱垂性息肉(肛管)等。
腺瘤包括早期腺瘤(畸形隐窝灶)、传统腺瘤(管状腺瘤、绒毛状腺瘤、管状绒毛状腺瘤)、锯齿状腺瘤(传统锯齿状腺瘤、广基锯齿状腺瘤息肉、混合性增生性息肉/锯齿状腺瘤)和杵状-微腺管腺瘤等。
通常认为肠道息肉数目100个以上者为肠道息肉病[20,21],包括家族性腺瘤性息肉病(family adenomatus polyposis, FAP)、锯齿状息肉病、Peutz-Jeghers综合征、幼年性息肉病综合征、Cowden综合征、Cronkhite-Canada综合征、炎性息肉病、淋巴性息肉病等。
上皮内瘤变(intraepithelial neoplasia, IEN)是一种以形态学改变为特征的上皮性病变,包括组织结构和细胞形态学改变,伴细胞增殖动力学和分化异常。
该术语于2000版WHO文件记载并引入结直肠,用于描述结直肠浸润前的病变。该病变有基因克隆性改变,有进展为浸润性病变的倾向[13,22]。本质上,上皮内瘤变与之前所称的异型增生(dysplasia)应为同义,可根据程度不同分为低级别和高级别上皮内瘤变。
低级别上皮内瘤变与Ⅰ~Ⅱ级上皮异型增生相对应。高级别上皮内瘤变是组织结构和细胞形态学具有恶性特征的黏膜病变,但无任何间质浸润证据,包括重度(Ⅲ级)异型增生和原位癌。应用上皮内瘤变概念的前提是标本切除完整,且能明确浸润深度。不能将高级别上皮内瘤变作为避免诊断失误的托词,应尽量明确诊断。
我国结直肠肿瘤的筛查目标人群建议为50~74岁人群。
我国结直肠肿瘤的发病率从50岁开始明显上升,75~80岁到达高峰,然后缓慢下降。国外研究[23]建议不必将76~85岁的高龄人口作为CRC筛查目标人群。结合国内情况,将人群筛查最高年龄定位为74岁。
我国人口众多,且CRC发病率正在上升,宜采取初筛发现高危人群,继而行结肠镜检查的筛查方法。
我国人口基数庞大,如采用适龄人群全结肠镜直接检查的方法,可致结肠镜应检人群庞大,无法适应当前的医疗状况。将筛查分成初筛确定高危人群,随后对高危人群行全结肠镜诊断性筛查的方法,可节约大量人力、物力。
筛查方法应包括FOBT、基于高危因素的问卷调查、全结肠镜或乙状结肠镜检查等。
FOBT是目前应用最广泛的筛查方法之一,诊断敏感性为35.6%~79.4%[24,25]。常用检测试剂有愈创木酯法检测试剂、联苯胺显色试剂、金标法免疫试剂、定量抗体免疫检测法等。免疫法粪便隐血试剂优于一般化学法粪便隐血试剂[26],建议至少检测2次。提倡应用"序贯粪便隐血筛检方案" (见附件1)。
高危因素问卷调查是一种简单而经济的筛查方法(见附件2)。基于流行病学病例-对照研究[27]的CRC高危因素调查可发现较多结直肠癌前病变。
直肠指检可发现下段直肠肿瘤,未行肠镜检查的高危人群,建议予直肠指检。目前,全结肠镜是CRC筛查的必需方法,有条件的地区应采用此筛查手段。内镜技术的运用、检查者个人技能、检查时间等均可影响肿瘤检出率[28]。
乙状结肠镜只能检查结肠脾曲远端的肠道,但即使单独使用乙状结肠镜亦能降低人群的CRC总体死亡率[29]。因此不具备全结肠镜检查条件的地区,可考虑行乙状结肠镜检查。
如对人群行持续性干预,筛查周期建议为3年。
采取初筛后行结肠镜检查的筛查方案行人群结直肠肿瘤筛查的地区,与非筛查对照区比较,其人群累积死亡率从第3年开始下降,第4年下降至最低点,随后逐渐上升至第6年;但死亡率与对照区差异无统计学意义。因此欲使筛查区的CRC死亡率持续降低,3年筛查间隔较为合适[30]。
粪便DNA检测、CT模拟肠镜检查等仅作为研究或试验使用,暂不建议用于人群筛查。
粪便DNA检测是指通过检查提取自粪便样本的DNA突变和(或)甲基化,从而提示CRC诊断的方法。CT模拟全结肠镜是指在清洁肠道后,通过腹部高精度CT检查行结直肠数字三维模拟成像,从而诊断肠道肿瘤的方法。上述方法操作相对复杂、检查费用昂贵,且存在假阳性、放射线危害等诸多问题,因此目前暂不建议用于人群CRC筛查[4],但可能有助于早期诊断。
目前CRC早诊早治项目中使用的初筛后行结肠镜检查的筛查方案可作为结直肠肿瘤筛查的参考方案。
初筛后行结肠镜检查的筛查方案的目标人群为50~74岁人群,对目标人群行高危因素问卷(见附件2)[31,32]调查和免疫法FOBT共2次。符合下列任一条者,即为CRC高危人群:① FOBT阳性;②一级亲属有CRC史;③本人有肠道腺瘤史;④本人有癌症史;⑤符合下列6项中任意2项者,慢性腹泻、慢性便秘、黏液血便、慢性阑尾炎或阑尾切除史、慢性胆囊炎或胆囊切除史、长期精神压抑。
对CRC高危人群应予全结肠镜检查,检查发现的所有息肉样病变应取活检行病理学诊断。诊断为腺瘤、CRC、伴高级别上皮内瘤变的其他病变者,应及时治疗。
伺机性筛查(opportunistic screening)[33]也称机会性筛查或个体筛查(individual screening)、个案筛查(case-finding),可以是受检者主动就医,也可以是医师根据受检者的危险水平决定筛查方式和策略。
伺机性筛查是一种基于临床的筛查,通过医院、社区门诊和乡镇卫生院对就诊和体检人群行个体筛查,即对主动体检的健康个体、因其他疾病就诊但有CRC高危因素的个体、无结直肠肿瘤症状的门诊患者,根据个体情况选择筛查方式(直接行结肠镜检查或FOBT初筛,阳性者再行肠镜检查)。这种筛查针对的是个体,目的在于早期检出结直肠肿瘤(包括部分癌前病变),以提高疗效;缺点是无法判断是否可降低某一人群或地区的CRC发病率。
人群筛查(mass screening)也称自然人群筛查(natural population screening)或无症状人群筛查(asymptomatic population screening),是通过标准化方法、以人群为基础的筛查。多数由国家相关部门或组织出面,以各种手段促使符合筛查条件的全部人群(或社区、单位),在某一规定、较短时间内参与筛查。这种筛查的目的是检出早期癌,以提高疗效;更重要的是通过筛查发现癌前疾病,经适当干预,降低人群发病率,起到预防CRC发生的作用。
结直肠肿瘤伺机性筛查可改善患者预后、提高生活质量,同时减轻我国庞大的医疗负担,是适合我国现行医疗制度和国情的筛查模式[34,35]。
我国人口基数大,即便采用费用最低的FOBT、仅筛查60岁以上的人群,粗略估计每年全国性CRC筛查需要180.81亿元。根据中国癌症基金会制定的"中国主要癌症的筛查及早诊早治指南"要求,40岁以上人群须行CRC筛查,其经费需求将是一个天文数字,显然无法为目前的国家财政和医疗保险所承受。其次,国内自然人群CRC筛查研究是临床医务人员的兼职工作,而全国性人群筛查则需大量专职医务人员和专业医疗设施,目前的国家卫生资源、人力资源状况无法满足这种需求。
"伺机性筛查"作为一种基于临床的结直肠肿瘤筛查模式,是在医院、社区门诊、体检中心面向就诊者和体检个体开展的"个体筛查" ,简便、实用、可操作性强,不需特殊经费支持和额外的工作人员,且患者依从性较好,因此可行性较高[35,36,37,38,39,40,41,42]。
循证医学研究已证实FOBT可作为结直肠肿瘤的初筛方法,全结肠镜检查是精查手段。
我国自上世纪70年代开始开展CRC筛查和早诊研究工作。李世荣等[43,44,45,46]于1988年设计了"序贯法粪隐血初筛方案" ,并多次行大规模人群筛查论证。郑树等[47,48,49]对CRC高发现场浙江省嘉善、海宁等地区的调查研究明确了我国CRC的高危因素,并在此基础上建立了"CRC筛查高危因素量化问卷" (见附件2)。
结直肠肿瘤伺机性筛查的实施要点:①社区、医院门诊和健康体检中心均可实施初筛;②筛查方式和策略因人而异;③分为初筛和精查两个步骤。
初筛方法:① FOBT(免疫法);②问卷调查(附件2)。
初筛对象:门诊就医和健康体检者。
精查对象:① FOBT阳性者;②问卷调查判定为高危个体者。
精查方法:全结肠镜检查。
筛查对象按罹患CRC的危险性分成一般个体和高危个体,分别采用不同的策略进行筛查。所有精查对象登记建档、根据后述具体条款定期随访(图1)。
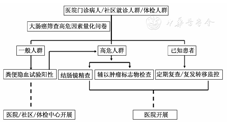

一般个体:门诊和健康体检者常规行FOBT(免疫化学法),阳性者建议行结肠镜精查。
高危个体:作为重点筛查对象,不必拘束于FOBT(免疫法或化学法)结果,建议行结肠镜检查;必要时可行肿瘤标记物检测和(或)遗传学检查。
有以下6项之一者可作为伺机性筛查高危个体:①有消化道症状,如便血、黏液便和腹痛者;不明原因的贫血或体质量下降;②有CRC病史者;③有结直肠癌前疾病者如结直肠腺瘤、溃疡性结肠炎(UC)、克罗恩病(CD)、血吸虫病等;④有CRC家族史的直系亲属;⑤有结直肠息肉家族史的直系亲属;⑥有盆腔放疗史者。
1.遗传性非息肉病性结直肠癌(HNPCC)的筛查策略:筛查对象为符合HNPCC诊断标准的患者和家族中有HNPCC患者的人群。参照家族中致病性突变基因情况进行筛查。
(1)检测发现致病性突变基因的家族:筛查对象行该基因的突变分析,对致病性突变基因携带者或未行基因突变分析者,从20~25岁开始或从比家族中最小发病年龄早10年开始(取较早时间),每1~2年行1次全结肠镜检查,35岁以后每年行1次全结肠镜检查[50,51]。对非突变基因携带者,参照CRC平均风险人群进行筛查。
(2)致病性突变基因未明确的家族:筛检对象行免疫组织化学染色和微卫星不稳定性(microsatellite instability, MSI)检测。①若以上2项均阴性,根据个体情况和家族风险评估筛查;②若至少一项阳性,即免疫组化染色相关蛋白表达缺失和(或)高度微卫星不稳定,则行MLH1和MSH2,亦可追加MSH6和PMS2基因突变分析。若发现致病性突变基因,突变基因携带者或未行基因突变分析者参照(1)进行筛查;若未发现致病性突变基因,则建议患者及其一级亲属参照(1)进行筛查,按致病性突变基因携带者进行筛查(以避免技术原因导致的漏诊),其他家族成员根据个体情况和家族风险评估进行筛查。
2.结肠腺瘤性息肉病(APC)基因相关性息肉病(包括经典的FAP、轻型FAP、Gardner综合征和Turcot综合征等)的筛查,应确诊先证者(首位被发现者)再行筛查。
(1)确诊先证者:①如果患者符合FAP诊断标准或怀疑为APC基因相关性息肉病,应行APC基因测序分析和多重探针连接依赖式扩增(multiplex ligation-dependent probe amplification,MLPA)分析;②如未发现APC基因突变,可行MYH基因分子遗传学检测。
(2)筛查:无症状家族成员存在一定风险,应尽早确认是否携带家族性突变基因。如家族中有确诊患者,但本人经分子遗传学检测未发现可遗传的致病性APC基因突变,则按CRC平均风险人群从50岁开始进行筛查。如APC基因突变为阴性,但家族中又有1例以上非同代亲属患者,应考虑行连锁分析,并根据个体情况和家族性风险,参考第(3)项监测方法进行筛查。
(3) APC基因相关性息肉病患者、无症状致病性APC突变基因携带者、未行分子遗传学检测的家族成员监测方法:①从10~12岁开始,每1~2年行1次乙状结肠镜或全结肠镜检查;一旦发现息肉,则每年1次行全结肠镜检查,直至行结肠切除术。②25岁以后或结肠切除术前行上消化道内镜检查,每1~3年复查1次;③发现十二指肠腺瘤或行结肠切除术前,每1~3年行1次小肠检查(内镜或影像学检查)。
3.Peutz-Jeghers综合征的筛查,包括确诊先证者、前瞻性筛查。
(1)确诊先证者:建议所有Peutz-Jeghers综合征息肉携带者或典型口腔黏膜色素沉着者都行分子遗传学检测[52]。
(2)筛查:对有家族史的无症状成人,需行分子遗传学检测。
(3)监测方法:①胃:上消化道内镜检查,从8岁开始,每2~3年1次。②小肠:内镜或影像学检查,从8岁开始,每2~3年1次;③结直肠:全结肠镜检查,从18岁开始,每2~3年1次。
4.幼年性息肉病综合征的监测,需针对不同部位进行[53]。
(1)结肠:结肠镜检查,15岁以前开始,如发现息肉,每年1次;如未发现息肉,则每2~3年1次。
(2)胃:上消化道内镜检查,15岁以前开始,如发现息肉,每年1次;如未发现息肉,则每2~3年1次。
5.CRC或结直肠腺瘤患者家族中还有其他亲属(1个以上一级亲属,或2个以上二级亲属)患有CRC或相关肿瘤,但不符合目前已定义的任何遗传性结直肠癌的临床诊断标准,则称为"其他家族性CRC" ,应根据患病年龄决定筛查方式[53]。
(1)一级亲属罹患CRC时年龄为50~60岁:从40岁开始行结肠镜检查,每3年1次。
(2) 1例一级亲属罹患CRC时年龄<50岁,或2例以上一级亲属罹患CRC:无论年龄,从40岁或低于年龄最小患者10岁开始行结肠镜检查,根据家族史情况,每3~5年1次。
(3) 1例一级亲属罹患CRC时年龄≥60岁,或2例以上二级亲属罹患CRC:无论年龄,从50岁开始行结肠镜检查,每5年1次。
IBD是CRC发生的高危因素,其中UC癌变的高危因素主要包括全结肠病变和病程超过10年。对此类患者更应重视全结肠镜筛查。
全结肠病变和长期反复炎症是UC癌变的主要高危因素。一般单纯直肠型和左半结肠型UC的癌变率较低。研究发现UC病程10年以上的癌变率为2%、20年以上为8%、30年以上达18%;病程10年以下的癌变率很低[54]。其他高危因素包括合并硬化性胆管炎、年轻时发病、肿瘤家族史等[55,56]。
根据UC癌变高危因素,一般针对全结肠型患者在起病10年后、左半结肠型患者在起病15~20年后,更应重视全结肠镜筛查[57,58,59]。世界最大规模的筛查研究表明,平均5年的受益率达73%,而非筛查组仅为36%[60]。说明针对性筛查有助于降低癌变发生率。尽管如此,针对UC癌变的筛查方案的实施还未广泛开展,有待患者和医师进一步认识筛查的必要性[61]。
根据UC癌变的不同危险度分级,决定全结肠镜筛查的不同间隔时间。
参照欧洲的2011年指南[57],UC相关性CRC的发生分为3个危险度:①低危险度:指全结肠病变但病变趋于稳定或左半结肠病变;②中危险度:指全结肠病变,内镜下明确为轻度活动性炎性反应改变,炎性反应后息肉形成,50岁或之后一级亲属中有CRC病史;③高危险度:指全结肠病变,内镜下明确为中重度活动性炎性反应改变,伴原发性硬化性胆管炎病史,既往5年内有结肠狭窄或任何程度的上皮内瘤变(异型增生),50岁之前一级亲属中有CRC病史。全结肠镜的筛查间隔时间按危险度不同而不同,低危险度人群每5年、中危险度人群每3年、高危险度人群每年行全结肠镜检查。如全结肠镜检查未达盲肠,建议重复检查。
UC患者全结肠镜筛查的主要目的是尽早发现黏膜上皮内瘤变(异型增生)及其相关病灶。为此,必要时可多段多点取活检以提高检出率,或可借助于染色内镜和放大内镜技术。
UC肠道黏膜病变大体上可呈平坦型,也可为增生性息肉样病变,包括异型增生相关性病变或肿块(dysplasia-associated lesion or mass, DALM)。组织学上可以是:①腺瘤性病变;②锯齿状病变;或③绒毛高黏液分泌病变。晚期可有狭窄样病变[62]。其中内镜较难发现平坦型病变。
CD的癌变率接近UC,包括CRC和小肠肿瘤;长期活动性病程是癌变发生的高危因素。累及结直肠的CD癌变筛查方案与UC相似。
UC和CD均可致CRC的发生,两者的癌变率相似。但亦有报道CD癌变率较低[63]。国内未见CD癌变的单中心研究。CD累及结直肠可致肿瘤发生,亦是小肠肿瘤发生的高危因素。累及结直肠的CD癌变筛查方案与UC相似(见以上相应条款)[64]。
参与共识意见起草:房静远,郑树,姜泊,来茂德,房殿春,韩英,盛剑秋,李景南
参与讨论并投票(按汉语拼音排列):迟宝荣,陈东风,陈洁,陈旻湖,陈其奎,陈卫昌,陈晓宇,陈萦晅,丁士刚,段丽萍,房殿春,房静远,樊代明,戈之铮,高峰,郭明洲,龚伟,侯晓华,韩英,金珠,姜海行,吕宾,吕农华,来茂德,李景南,李建生,李淑德,李世荣,李晓燕,李延青,罗和生,林琳,蓝宇,钱家鸣,冉志华,任建林,孙明军,沈锡中,沈祖尧,施瑞华,盛剑秋,韦红,王江滨,王启仪,吴开春,吴小平,许建明,肖冰,萧树东,于成功,于红刚,杨幼林,游苏宁,左秀丽,朱元民,张桂英,张军,张澍田,张亚历,郑鹏远,郑青,郑树,钟捷,诸琦
序贯FOBT即在化学法基础上加做免疫法FOBT。作为CRC初筛手段,化学法和免疫法均可用于CRC筛查(目前绝大多数基层医院仍采用化学法FOBT),建议对无症状人群筛查应用序贯FOBT。
1.健康个体和CRC患者粪便隐血量:一项同位素标记红细胞研究结果示,健康个体每天排便量100~200 g,平均150 g,每天有(0.5±0.4) ml血液进入粪便,即健康个体每天粪便中含Hb 60 mg; 60 mg/150 g粪便=400 μg/g粪便,即健康个体平均每天粪便中的Hb含量为400 μg/g粪便。因此选择此数值作为FOBT阳性阈值可检出绝大部分CRC和少数健康个体。
2.2001年北京15家医院联合应用市售隐血试剂盒行CRC普查,实际普查人数为19 852,阳性992.6人,阳性率为5.6%。501名接受结肠镜检查者,14例发现CRC,即487例(97.2%)为假阳性。假阳性患者中,376例为其他肠道疾病,111例(22.15%)为健康个体,此部分健康个体不应行肠镜检查。可见FOBT的敏感性不可过高。
目前使用的免疫法FOBT的阳性阈值为0.1~50 μg,化学法为50~200 μg,所以化学法初筛可完全达到CRC的筛查要求。加之化学法的价格仅为免疫法的1/4~1/10。因此在行较大人群筛查时,采用化学法可明显节约费用。但由于化学法受食物和上消化道出血的影响,对CRC筛查而言,其假阳性率过高(国人不控制饮食的化学法阳性率高达35.36%,国外仅2%~4%),使后续结肠镜检查量过大,致普查费用和肠镜检查风险较高。对结肠病变而言,免疫法虽然价格较高,但特异性强,为此在化学法阳性的基础上,加做免疫法(大部分化学法阴性者不做),可降低化学法的假阳性率,且较少漏诊结肠出血病变。
如下图装置,采便瓶分为两部分,上端为带有采便棒的粪便容器,下端为另一容器。实验室接收到送来的标本后,分别将粪便放入两个瓶中备查。绝大多数受检者的化学法FOBT为阴性,则丢弃另一容器。若化学法阳性,再行免疫法FOBT(仅5%的筛查者需要做)。


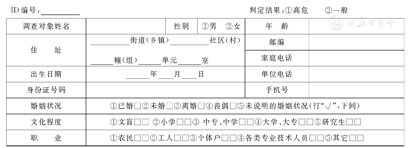
| ID编号:__________ | 判定结果:①高危 ②一般 | ||||
| 调查对象姓名 | 性别 | ①男 ②女 | 年 龄 | ||
| 住 址 | __________街道(乡镇)__________社区(村) | 邮编 | |||
| ______幢(组)______单元______室 | 家庭电话 | ||||
| 出生日期 | ______年____月____日 | 单位电话 | |||
| 身份证号码 | 手机号 | ||||
| 婚姻状况 | ①已婚□②未婚□③离婚□④丧偶□⑤未说明的婚姻状况(打"√" ,下同) | ||||
| 文化程度 | ①文盲□□ ②小学□□③中专、中学□□④大学、大专□□⑤研究生□□ | ||||
| 职 业 | ①农民□□②工人□□③个体户□□④各类专业技术人员□□⑤其它□□ | ||||
说明:请在下述相应的栏目打"√"或填写内容
一、本人有无慢性腹泻史 ①有□②无□
二、本人有无慢性便秘史 ①有□②无□
三、本人有无粘液和或血便史 ①有□②无□
四、本人有无慢性阑尾炎或阑尾切除史
①有□②无□
五、本人有无慢性胆囊炎或胆囊切除史
①有□②无□
六、近二十年来本人有无不良生活事件史
①有□②无□
如有,请打"√" :①离婚□②配偶死亡□③一级亲属死亡□④子女下岗□⑤其他□
七、本人有无癌症史 ①有□②无□③如有,请具体描述□□□□什么癌:□□□□发病时几岁:□□□□诊断医院:□□□□
八、本人有无肠息肉史 ①有□②无□
九、一级亲属(父、母、兄弟姐妹、子女)肠癌史
①有□②无□③不详□
谁:____发病时几岁:____在世与否:____
谁:____发病时几岁:____在世与否:____
谁:____发病时几岁:____在世与否:____
十、吸烟史
连续吸烟的时间:____每天吸烟量:____
十一、你认为重要的其它疾病
调查员签名:____调查日期____年__月__日
十二、粪便隐血检查
第一次FOBT ①+ ②-
第二次FOBT ①+ ②-
调查员签名:____调查日期____年__月__日
备注:
1.慢性腹泻指近2年来腹泻累计持续超过3个月,每次发作持续时间在1周以上。
2.慢性便秘指近2年来便秘每年在2个月以上。
3.不良生活事件史须发生在近20年内,并在事件发生后对调查对象造成较大精神创伤或痛苦。
(未完待续)





























