
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
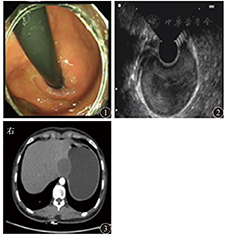
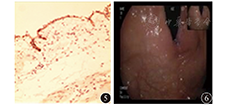
患者女,18岁,因上腹胀6个月于2013年9月23日入院。体检未见明显异常。胃镜检查示胃底近齿状线可见黏膜隆起,大小约3.0 cm×4.0 cm,表面光滑,颜色同周围黏膜(图1),胃镜通过贲门未感明显阻力。超声内镜示胃壁层次结构清晰完整,病变起源于黏膜下层,边界尚清,内部见均匀中等偏高回声,切面大小为3.4 cm×2.4 cm(图2)。胃二期增强CT检查示胃底近齿状线处胃腔外见结节状低密度影,直径大小约3.8 cm(图3),增强扫描边缘轻度强化。在内镜下标记病变后行黏膜下注射,剥离肿物表面黏膜,暴露黏膜下病变,病变触之尚软,表面见纤维膜包裹,切开后见咖啡色黏稠液体流出,充分引流及灌洗后切除部分囊壁送病理检查,并开放囊腔(图4),手术顺利,术后7 d出院。病理诊断为胃黏膜下囊性淋巴管瘤;HE染色见扩张的淋巴管成囊状,并见少许腺体成分及平滑肌组织增生;免疫组织化学检查结果为结蛋白、CD31、CD34、细胞角蛋白(cytokeratin,CK)20、Ki67、H.pylori阴性,特异性淋巴管内皮标志物D2-40(图5)、CK7阳性。术后5个月复查胃镜,未见复发(图6)。

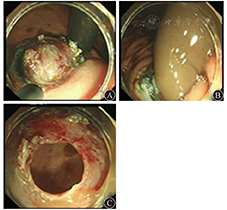


患者男,35岁,因反酸、嗳气伴上腹胀2月余于2012年6月15日入院。体检未见明显异常。胃镜检查示胃窦小弯处有一大小约4.0 cm×3.0 cm的黏膜隆起,宽基底,表面光滑,颜色同周围黏膜,质软。超声内镜示胃壁层次结构清晰完整,病变起源黏膜下层,边界清晰,内部可见多个无回声管样结构,切面大小约3.4 cm×2.5 cm。胃二期增强CT扫描示病变与邻近结构分界清楚,表面光滑,内部为低密度,见不规则纤维分隔,边缘及分隔轻度强化。行外科手术,术中探查胃窦部可触及约4 cm×5 cm的囊性肿物,质软,未突破浆膜,行胃部分切除、毕Ⅰ式胃十二指肠吻合术,手术顺利,术后10 d出院。病理诊断为胃黏膜下囊性淋巴管瘤,HE染色见扩张的淋巴管成囊状,伴平滑肌及纤维组织增生。术后24个月复查胃镜,未见复发。
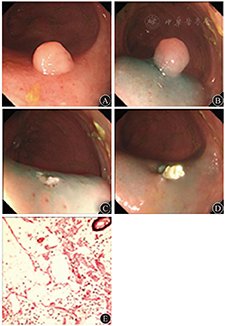
患者男,54岁,因间断腹泻1月余于2012年6月15日就诊。体检未见明显异常。结肠镜检查示距肛缘8 cm处直肠见0.8 cm×1.0 cm的宽基底黏膜隆起,质软,表面光滑,颜色同周围黏膜(图7A)。遂行内镜下黏膜切除术(endoscopic mucosal resection,EMR),见图7B至图7D,手术过程顺利。病理检查为直肠黏膜下囊性淋巴管瘤,HE染色见扩张的囊腔形成及分隔,内衬内皮细胞,并见淋巴细胞及平滑肌成分(图7E)。术后24个月复查结肠镜,未见复发。

患者男,37岁,因间断左下腹痛2月余于2013年5月23日就诊。体检:腹软,左下腹偶有压痛,余未见异常。结肠镜检查示距肛缘20 cm处乙状结肠见1.0 cm×1.0 cm的亚蒂息肉样隆起,色灰白,半透明状,表面光滑,质软。行EMR。病理诊断为乙状结肠黏膜下囊性淋巴管瘤,HE染色见扩张的淋巴管呈囊性,囊壁常见淋巴细胞及肌纤维,内覆内皮细胞。术后12个月复查结肠镜,未见复发。
目前,囊性淋巴管瘤的发生机制尚不明确,多数学者认为是由于先天发育畸形导致淋巴管异常增生扩张,另一种说法是由于某些后天因素如出血、炎性反应、手术、外伤等引起淋巴液回流障碍所导致。胃结直肠囊性淋巴管瘤患者的临床表现多不典型,因肿块的大小、部位不同,表现为腹胀、反酸、恶心、呕吐、腹痛、腹泻等症状,其中因腹胀、腹痛、腹泻就诊最为常见。
胃结直肠囊性淋巴管瘤的体检和实验室检查缺乏特异性表现,而影像学检查对诊断有重要价值。CT和MRI可准确判断病变的位置、大小、形态、范围,以及瘤内容物的性质。根据影像学特点,囊性淋巴管瘤分为单房和多房病变。单房者表现为黏膜下层的圆形或类圆形薄壁囊性病变,多房者其内可见不规则纤维分隔,边界均清楚。CT下囊内密度均匀,CT值为15~20 Hu,少数因囊内出血或存在乳糜液时表现为密度不均匀增高[1]。增强CT下边缘及分隔轻度强化,内部不强化。而MRI则显示为均匀的长T1、长T2信号影,当存在乳糜液或血液时,T1加权像则表现为高信号。研究表明,MRI对病变的内容物和性质的判断效果明显优于CT,因此MRI被认为是目前首选的影像学检查方法[2]。
胃结直肠囊性淋巴管瘤在普通内镜下大多表现为黏膜下肿物,呈灰白、灰黄色,表面光滑呈半透明状,质软,触碰时可变形。在超声内镜下表现为均匀低回声囊性肿物,其内多见分隔,未侵及黏膜肌层[3],存在出血、感染等并发症时可见回声不均匀增强。超声内镜的另一个重要作用是可对病变进行穿刺,抽取液体进行检验或治疗[4]。因此MRI和内镜检查相结合,可准确判断病变的位置、大小、形态、范围,以及瘤内容物的性质,提高术前诊断水平,并可指导临床治疗。但是对于体积较大者,超声内镜对病变边界和浸润深度的判断有一定局限性。
囊性淋巴管瘤需与脂肪瘤、血管瘤、平滑肌瘤等黏膜下病变相鉴别。脂肪瘤患者多出现腹痛、腹胀、腹泻,内镜下多表现为淡黄色的黏膜丘状隆起,柔软,表面光滑,超声内镜示肿块为起源于黏膜下层的均匀高回声肿物。血管瘤患者多因消化道出血、腹部不适就诊,内镜下表面黏膜呈蓝色或鲜红色,偶可见活动性出血,超声内镜见起源于黏膜下层的不均匀低回声肿块。平滑肌瘤在超声内镜下表现为边界清楚的低回声区,内部回声均匀并围以高回声包膜带,是与囊性淋巴管瘤鉴别的重要特征。
病理检查是诊断囊性淋巴管瘤的金标准。HE染色见黏膜下扩张的囊腔形成,多见分隔,内衬内皮细胞,囊壁常见淋巴细胞、平滑肌成分[5]。免疫组织化学染色可进一步明确病变来源。研究表明,D2-40是淋巴管内皮细胞的特异性标志物,但近年来发现,其表达于各种神经血管肿瘤,包括淋巴管瘤、卡波西肉瘤、血管内皮瘤等[6]。除了D2-40,淋巴管瘤内皮细胞的CD31表达率为88%~100%,CD34的表达率为0~57%[7]。因此加做免疫组织化学染色对鉴别诊断具有重要价值。
囊性淋巴管瘤的治疗方法主要有手术切除、穿刺抽吸、硬化疗法。以往外科手术是首选的治疗方式,可彻底切除病变并降低术后复发率。研究统计,囊性淋巴管瘤不完全切除后的复发率为40%,完全切除后的复发率为17%[8]。外科手术会导致正常解剖结构的改变,引起术后感染、进食习惯改变、肠道粘连等并发症。目前认为该病均为良性病变,检索PubMed、Embase等数据库尚未发现恶变的报道,鉴于此病属良性病变,同时由于外科手术切除后复发率仍较高,且会引起相关并发症,所以通过内镜技术治疗胃结直肠囊性淋巴管瘤是优于外科手术的新方法。随着内镜治疗技术的发展,EMR和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),以及超声内镜引导下穿刺引流等技术已被广泛应用于消化道疾病的诊断和治疗。Matsuda等[9]统计了210例结直肠囊性淋巴管瘤患者的病例资料,发现其中肿瘤直径范围为0.5~23.0 cm,平均直径为(2.8±2.1) cm,直径>10 cm者仅3例。因此,有学者认为对于<2 cm的带蒂及亚蒂的凸向管腔的囊性淋巴管瘤,可采取内镜下电圈套和EMR切除[10]。本研究中的例3和例4均采取EMR切除,术后症状明显好转,随访期间未见复发。而对于直径>2 cm或宽基底病变,无法行电圈套或EMR切除时,可根据术前超声内镜和影像学检查结果判断。若病变未侵及黏膜肌层,可首先考虑行ESD完整剥离病变;若病变较大或位置不佳时,可行内镜下肿物切开引流术、超声内镜引导下穿刺引流术等阻止疾病进展,并缓解临床症状。如例1患者,行肿物切开引流术后5个月,复查胃镜未见复发。内镜下治疗方法简便易行、并发症少,若不能完整切除病变或出现复发,明确诊断后仍可再次行内镜下治疗,避免了外科手术对患者造成的创伤。但目前尚缺乏大样本的研究,仍需长期随访,观察远期疗效。
近年来,关于采取硬化疗法治疗位于头颈部、躯干部的淋巴管瘤的研究开展较多。在超声引导下穿刺抽液后,采用平阳霉素、博莱霉素、溶血性链球菌制剂OK-432、纤维封闭剂等进行瘤内注射,促使瘤壁发生炎性反应粘连,使淋巴管道闭塞,缩小肿瘤,可避免外科手术治疗,且术后复发率也较低,尤其是治疗体积较大的囊性淋巴管瘤,效果较好[11,12]。但目前尚无采用该方法治疗胃肠道囊性淋巴管瘤的报道,若将超声内镜引导下穿刺引流术与硬化疗法相结合治疗该病是另一种值得研究的方法。


























