
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃炎是一种组织病理学诊断,是指光学显微镜下所见到的胃黏膜炎性细胞浸润。当各种机制导致胃黏膜损伤但不伴有明显的炎性反应时,应称之为胃病(gastropathy)。H.pylori感染是慢性胃炎最常见的病因,但其他一些损伤因素如乙醇、NSAID和胆汁反流等也会造成胃黏膜的损伤。目前应用最广泛的胃炎分类系统是改良悉尼系统[1]。该系统根据病变的分布、形态学和病因将慢性胃炎分为慢性非萎缩性胃炎、慢性萎缩性胃炎和其他特殊类型胃炎3大类。长期暴露于化学物质如胆汁、乙醇、NSAID等可引起胃黏膜损伤,在组织学上表现为不同程度的小凹增生、黏膜水肿、黏膜固有层肌纤维增生、血管扩张和充血,而炎性细胞浸润并不明显。根据改良的悉尼分类标准,这一类胃病被称为化学反应性胃病,也被称为化学性胃炎、反应性胃炎、C型胃炎等,胆汁反流则是化学反应性胃病的常见病因。也有学者将其作为其他特殊类型胃炎的一种,称为胆汁反流性胃炎(病)。应该指出的是,胆汁反流是胃镜检查时的常见现象,林金坤等[2]研究提示,有相当一部分存在胆汁反流的患者没有典型的反应性胃炎的组织学特征,对于这一部分患者不能诊断为胆汁反流性胃病,而应诊断为慢性胃炎伴胆汁反流。
胆汁反流性胃病最早被用于描述胃大部切除的患者[3]。此后的研究发现胆汁反流性胃病也可见于胆囊切除术后或胆管括约肌切开术后的患者,这两种操作都会造成十二指肠持续地暴露于胆汁中,从而增加胆汁反流的风险[4]。此外,胆汁反流性胃病也可见于未接受过上述操作的患者中,这可能与十二指肠动力异常有关。
胆汁反流性胃病患者可以表现为上腹部烧灼样疼痛,服用抗酸药物不能缓解,也可以伴有口苦、呕吐,呕吐物中混有胆汁。上述这些症状并无特异性,也常见于其他上消化道疾病患者。另外,很多胃镜和组织学上存在胆汁反流性胃病的患者并无明显的临床症状。
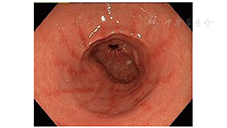
胆汁反流性胃病最典型的胃镜下表现是胃窦或吻合口周围纵行分布的条状红斑(图1),病变以胃窦或吻合口周围最重,近端胃较轻[5]。也可见到其他胃炎的胃镜下表现,如黏膜水肿、充血、糜烂和上皮下出血。但上述胃镜下表现并无特异性,在Chen等[5]的研究中,仅54%有这些胃镜下表现的患者存在胆汁反流。

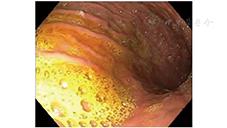
胆汁反流性胃病的另一个特征性的胃镜下表现是可以见到胆汁反流,黏液池呈黄色,黏膜表面附着黄色胆汁,不易用水冲掉(图2)。根据黏液池颜色从清亮、轻、中至深黄或黄绿色分为0、1、2、3级。然而,应当指出的是,胃镜是一种"非生理性"的检查,在检查过程中患者常会出现干呕,因此胃镜检查时所见到的胆汁反流亦可能并不存在于正常生理状态下。

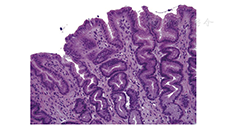
胆汁反流性胃病的组织学表现有以下特点(图3)。①胃小凹上皮的增生,胃小凹变长、扭曲,呈"开塞钻"样改变;②胃上皮细胞再生的改变,表现为上皮细胞呈立方形、核大,缺乏黏液,有时这些改变会与异型增生相混淆;③胃黏膜固有层平滑肌纤维增生、血管充血;④急、慢性炎性细胞浸润不明显;⑤病变主要局限在胃窦或吻合口附近。

Dixon等[6]最早系统描述了上述组织学特征,并提出将胃小凹增生、水肿、固有层平滑肌纤维增生、固有层充血水肿、炎性细胞浸润按0~3分评分,相加所得的总分为Dixon评分,>10分作为诊断胆汁反流性胃病的组织学标准。在Zhang等[7]于2012年发表的研究中,对59例患儿进行了Bilitec 2000胃胆汁反流监测,并与组织学改变对照,发现胃小凹上皮增生与胆汁反流的严重程度相关。2005年,Genta[8]发表综述提出,胃小凹上皮增生、黏膜固有层肌纤维增生、固有层水肿、上皮破坏或糜烂、胃小凹间充血、缺少炎性细胞浸润、缺少或仅有轻度的肠化生这几个组织学特点支持化学反应性胃病的诊断,而明显的炎性细胞浸润和肠化生则不支持诊断。
胆红素是胆汁的主要成分,胆红素在450 nm波长时具有特征性的吸收峰。Bilitec 2000正是利用这一原理,使用直径为1.5 mm的光度计探头测量胆红素特征性的吸收峰,从而诊断胆汁反流。在体外研究中,Bilitec 2000与传统的分光光度计具有良好的一致性,可以反映胃液中的胆红素浓度[9]。在Barrett等[10]的体内研究中,Bilitec 2000也与胆汁反流具有较好的一致性,其特异性很高,但敏感性稍差,大约23%的胆汁反流不能通过Bilitec 2000监测发现。Fein等[11]利用Bilitec 2000评估了345例有上消化道症状的患者和41名健康对照者的胆汁反流,发现胃大部切除术后患者、胆囊切除术后患者的胆汁反流明显多于健康对照者。上述研究提示,Bilitec 2000是诊断胆汁反流的有效工具。
Bilitec 2000监测的主要缺陷在于,有一系列物质会造成假阳性结果,如血红蛋白、卟啉、类胡萝卜素、核黄素,以及许多食物,如番茄、香蕉、甜菜、干酪、胡萝卜、牛肉、茶和咖啡。另外,固体食物也可能会阻挡探头,降低监测的准确性。因此在监测期间,患者需要进食标准化的流食,这也使得监测结果并不能反映患者的日常生理状态。Bilitec 2000监测的另一缺陷是在酸性环境下会低估胆汁反流的程度,这是因为在pH<3.5时,胆红素的吸收峰会向400 nm方向移动。
应当指出,胆汁反流可以发生在生理情况下,相当一部分存在胆汁反流的患者并没有相关的症状或组织学改变。前文所提到的方法主要用于检测胆汁反流的存在,但胆汁反流性胃病的诊断则需要结合临床表现、胃镜检查和组织学改变。
另一项可以用于诊断胆汁反流的技术是放射性核素肝胆显像。这一技术利用99Tcm标记的亚氨基二乙酸(ethyl hepatic iminodiacetic acid,EHIDA)进行静脉注射,使用单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT)在存在胆汁反流的患者中,可以看到放射性核素逆向从十二指肠移动至胃内,计算(胃内最高计数/肝内最高计数)×100%,可以得到十二指肠胃反流指数(duodenogastric reflux index,DGRi)。有研究显示DGRi与胃内胆汁酸浓度高度相关,存在胆汁反流的患者的DGRi明显高于健康对照者[12],提示放射性核素肝胆显像是诊断胆汁反流的有效工具。核素成像的优势在于,与其他方法相比是无创检查。但其主要问题在于,这是一种二维的半定量检测,与小肠或左肝影像的重叠会影响检测的结果。同时,由于胆汁反流是间断发生的,单次核素成像阴性并不能排除胆汁反流的存在。
目前胆汁反流性胃病尚没有公认的诊断标准,需要综合临床表现、胃镜检查和组织学特点来诊断。对于有远端胃大部切除、胆囊切除、胆管括约肌切开术病史的患者,如果胃镜下表现为典型的条状红斑,黏液池呈黄色,黏膜胆染,组织学有明显的胃小凹上皮增生改变而炎性细胞浸润不明显,则胆汁反流性胃病的诊断往往比较容易。对于那些没有手术史、胃镜下或组织学表现不典型的患者,胆汁反流性胃病的诊断则需要排除其他可能引起胃炎或胃病的病因(如H.pylori感染、NSAID等),同时获得胆汁反流的客观证据,结合胃黏膜活组织检查病理组织学特点来确定。胆汁反流的存在可以通过胃镜下看到黏膜胆染、胃液胆盐分析、Bilitec 2000监测或放射性核素肝胆显像等来诊断。


























