
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome,HSOS),又称肝小静脉闭塞病(hepatic veno-occlusive disease,HVOD),是由各种原因导致的肝血窦、肝小静脉和小叶间静脉内皮细胞水肿、坏死、脱落进而形成微血栓,引起肝内淤血、肝功能损伤和门静脉高压的一种肝脏血管性疾病[1,2,3,4]。2002年,DeLeve等[5]基于实验和病理研究发现,建议以HSOS代替HVOD。在近年发表的文献中上述两种名称均有使用。因此,本共识认同HSOS和HVOD可以相互替换[6]。
HSOS/HVOD(以下简称HSOS)临床表现为腹胀、肝区疼痛、腹水、黄疸、肝脏肿大等,常被误诊为巴德-吉亚利综合征(Budd-Chiari syndrome,BCS)、失代偿期肝硬化或急性重型肝炎等疾病,影响对其及时诊断和治疗。HSOS病因较多,但国内外明显不同。欧美报道的HSOS大多发生在骨髓造血干细胞移植(hematopoietic stem cell transplantation,HSCT)预处理后,国内报道以服用含吡咯生物碱(pyrrolidine alkaloid,PA)的植物居多,其中以土三七(或称菊三七)最多[7,8,9]。
目前,国外有关HSOS的诊治共识指南有2013年英国血液及骨髓移植学会HSCT后HVOD(HSOS)诊断和处理指南[10],以及2015年欧洲骨髓移植协作组HSOS/HVOD现状和展望立场声明[11]。此外,在2009年美国肝病学会和胃肠病学会肝脏血管疾病指南[12]、2011年意大利肝病学会肝脏血管疾病推荐意见[13]和2016年欧洲肝病学会肝脏血管性疾病指南[14]中,均有提及HSOS诊治的内容,但国内尚无相关共识。
近些年来,国内报道的因服用含PA植物罹患HSOS病例数量呈现上升趋势,其中相当一部分患者没有得到及时诊断和恰当的治疗,导致预后不佳。为此,中华医学会消化病学分会肝胆疾病协作组于2016年7月讨论决定,基于现有的国内外研究,制订我国吡咯生物碱相关肝窦阻塞综合征(pyrrolidine alkaloid-related hepatic sinusoidal obstruction syndrome,PA-HSOS)的诊断和治疗专家共识;经1年起草,其间1次在武汉、2次在南京组织专家对共识草案反复讨论修改,最终定稿。
本共识采用推荐分级的评估、制订和评价(grading of recommendations assessment,development and evaluation,GRADE)系统对循证医学证据的质量(表1)和推荐意见的级别(表2)进行评估。在形成推荐意见时,不仅考虑到证据的质量,还要权衡干预的利弊与负担、患者意愿和价值观的多样性,以及资源的合理利用、推荐措施的公平性与可实施性等。

推荐分级的评估、制订和评价系统的证据质量及其定义
推荐分级的评估、制订和评价系统的证据质量及其定义
| 证据等级 | 定义 |
|---|---|
| 高质量(A级) | 非常确信估计的效应值接近真实效应值,进一步研究也不可能改变其可信度 |
| 中等质量(B级) | 对估计的效应值确信度中等,其有可能接近真实效应值,进一步研究有可能改变其可信度 |
| 低质量(C级) | 对估计的效应值确信度有限,其与真实效应值可能大不相同,进一步研究极有可能改变其可信度 |
| 极低质量(D级) | 对估计的效应值几乎没有信心,其与真实效应值很可能完全不同,对其的任何估计都很不确定 |

推荐分级的评估、制订和评价系统的推荐强度等级
推荐分级的评估、制订和评价系统的推荐强度等级
| 推荐强度 | 具体描述 |
|---|---|
| 强推荐(1级) | 明确显示干预措施利大于弊或弊大于利 |
| 弱推荐(2级) | 利弊不确定或无论质量高低的证据均显示利弊相当 |
HSOS首先于1953年由牙买加医师Hill等[15]报道,作者分析患者病理改变后认为该病是由于肝内毛细血管阻塞所致,随着疾病的进展最终发展成淤血性肝纤维化,推测病因可能是营养不良或摄入蛋白质少,故称为浆液性肝病(serous hepatosis)。1年后,同为牙买加的医师Bras等[16]报道了5例儿童因食用狗舌草而导致肝大、腹水、黄疸等急性门静脉高压表现的临床病例,并发现了与Hill等[15]研究相同的病理改变,遂采用"HVOD"对该病进行命名,此后HVOD被世界各地医师广为接受。1999年,DeLeve等[17]用野百合碱给大鼠灌胃后发现,该病肝损伤的最早期表现是肝窦内皮细胞损伤、脱落(红细胞进入狄氏间隙),后续才出现一系列继发性损伤。鉴于这些发现,DeLeve等[5]于2002年提出以"HSOS"替代HVOD作为该病的诊断名称。
我国中草药一直被广泛使用。一些含PA的植物,如菊科的土三七、千里光,豆科的猪屎豆,紫草科的天芥菜等,因同样具有止血、止痛等功效,容易与主要产自云南的五加科三七(亦称参三七)相混淆,服用后可能导致严重的HSOS。其中以土三七最常见,五加科三七不含PA,不会引起HSOS。
通过检索300余篇以英文发表的HSOS相关文献,发现西方国家的HSOS患者绝大多数发生在HSCT后,与大剂量化学治疗药物预处理等因素有关;其次也有实体瘤化学治疗、肝移植术后应用免疫抑制剂相关的HSOS报道。我国鲜有骨髓造血干细胞移植相关肝窦阻塞综合征(hematopoietic stem cell transplantation-hepatic sinusoidal obstruction syndrome, HSCT-HSOS)的报道。国内以PA-HSOS为主,其中因服用土三七导致的HSOS占50.0%~88.6%[7,8,18,19,20,21,22]。
推荐意见:①我国HSOS以PA-HSOS为主,PA-HSOS病因以服用土三七最常见;证据等级为A级,推荐强度为1级。
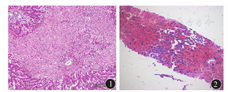
PA-HSOS动物模型的病理改变研究较为详细,而人体病理资料较少。大鼠模型的病理改变包括:最先出现肝血窦内皮细胞超微结构受损,而后肝血窦堵塞的表现逐渐明显,内皮细胞损伤,窦壁破坏;其中,肝腺泡Ⅲ区血窦淤血、肝板结构破坏、肝细胞坏死、小叶间静脉内皮细胞损伤,以及管壁肿胀最为显著[17,23](图1)。造模第6天,一些大鼠肝脏病变恢复接近正常,另一些大鼠肝细胞受损改善,但血窦内、窦周和小叶间静脉内仍有大量胶原蛋白沉积。人PA-HSOS的病理改变与大鼠模型表现高度相似:典型表现为以肝腺泡Ⅲ区为主的肝窦内皮细胞肿胀、损伤、脱落,肝窦显著扩张充血;肝细胞不同程度的肿胀、坏死,红细胞渗入狄氏间隙,肝内小静脉管壁增厚,管腔狭窄、闭塞,无纤维化表现或可见汇管区轻度纤维增生[8,24,25,26,27](图2)。

目前,对于PA-HSOS的发病机制尚不完全清楚。PA属于双环氨基醇衍生物,可分为饱和型和不饱和型,其中饱和型无明显毒性或具有低毒性,不饱和型则具有极强的肝毒性。此外,部分种类PA还可导致肺损伤引起肺动脉高压[28,29,30]。不饱和型PA进入肝脏后,在细胞色素P450酶(CYP3A)的催化下,生成有反应活性的中间代谢物脱氢吡咯,再被水解为脱氢倒千里光裂碱(6,7-dihydro-7-hydroxy-1-hydroxymethyl-5H pyrrolizidine,DHR),易与蛋白质结合形成吡咯蛋白加合物(pyrrole protein adducts,PPAs),从而损伤肝窦内皮细胞[31]。CYP3A的基因多态性、诱导剂和抑制剂均会影响PA的细胞毒性[30]。
肝窦内皮细胞谷胱甘肽耗竭在PA-HSOS发病中起重要作用[32]。野百合碱、脱氢吡咯和DHR对体外培养的肝窦内皮细胞均具有毒性作用,机制是下调谷胱甘肽和形成PPAs[33,34]。动物模型中肝窦内皮细胞谷胱甘肽的降低与内皮细胞死亡相关,经门静脉补充谷胱甘肽具有预防作用[35]。PA-HSOS以肝腺泡Ⅲ区病变为主,可能与该区富含CYP3A和谷胱甘肽S转移酶而谷胱甘肽水平较低相关。另外,基质金属蛋白酶(matrix metalloproteinase,MMP)-9和MMP-2表达上调[36,37],一氧化氮减少[38],以及凝血相关信号通路激活[32]等也参与PA-HSOS的发生。Li等[39]采用蛋白质组学的方法发现,在早期PA-HSOS大鼠体内有48种蛋白质水平改变,其中氨基甲酰磷酸合成酶1(carbamyl phosphate synthetase 1,CPS1)和ATP5β与发病有密切关系,具体机制有待阐明。Harb等[40]的研究表明,骨髓来源的祖细胞能够替代肝窦和中央静脉内皮细胞从而修复损伤,而野百合碱能够抑制骨髓和循环中的内皮祖细胞。由此可见,PA-HSOS的发病机制应包括两方面:①PA对肝窦和中央静脉内皮细胞的直接损伤;②PA对骨髓祖细胞损伤从而阻止内皮细胞修复[41]。
推荐意见:②肝脏是PA损伤的主要靶器官,此外,部分种类PA还会导致肺动脉高压;证据等级为A级,推荐强度为1级。③肝腺泡Ⅲ区肝窦内皮细胞肿胀、损伤、脱落,肝窦显著扩张、充血,是急性PA-HSOS的典型病理改变;证据等级为A级,推荐强度为1级。
PA-HSOS的主要临床表现包括腹胀、肝区疼痛、纳差、乏力、腹水、黄疸、肝大等[42]。患者多数在服用含PA植物后1个月内发病,也可经过较长时间后出现临床症状。体格检查有不同程度的皮肤巩膜黄染、肝区叩击痛、移动性浊音阳性,严重者合并胸腔积液和下肢水肿。一些重度或治疗无效、病情进行性加重的患者可以并发感染(以呼吸系统为主)和(或)肝肾功能衰竭,并可导致死亡。慢性期患者可缺少部分典型表现,或仅表现为顽固性腹水和门静脉高压相关并发症。
大多数患者的血常规没有明显异常,合并感染时有白细胞计数升高,病情严重患者可表现为血小板计数进行性降低。肝功能异常主要表现为血清TBil升高,范围多在17.1~85.5 μmol/L,还可有ALT、AST和(或)ALP、GGT的升高,少部分重度患者或并发门静脉血栓导致肝功能恶化时,血清胆红素显著升高[42]。凝血功能大都正常或仅有PT和活化部分凝血酶时间(activated partial thromboplastin time,APTT)的轻度延长,但D-二聚体升高较常见。腹水性质符合典型的门静脉高压性腹水表现,血清腹水白蛋白梯度(血清白蛋白与同日内测的腹水白蛋白之间的差值)>11 g/L。
有文献报道,PA-HSOS患者外周血均能检测到一定浓度的PPAs,对临床诊断患者是否服用含PA的植物或药物的特异性强。检测方法:采集250 μL血清,采用超高效液相色谱-质谱法定量检测。以脱氢野百合碱与谷胱甘肽反应合成的吡咯-谷胱甘肽复合物7,9-二谷胱甘酰DHR建立标准曲线,所测得浓度是所有PPAs释放的吡咯基团的浓度[3,43,44]。
推荐意见:④PA-HSOS的主要临床表现为腹胀、肝区疼痛、腹水、黄疸、肝大,证据等级为A级,推荐强度为1级。
影像学检查是临床怀疑PA-HSOS时的必查项目。PA-HSOS二维超声的典型表现包括:肝脏弥漫性肿大;肝实质回声增粗、增密,分布不均匀,可见沿肝静脉走行的"斑片状"回声减低区;腹腔积液[45,46,47,48]。彩色多普勒超声的表现是门静脉、脾静脉内径正常,血流速度减慢(<25 cm/s)[48]。超声造影的表现为动脉期呈"花斑样"不均匀增强,门静脉充盈缓慢,肝动脉-肝静脉渡越时间延长[45,46]。
典型CT表现包括[24,25,26,49,50,51]:①肝脏弥漫性肿大,平扫显示肝实质密度不均匀减低;②静脉期和平衡期肝实质呈特征性"地图状""花斑样"不均匀强化,门静脉周围出现的低密度水肿带称为"晕征";③尾状叶、肝左外叶受累稍轻,肝静脉周围肝实质强化程度较高,呈现特征性"三叶草征",肝静脉管腔狭窄或显示不清,下腔静脉肝段受压变细;④通常合并腹水、胸腔积液、胆囊壁水肿和胃肠壁水肿等肝外征象(图3)。急性期患者较少合并脾大、食管胃静脉曲张等征象。
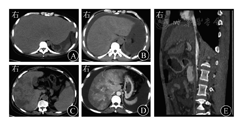

MRI的典型表现包括:平扫表现为肝脏体积增大和大量腹水,肝脏信号不均,3支肝静脉纤细或显示不清;T2加权成像(T2-weighted imaging)表现为片状高信号,呈"云絮"状。MRI动态增强扫描表现为动静脉期不均匀强化,呈"花斑"状,延迟期强化更明显[25,52,53]。
临床上以腹胀、肝区疼痛、腹水、黄疸、肝大等表现就诊的患者,应考虑PA-HSOS的可能性,需详尽采集既往用药史,必要时反复多次询问。有明确服用含PA植物史是PA-HSOS诊断的基础。疑诊患者需完善超声检查,至少包括肝脏、脾脏、门静脉、腹腔积液等项目。超声检查对PA-HSOS的诊断有价值,但过于依赖超声医师的经验和水平。因此,超声仅作为初筛检查,所有患者都应进一步完善腹部增强CT和(或)MRI检查,发现典型征象者,即可确诊为PA-HSOS。同时,需排除其他已知病因引起相似肝损伤的疾病,如BCS、失代偿期肝硬化、感染、酒精性肝损伤及其他药物性肝损伤等。其他如超声剪切波弹性成像技术、超声造影等检查的诊断价值仍需要探索。
对于实验室和影像学检查不典型的疑诊患者,可行肝脏活组织检查(以下简称活检)获取病理支持。若患者合并大量腹水,经皮肝穿刺活检风险较大。此时,有条件的单位可采取经颈静脉肝活检术(transjugular liver biopsy,TJLB),安全性较高[54]。还可联合测定肝静脉压力梯度(hepatic venous pressure gradient,HVPG)评估门静脉高压情况。在HSCT-HSOS的诊断中,国外报道HVPG>10 mmHg(1 mmHg=0.133 kPa)的敏感度为52%,特异度为91%[14]。HVPG也有一定的预后判断价值,HVPG越高者预后越差[13]。
对于临床怀疑PA-HSOS的患者,如无法获得明确服用含PA植物史,可行血清PPAs检测,其具有溯源性诊断价值[2,3]。Gao等[43]的前瞻性研究(包含23例PA-HSOS和17例对照组)显示,外周血PPAs检测诊断PA-HSOS的敏感度为100.0%,特异度94.1%(23/24),阳性预测值为95.8%,阴性预测值为100.0%;PPAs水平越高,预后越差。但是目前能够开展这项检查的医院较少。
目前国际上常用的HSCT-HSOS临床诊断标准主要包括改良西雅图(Seattle)标准和巴尔的摩(Baltimore)标准[10](表3)。但上述标准的敏感度和特异度并不明确,且只针对HSCT-HSOS,未在其他病因的HSOS诊断中得到充分验证[14]。对于PA-HSOS的诊断,目前尚无统一标准,多在一定程度上借鉴Seattle标准和Baltimore标准。一项总结了115例急性PA-HSOS的临床和影像特征的单中心回顾性研究发现,虽然93.91%的患者血清TBil浓度高于正常值上限(17.1 μmol/L),但41.74%的患者血清TBil≤34.2 μmol/L[42]。这一结果提示,如果参照Seattle标准或Baltimore标准中胆红素水平诊断PA-HSOS,会有相当一部分患者不符合其诊断标准。另外,该研究还发现,高达95%以上的PA-HSOS患者有典型的影像学改变:肝大、增强CT平衡期肝脏不均匀强化、肝段下腔静脉受压变细,超声检查发现门静脉和脾静脉血流速度减慢,这些影像学改变在改良Seattle标准或Baltimore标准中没有提及。基于以上事实和国内外文献报道,参照改良Seattle标准和Baltimore标准,本共识推荐PA-HSOS诊断的"南京标准"(表3)。PA-HSOS的诊断路径见图4。
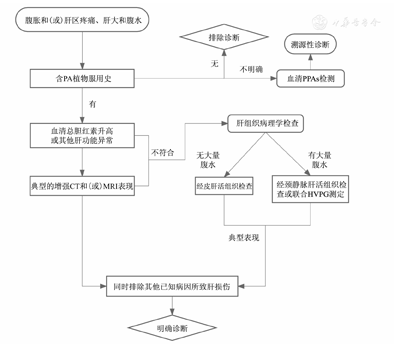

注:PA为吡咯生物碱;CT为计算机断层扫描;MRI为磁共振成像;PPAs为吡咯蛋白加合物;HVPG为肝静脉压力梯度;PA-HSOS为吡咯生物碱相关肝窦阻塞综合征

HSOS的诊断标准
HSOS的诊断标准
| 标准名称 | 适用范围 | 诊断项目 | |||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | ||
| 改良西雅图(Seattle)标准 | HSCT-HSOS | 骨髓造血干细胞移植后20 d内出现以下3项中的2项 | 肝大、肝区疼痛 | 血清总胆红素≥34.2 μmol/L | 腹水或体质量增加超过原体质量的2% |
| 巴尔的摩(Baltimore)标准 | HSCT-HSOS | 骨髓造血干细胞移植后21 d内血清总胆红素≥34.2 μmol/L且有以下3项中的2项 | 肝大伴肝区疼痛 | 腹水 | 体质量增加超过原体质量的5% |
| 南京标准 | PA-HSOS | 有明确服用含PA植物史,且符合以下3项或通过病理确诊,同时排除其他已知病因所致肝损伤 | 腹胀和(或)肝区疼痛、肝大和腹水 | 血清总胆红素升高或其他肝功能异常 | 典型的增强CT或MRI表现 |
注:HSOS为肝窦阻塞综合征;HSCT-HSOS为骨髓造血干细胞移植相关肝窦阻塞综合征;PA-HSOS为吡咯生物碱相关肝窦阻塞综合征;PA为吡咯生物碱;CT为计算机断层扫描;MRI为磁共振成像。通过病理确诊需要有典型病理表现:肝腺泡Ⅲ区肝窦内皮细胞肿胀、损伤、脱落,肝窦显著扩张、充血
在确立PA-HSOS诊断的同时,需考虑病程分期和严重程度分级,因为不同病程时期的临床表现和治疗不尽相同,不同严重程度的患者预后差别巨大。然而,目前对PA-HSOS的病程和严重程度知之甚少,更无简单易用的分层工具。以下参照HSCT-HSOS的标准,是否完全适用还需要进一步研究。根据PA-HSOS病程和临床表现的不同特点,大体上可将其分为急性期/亚急性期、慢性期。急性期/亚急性期:一般指起病3 d至4周以内,患者有腹胀、肝区疼痛、腹水,肝脏迅速肿大、叩击痛,可伴有纳差、恶心、呕吐等症状,绝大部分患者有黄疸。慢性期:病程一般在发病数月以后,以腹水和(或)食管胃静脉曲张破裂出血等门静脉高压并发症为主要表现,与失代偿期肝硬化的临床表现相似[6,17,55]。按疾病程度分为轻度、中度和重度:轻度HSOS具有自限性,不需要治疗;中度HSOS经积极的对症支持治疗尚能恢复;重度HSOS治疗100 d后仍无好转,多合并多脏器功能衰竭,可导致死亡[14]。但该疾病程度分类为回顾性,对临床治疗的指导意义有限。
本病主要应与BCS鉴别,尤其是单纯的肝静脉阻塞型BCS,两者容易混淆;另外,PA-HSOS也较容易被误诊为肝硬化并发腹水、急性重型肝炎等。
BCS是由各种原因的肝静脉和肝后段下腔静脉阻塞,导致肝静脉血流受阻而继发的一类疾病。急性期患者主要表现为肝区疼痛、肝大、黄疸、顽固性腹水和(或)双下肢水肿等。临床上诊断BCS主要依赖影像学检查,超声可见下腔静脉近心端和(或)肝静脉有狭窄或闭塞,常伴有尾状叶肿大、肝静脉间交通支形成、第三肝门开放等特征性表现。病理学在光学显微镜下主要表现为梗阻性淤血性改变,缺少内皮细胞损伤、窦周和小叶间静脉纤维化和胶原蛋白沉积。PA-HSOS时,肝脏肿大压迫下腔静脉造成其狭窄,但肝静脉变细且不具备肝静脉间交通支是其与BCS的重要区别。对于一些诊断困难或者疑似病例还可以通过下腔静脉造影或HVPG测定来进一步明确诊断。虽然BCS和PA-HSOS临床表现相似,但两类疾病的发病机制与治疗不尽相同,因此,鉴别诊断显得尤为重要。
如果忽视了服用含PA植物的病史,急性期/亚急性期PA-HSOS易误诊为失代偿期肝硬化。慢性期HSOS会有类似肝硬化的临床表现,且治疗并无太大差别。但急性期/亚急性期HSOS的表现和治疗与肝硬化有明显不同。HSOS与失代偿期肝硬化的鉴别要点包括病史、病理和辅助检查。失代偿期肝硬化患者起病缓慢,病情迁延数年甚至数十年,患者常有明确的肝炎病毒感染史、长期大量饮酒史或自身免疫病等长期致肝损伤的病因。实验室检查可见转氨酶升高、低蛋白血症、凝血功能异常和脾功能亢进等。超声检查可见肝脏左右叶比例失调、体积缩小、实质回声增粗,门静脉扩张,脾大等。胃镜检查可见食管胃静脉曲张和门静脉高压性胃病等表现。PA-HSOS患者肝脏体积增大、实质回声不均匀,门静脉无扩张,脾脏一般不肿大,急性期患者食管胃静脉曲张常不明显,但胃肠黏膜水肿常见。失代偿期肝硬化患者肝脏病理可发现假小叶形成、中央静脉缺失、纤维组织增生等典型改变。急性期PA-HSOS的典型表现是肝窦扩张伴出血和淤血,肝腺泡Ⅲ区为主的肝板结构破坏,中央静脉内膜破坏和淤血,部分慢性期PA-HSOS患者可以出现广泛的血窦内和窦周围胶原蛋白沉积等病理学改变。
急性重型肝炎是指因大量肝细胞坏死而在起病数天内患者出现肝性脑病、腹水和凝血功能障碍的一种严重肝病,具有起病急、预后差、病死率高等特点。当PA-HSOS肝损伤严重时,临床表现类似,容易误诊。但急性重型肝炎多有明确病因,包括肝炎病毒感染、药物诱导、代谢和自身免疫等原因。另外,急性肝炎较少出现大量腹水,当重型肝炎出现腹水时肝脏体积多已缩小,而PA-HSOS多以腹水为突出表现。重型肝炎患者凝血功能严重障碍,而PA-HSOS患者凝血功能大多正常或轻度异常。肝组织病理检查和HVPG测定有重要鉴别诊断价值。
推荐意见:⑤超声仅作为初筛检查,腹部增强CT和(或)MRI检查的典型表现对PA-HSOS的诊断和鉴别诊断具有重要价值;证据等级为B级,推荐强度为1级。⑥对含PA植物服用史不明确的患者,血清PPAs浓度测定对临床怀疑PA-HSOS的患者具有溯源性诊断价值;证据等级为B级,推荐强度为1级。⑦PA-HSOS的诊断推荐"南京标准":有明确服用含PA植物史,且符合以下3项[腹胀和(或)肝区疼痛、肝大和腹水,血清TBil升高或其他肝功能异常,典型的增强CT或MRI表现],或通过病理确诊,同时排除其他已知病因所致肝损伤。通过病理确诊需要有典型病理表现:肝腺泡Ⅲ区肝窦内皮细胞肿胀、损伤、脱落,肝窦显著扩张、充血。证据等级为B级,推荐强度为1级。⑧对于实验室和影像学检查不典型的疑诊患者,建议行肝穿刺活检,存在大量腹水者,为降低操作相关风险,可采用TJLB,并可行HVPG测定评估门静脉压力;证据等级为B级,推荐强度为1级。⑨PA-HSOS需注意与BCS、失代偿期肝硬化、急性重型肝炎等疾病鉴别,证据等级为A级,推荐强度为1级。
所有疑诊患者均应停止服用含PA植物。对症支持治疗是PA-HSOS的基础治疗方案,包括保肝、利尿、改善微循环等,应尽早开始。腹水严重且药物治疗无效时可考虑腹腔置管引流,当液体潴留和严重肾功能下降时,需要进行血液透析或血液滤过。合并多脏器功能衰竭的患者应当入住监护病房。急性期/亚急性期患者在排除禁忌情况下,建议给予抗凝治疗。内科治疗效果不佳者,可行经颈静脉肝内门体静脉分流术(transjugular intrahepatic portosystemic stent-shunt,TIPS)控制顽固性腹水和门静脉高压[56]。对于合并肝功能衰竭内科治疗不佳的患者,可考虑行肝移植术。
对症支持治疗对于急性期/亚急性期患者尤为重要。保肝治疗可以改善肝脏淤血缺氧对肝细胞造成的损伤,为肝细胞的再生和肝功能的恢复提供有利的内环境。目前临床常用的保肝药物主要有多烯磷脂酰胆碱、异甘草酸镁、谷胱甘肽等药物,合并肝内胆汁淤积或高胆红素血症时,可以选择熊去氧胆酸和(或)S-腺苷蛋氨酸治疗。利尿治疗首选口服呋塞米和螺内酯联合应用。如利尿剂无效,可以在超声定位下进行腹腔穿刺,同时配合大量白蛋白输注。对于改善微循环的药物如前列腺素E1、活血化瘀类中药等在PA-HSOS治疗中的作用尚不确切[57,58]。综合国内各大型医院相关病例报道(以PA-HSOS为主)结果显示,仅给予以对症支持治疗为主的内科治疗,PA-HSOS的病死率为12.2%~78.6%[7,20,21,59]。由于各单位报道病例数量、病情轻重程度、病程时间、具体治疗方案均不同,故病死率差异较大,但大多数报道病死率在40%以上[60,61,62]。对症支持治疗虽然无法从根本上逆转PA-HSOS患者的病理、生理学改变,但是可能通过相关治疗减轻水钠潴留,修复受损的肝细胞,进而促进肝功能早日恢复。
糖皮质激素对PA-HSOS的疗效仍存在争议。国外在HSCT-HSOS中的相关糖皮质激素应用研究提示其可能有效。2013年,英国指南推荐大剂量糖皮质激素冲击可以用于HSCT-HSOS的治疗,但需关注感染的风险,且证据等级偏低[10]。糖皮质激素在PA-HSOS中应用的证据主要来自于国内几个单位的基础研究和小样本临床病例报道[7,20,21,63],疗效尚不能确定。
存在腹水、黄疸等表现的急性期/亚急性期患者是抗凝治疗的主要人群,并应尽早开始。禁忌证主要是合并严重出血疾病或出血倾向。抗凝药物首选低分子肝素,亦可联合或序贯口服维生素K拮抗剂(华法林)。低分子肝素安全性较普通肝素高,出血不良反应少,大多数患者使用时无需监测。建议剂量为100 IU/kg,每12 h 1次,皮下注射,肾功能不全者慎用。华法林是长期抗凝治疗的主要口服药物,疗效评估需监测凝血酶原INR。治疗剂量范围窄,个体差异大,药效易受多种食物和药物影响。抗凝强度:建议INR为2.0~3.0,这一强度可能既满足较佳的抗凝强度,也有较好的安全性。初始剂量:建议口服起始剂量为1.25~3.00 mg/d(即0.5~1.0片,国内主要规格为2.5 mg和3.0 mg),高龄、肝功能严重受损等患者初始剂量可适当降低。剂量调整:口服2~3 d后开始测定INR,并定期监测,剂量调整应谨慎,如连续两次测得INR不达标,再考虑调整剂量(一般为加或减1/4片),待剂量稳定后可每4周监测1次。抗凝治疗的主要不良反应是出血,包括轻微出血和严重出血。抗凝治疗2周后通过临床表现、肝功能、影像学检查结果评估效果,如治疗有效,继续抗凝至3个月以上;如治疗无效,停止抗凝,考虑其他治疗措施。其他抗凝药物缺乏经验。
国内部分单位在PA-HSOS的治疗中有使用肝素或低分子肝素抗凝的小样本报道,治愈和好转率达70.0%~88.9%[8,27,64,65]。王轶等[66]在一项单中心回顾性研究中总结了连续85例PA-HSOS患者不同治疗方案的中长期随访结果:22例未抗凝患者中,14例(63.6%)死亡;63例采用低分子肝素联合口服华法林抗凝治疗的患者中,6例(9.5%)死亡,36例(57.1%)治愈,21例因抗凝2周未见改善行TIPS治疗后20例症状明显改善。两组疗效差异有统计学意义。同时,所有采用抗凝治疗的患者均未发生因联合使用低分子肝素和华法林导致的并发症(如严重大出血)。基于以上结果,建议急性期/亚急性期的PA-HSOS患者应尽早给予抗凝治疗。
目前有几篇小样本研究报道了TIPS治疗急性期HSCT-HSOS的效果,疗效各异[67,68]。一篇包括10例重度HSCT-HSOS的病例报道显示,5例TIPS术后10 d内死亡,而另外5例显著好转[69]。2011年意大利推荐意见指出,行TIPS治疗的HSCT-HSOS患者存活率为20%,如果患者已经合并多脏器功能衰竭,则TIPS为时已晚[13]。这可能是由于大部分HSCT-HSOS患者合并有严重的血液系统疾病,基础情况差,影响TIPS治疗的效果。但是PA-HSOS患者一般不合并致命性基础疾病。王轶等[70]报道23例PA-HSOS患者,在对症支持或联合抗凝治疗无效后行TIPS治疗,1例死于手术并发症,大部分患者在术后1周左右腹水明显消退,随访期内22例均存活,仅2例(9.1%)术后发生肝性脑病,肝性脑病发生率显著低于因肝硬化行TIPS的患者。因此,TIPS能够明显改善内科治疗无效PA-HSOS患者的腹水和门静脉高压。但TIPS能否改善远期预后还需要更长时间的随访观察[12,56]。
肝移植是治疗多种终末期肝病的有效方法。目前有个别报道表明肝移植可以改善HSCT-HSOS患者预后,但限于器官供应短缺,尚无足够证据支持[12]。迄今国内尚无PA-HSOS患者行肝移植的研究文献报道。对于合并肝功能衰竭经内科治疗无效的患者,可考虑行肝移植。
去纤苷(defibrotide)是唯一被证明有效的预防和治疗HSCT-HSOS的药物[10],欧洲药品管理局在2014年批准去纤苷用于治疗重度HSCT-HSOS。但由于去纤苷在我国未上市,故对PA-HSOS的疗效尚不清楚。一些小样本研究或个案报道采用诸如抗凝血酶原Ⅲ、重组人血栓调节蛋白、N-乙酰半胱氨酸、重组人组织型纤溶酶原激活因子(tissue type plasminogen activator)等治疗HSCT-HSOS,但疗效尚不确定[71,72,73,74],且国内对PA-HSOS缺乏经验,仍需要进一步研究。
推荐意见:⑩对症支持是PA-HSOS的基础治疗;证据等级为B级,推荐强度为1级。○11急性期/亚急性期PA-HSOS患者排除禁忌证后应尽早给予抗凝治疗,可选择单用低分子肝素或酌情联用华法林,亦可序贯口服华法林;证据等级为B级,推荐强度为1级。○12糖皮质激素、前列腺素E1等治疗PA-HSOS的疗效尚不确定,证据等级为D级,推荐强度为1级。○13对于内科治疗效果不佳者,在充分评估获益和风险后,可考虑行TIPS控制顽固性腹水和门静脉高压;证据等级为B级,推荐强度为1级。○14对于合并肝功能衰竭内科治疗无效的患者,可考虑行肝移植术;证据等级为C级,推荐强度为1级。
对于PA-HSOS,首先要加强宣传,引导人们在医师或药师指导下正规使用含PA植物,切勿私自口服。同时,应该通过基层社会管理的力量教育群众认识含PA植物的巨大危害,甄别参三七和土三七。PA-HSOS的发病机制、病情评估和治疗措施等方面还有许多不清楚的地方,有待进一步研究。
推荐意见:○15加强宣传教育,引导人们在医师或药师指导下正规使用含PA植物;证据等级为A级,推荐强度为1级。
参加本共识撰写和讨论的专家人员名单(按姓氏汉语拼音为序):白文元,陈东风,陈骏,陈立刚,高艳景,韩浩,何健,胡锡琪,姜海行,李良平,刘杰,刘玉兰,陆伦根,马雄,宓余强,聂勇战,沈薇,沈锡中,田德安,王红玲,王吉耀,王江滨,王轶,谢渭芬,徐有青,徐肇敏,许国强,许建明,杨建,杨丽,杨玲,杨云生,张峰,张明,张玮,周新民,诸葛宇征,朱斌,朱萱,邹晓平


























