
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2007年,《中华消化杂志》组织国内消化科、外科、放射科和核医学科等学科的部分专家,针对不明原因消化道出血(obscure gastrointestinal bleeding,OGIB)制定了《不明原因消化道出血诊治推荐流程(2007年3月,南京)》[1],推动了国内对OGIB的研究并提高了其诊疗水平。当时OGIB定义为:常规消化内镜检查(包括检查食管至十二指肠降段的上消化道内镜与肛门直肠至回盲瓣的结肠镜检查)和常规X线钡剂检查不能明确病因的持续或反复发作的消化道出血。2012年,《中华消化杂志》再次组织专家对推荐流程进行了修订,在OGIB的定义中增加了小肠CT这一检查手段[2]。2015年,国内《急性非静脉曲张性上消化道出血诊治指南(2015年,南昌)》中OGIB仍定义为"经常规内镜(包括胃镜与结肠镜)检查不能明确病因的持续或反复发作的消化道出血"[3]。
近年来,胶囊内镜、小肠镜和放射影像学等小肠检查技术在国内已逐渐普及,多数OGIB得以明确诊断,主要为小肠出血(small bowel bleeding)。目前,继续沿用此定义已不适用于临床,因此国内有学者对此提出商榷,并建议在OGIB定义中增加胶囊内镜、小肠镜和影像学等检查手段[4]。目前认为,OGIB应定义为:经常规消化内镜(包括上消化道内镜和结肠镜)、胶囊内镜、小肠镜和影像学检查后仍未明确病因的持续或反复发作的消化道出血(含消化道所有部位)。2015年,美国胃肠病学院提出以更为明确的"小肠出血"替代传统定义的OGIB[5],因此有必要对2012年制定的推荐流程进行及时更新,使其能与时俱进。
制订本共识的方法如下:
1."陈述(statements)"的构建:通过系统文献检索,结合小肠出血诊治过程中的关键或热点问题,构建了相关"陈述"。"陈述"起草过程中参考了PICO(population, intervention, comparison, outcome)原则[6],并借鉴了国际相关指南[5]。
2.证据质量(quality of evidence)和推荐强度(strength of recommendation)的评估:采用GRADE(grading of recommendations assessment, development and evaluation)系统评估证据质量和推荐强度[7]。证据质量分为高质量、中等质量、低质量和很低质量4级,推荐强度分为强推荐(获益显著大于风险,或反之)和条件推荐(获益大于风险,或反之) 2级。证据质量仅是决定推荐强度的因素之一,低质量证据亦有可能获得强推荐。
小肠解剖上包括十二指肠、空肠和回肠。因十二指肠出血通常可通过上消化道内镜诊断,故狭义的小肠出血是指Triez韧带以下的空肠和回肠出血。小肠出血可以分为:显性小肠出血,表现为呕血、黑便或血便等肉眼可见的出血;隐性小肠出血,表现为反复发作的缺铁性贫血和粪便隐血试验阳性。小肠出血占消化道出血的5%~10%,其常见病因见表1。

小肠出血的常见病因
小肠出血的常见病因
| 年龄(岁) | 常见病因 |
|---|---|
| ≤40 | 克罗恩病、肿瘤、麦克尔憩室、Dieulafoy溃疡、血管扩张性病变、息肉综合征 |
| >40 | 血管扩张性病变、Dieulafoy溃疡、肿瘤、非甾体抗炎药相关性溃疡、克罗恩病、小肠憩室、缺血性肠病、寄生虫病 |
对于怀疑小肠出血的患者,首先应仔细询问其病史(包括目前症状、既往史、用药史、家族史等)。详细可靠的病史和体格检查是小肠出血诊断的基础。
常规内镜包括上消化道内镜和结肠镜,为小肠出血的初步检查。初次检查时,可能因病灶微小、位置隐蔽或检查者经验不足等造成漏诊,易被漏诊的病变有毛细血管扩张等微血管病变、息肉、Cameron糜烂和位于视野盲区的病变等。初次检查阴性的患者必要时可重复进行内镜检查,有助于减少漏诊,提高诊断率。
目前,胶囊内镜检查已成为小肠疾病的一线检查技术和小肠出血的主要诊断方法之一[8]。胶囊内镜对可疑小肠出血的诊断率为38%~83%[9],胶囊内镜检查阴性者再出血率为6%~27%[10,11],重复检查能提高诊断率。诊断率和出血状况密切相关,显性出血和持续性出血的诊断率显著高于隐性出血和间歇性出血。急诊胶囊内镜检查常因视野不佳而不能明确病因。择期胶囊内镜的最佳检查时机为出血停止后2周内。择期行胶囊内镜检查需行肠道准备,聚乙二醇(polyethylene glycol)电解质散可作为胶囊内镜检查的常规肠道准备导泻药,聚乙二醇联合二甲基硅油可提高小肠图像质量,但是促胃肠动力药物不能提高图像质量和全小肠检查的成功率[8]。推荐用法:检查前禁食12 h,检查当日提前4 h服用聚乙二醇溶液1 L,另于吞服胶囊内镜前30 min服用西甲硅油乳剂8 mL(含西甲硅油32 mg,使用250 mL清水混合搅匀)。
胶囊内镜的优点为非侵入性,不足之处有以下几点:①不能进行常规内镜检查时的充气、冲洗、局部反复观察、活组织检查,以及治疗等操作;②肠内容物残留和动力障碍可影响其对消化道的全面观察;③在出血量较多或有血凝块时视野不清,易遗漏病灶,无法做出病因诊断,而肠道狭窄时有发生滞留的危险;④不能控制胶囊内镜的移动速度;⑤胶囊内镜靠自身电池供电,部分病例的胶囊尚未通过回盲部,电池电量就已耗尽。
小肠镜是目前小肠疾病的主要检查手段。探条式小肠镜已不再应用,推进式小肠镜也已较少应用。目前,应用最广泛的是各种器械辅助式小肠镜。
推进式小肠镜是较为传统的小肠检查技术,插入深度在幽门下90~150 cm,但患者依从性较差,操作技术要求较高,仅适用于近端小肠病灶的检查和治疗,目前已基本被气囊辅助式小肠镜替代。
DBE经口检查可至幽门下240~360 cm,经肛门检查可至回盲瓣上102~140 cm,远优于推进式小肠镜和结肠镜。通过经口和经肛门进镜的联合应用,可完成全小肠无盲区检查。DBE检查对可疑小肠出血和其他小肠疾病的诊断率为60%~80%[5],并且对显性小肠出血的诊断阳性率高于隐性出血[5]。DBE的优点是可在直视下行小肠活组织检查,除诊断外还可开展内镜下治疗。不足之处在于该检查为侵入性检查,操作技术要求较高。DBE并发症的发生率为0.8%~1.2%[12,13],严重并发症主要为急性胰腺炎和肠穿孔。急性胰腺炎主要见于经口检查,而肠穿孔则多见于有腹部手术史和息肉切除患者。腹胀和腹痛曾是气囊辅助式小肠镜检查术后的常见症状,但应用二氧化碳充气后可减轻症状,增加内镜插入深度,提高对接率[14]。如行内镜下治疗,并发症发生率约为4%[12]。
DBE与胶囊内镜比较,总体诊断率相似[15],尤其对血管性和炎性病变的诊断一致性较高,但在息肉和肿瘤性病变诊断中存在差异。研究报道,在胶囊内镜检查仅发现小肠积血而未发现病灶的患者中,64.6%可经DBE检出病灶[16]。
CT/MRI小肠影像学检查作为非侵入性检查,易被患者接受。可以在相对短的时间内完成对整个小肠疾病的评价,观察到腹部实质脏器及肠腔内外情况,并可显示病变及毗邻血管、淋巴结之间的关系,有利于术前评估。作为小肠出血影像学的初步筛查,应首选小肠计算机断层扫描造影(computed tomography enterography, CTE)。MRI检查虽无X射线且对软组织分辨率高,但相对费时,空间分辨率也不如CT检查。
通过口服造影剂充盈小肠肠腔后行CT平扫及多期增强扫描,图像经处理后可显示小肠肠腔、肠壁、系膜、血管、后腹膜和腹腔内实质脏器,是一项很好的小肠检查方法,目前已在国内广泛开展。一项meta分析显示,CTE对疑似小肠出血患者的诊断率为40%,但对于浅表溃疡、糜烂和毛细血管病变的诊断率不高[23]。CTE与胶囊内镜检查互补性较高,一种检查阴性后再行另一种检查常有阳性发现。
CTA对急性小肠出血的诊断价值较高,适用于活动性出血(出血速率≥0.3 mL/min)患者。一项meta分析显示,CTA的灵敏度和特异度分别为89%和85%[24]。对于血流动力学稳定的急性小肠大出血患者,可先行CTA检查,如有阳性发现可再行血管造影下栓塞治疗。
在行小肠CTE检查时,可对动脉、静脉血管进行三维重建,所以小肠CTE可同时完成CTA和计算机断层扫描静脉成像(computed tomography venography,CTV)检查,不需要另外再行腹部CTA或CTV检查。这种一次检查就完成腹、盆腔脏器和血管的多期扫描,称之为"一站式检查",对小肠疾病的诊断非常实用和有效,但不适用于急性大出血患者。
目前,小肠MRE检查应用于小肠出血诊断的相关研究较少,其诊断价值尚不明确。MRE能显示的肠管异常主要为肠壁增厚及强化、肠腔狭窄、肠管扩张等,对小肠CD,特别是早期的CD,其诊断价值较高[25],而对浅表溃疡、糜烂和毛细血管病变的诊断价值有限。儿童如高度怀疑小肠CD,推荐首选小肠MRE检查。此外,在无法选用CTE检查的情况下可选用MRE。
与CTA不同,血管造影是一项有创性检查,适用于活动性出血(出血速率≥0.5 mL/min)患者,对小肠出血的诊断率约为50%[26]。对于血流动力学不稳定的急性小肠大出血患者,可首选血管造影。血管造影的优点在于能直接进行血管栓塞治疗,止血率较高。缺点为其属有创性检查及存在辐射暴露,同时有发生肾功能衰竭、缺血性肠炎等并发症的风险。血管造影对肿瘤和血管发育不良造成的出血性病变诊断价值较大,其直接出血征象为造影剂外溢。小肠肿瘤的影像学特征为血管团伴有血管移位、包绕、痉挛和狭窄;肠道血管扩张性病变造影的特征为有血管团、肠壁静脉扩张、迂曲,以及末梢血管杵状扩张。
核素扫描仅对活动性出血(出血速率≥0.1~0.5 mL/min)有诊断价值,诊断率约为50%,尤其适用于间歇性和延迟性小肠出血[27],不适用于大出血患者。使用99Tcm-Pertechnitate标记壁细胞是检查憩室出血的一种方法,又称为麦克尔扫描[28]。怀疑憩室出血患者和疑似小肠出血的患儿可考虑应用核素扫描。
小肠钡剂检查包括全小肠钡剂造影和小肠钡剂灌肠。全小肠钡剂造影对小肠出血的诊断率不高,并且假阴性率较高。小肠钡剂灌肠对小肠出血的诊断率为10%~21%[29],优于全小肠钡剂造影。随着小肠CTE、胶囊内镜和小肠镜的广泛应用,小肠钡剂检查在小肠疾病诊断中的地位正在逐步降低,但对小肠憩室和粘连性病变的诊断仍有一定价值。
如以上多种检查手段仍未能明确病因,且反复出血严重影响患者生命质量或生命时,建议行手术探查和术中内镜检查。术中内镜检查对可疑小肠出血的诊断率为58%~88%,主要并发症包括浆膜撕裂、肠系膜血管撕脱和延迟性肠梗阻[30]。
各种小肠出血检查手段比较见表2。
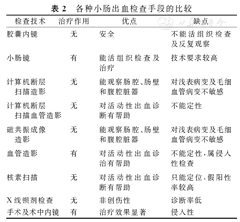
各种小肠出血检查手段的比较
各种小肠出血检查手段的比较
| 检查技术 | 治疗作用 | 优点 | 缺点 |
|---|---|---|---|
| 胶囊内镜 | 无 | 安全 | 不能活组织检查及反复观察 |
| 小肠镜 | 有 | 能活组织检查及治疗 | 技术要求较高 |
| 计算机断层扫描造影 | 无 | 能观察肠腔、肠壁和腹腔脏器 | 对浅表病变及毛细血管病变不敏感 |
| 计算机断层扫描血管造影 | 无 | 对活动性出血诊断有帮助 | 不能定性 |
| 磁共振成像造影 | 无 | 能观察肠腔、肠壁和腹腔脏器 | 对浅表病变及毛细血管病变不敏感 |
| 血管造影 | 有 | 对活动性出血诊治有帮助 | 不能定性,属侵入性检查 |
| 核素扫描 | 无 | 对活动性出血诊断有帮助 | 只能定位,假阳性率较高 |
| X线钡剂检查 | 无 | 非创伤性 | 诊断率低 |
| 手术及术中内镜 | 有 | 治疗效果显著 | 侵入性 |
2007年,国内专家根据国情对美国胃肠病学会提出的OGIB诊断和处理流程进行了修改,首次制定了我国的OGIB诊断和处理推荐流程[1]。2012年的更新版推荐流程中将小肠CTE、胶囊内镜、小肠镜等共同列为小肠的主要检查技术[2]。近年来,研究证据更为充分,现对诊治流程进行优化,见图1。
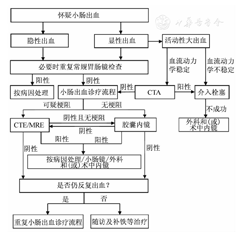

注:CTE为计算机断层扫描造影;MRE为磁共振成像造影;CTA为计算机断层扫描血管造影
对于小肠出血患者的治疗,尤其是对急性大出血患者,应先复苏再明确诊断。首先要根据患者的临床状态、循环容量缺失程度、出血速度、年龄和并发症情况,给予适当的补液及输血治疗,以维持生命体征,并创造条件进行病因诊断。大多数慢性或间歇性出血患者都会存在不同程度的缺铁性贫血,因此建议给予补铁治疗以纠正贫血。
小肠镜的出现使小肠出血的治疗变得更为准确、有效,因为可在内镜直视下进行止血治疗。治疗方法可结合当地医疗条件和医师对技术的熟悉程度,选择烧灼、钛夹或局部注射、喷洒止血剂等治疗手段,异位静脉曲张和蓝色橡皮大疱痣综合征可采用硬化剂注射。在内镜止血治疗后,小肠出血会有一定的再发率,尤其是血管扩张性病变的发生率更高。一项meta分析报道,小肠血管扩张性病变在内镜下止血后,平均随访22个月的再出血率为45%[31]。小肠血管扩张性病变再出血的风险因素包括病变数量、年龄>65岁、病变位于空肠、合并心血管疾病、合并慢性肾脏病、应用抗凝药和输血等。
主要用于小肠急性大出血,方法主要包括选择性动脉内加压素治疗、超选择性微线圈栓塞或合用明胶海绵或聚乙烯醇栓塞等。该治疗方式快速、有效,但有可能发生小肠坏死,须密切监测。有关血管造影下栓塞治疗小肠出血的报道较少,一项纳入15项研究共309例下消化道出血患者的综述报道,血管造影下栓塞治疗的成功率为82%,但其中多数病例并非小肠出血[32]。
出血病变部位不明或病变弥漫,不适用内镜治疗、手术治疗或血管造影栓塞治疗和治疗无效者,可考虑采用药物治疗。针对小肠出血的药物治疗研究有限,性激素类药物已被证实无效,生长抑素及其类似物和沙利度胺(thalidomide)有一定疗效。
生长抑素及其类似物在急性消化道出血治疗中的短期应用较为广泛,长期应用对胃肠道毛细血管扩张和蓝色橡皮大疱痣综合征引起的慢性肠道出血有一定的治疗作用,其机制可能与抑制血管生成和内脏血流有关。推荐用法:先用奥曲肽100 μg皮下注射,3次/d,共4周,第2周起采用长效奥曲肽20 mg每月肌内注射1次,疗程6个月;或兰瑞肽(lanreotide,一种长效生长抑素八肽类似物)90 mg每月肌内注射1次[33]。一项回顾性分析显示,长效奥曲肽对胃肠道血管扩张性病变导致的出血有一定治疗作用,其中40%完全应答,32%部分应答;年龄>65岁、男性、应用抗血小板药物、慢性阻塞性肺疾病、慢性肾功能衰竭可能是不应答的独立相关因素[34]。最近一项meta分析综合了4项生长抑素治疗胃肠道血管扩张性病变的回顾性研究,结果也显示奥曲肽有效[31]。
随着内镜技术的不断发展,手术治疗小肠出血已不再是一线治疗手段。但对于小肠肿瘤、经保守治疗无效的大出血、小肠穿孔、小肠梗阻和不明原因的反复出血等仍是手术治疗的指征。手术探查的困难在于难以发现小肠腔内微小的病灶,尤其是血管扩张性病变,因而可能发生术后再出血。术中内镜检查有助于明确病因,提高小肠出血的疗效。
1.对于反复出血或既往检查不完善的患者,可考虑重复进行常规内镜检查(推荐级别强,证据水平为低质量)。
2.如果两次常规内镜检查均未明确出血原因,下一步应该检查小肠(推荐级别强,证据水平为中等质量)。
3.胶囊内镜是常规内镜检查阴性、怀疑小肠血管性疾病或黏膜疾病出血患者的首选检查方法(推荐级别强,证据水平为中等质量)。
4.小肠CT造影是常规内镜检查阴性、怀疑梗阻、怀疑小肠肿瘤或其他疾病出血、或胶囊内镜检查阴性患者的首选影像学检查方法(推荐级别强,证据水平为很低质量)。
5.优先行小肠镜检查一般用于有胶囊内镜检查禁忌证、出血量较大或考虑行内镜下治疗的患者(推荐级别强,证据水平为高质量)。
6.对于以上多种检查手段未能明确病因或无法行小肠镜检查,并且反复出血严重影响生命质量或生命的患者,推荐手术探查和术中进行内镜检查(推荐级别强,证据水平为低质量)。
7.对于经胶囊内镜或小肠镜检查发现活动性出血灶,并且同时存在进行性贫血加重或活动性出血的患者,如有条件,应采取内镜下止血治疗(推荐级别强,证据水平为很低质量)。
8.内镜下治疗措施应根据当地医疗条件、患者病因和治疗应答情况综合决定(推荐级别为有条件推荐,证据水平为中等质量)。
9.如果存在持续性或复发性出血,或无法定位出血灶,则推荐补铁治疗、生长抑素或抗血管生成药物(沙利度胺)治疗(推荐级别强,证据水平为中等质量)。
10.对于血流动力学不稳定的急性大出血患者,可首选血管造影,并可立即行栓塞治疗(推荐级别强,证据水平为低质量)。
执笔者:谢渭芬,施健
参与讨论和修改(按姓氏汉语拼音排序):陈卫昌,陈宗祐,房静远,戈之铮,郭晓钟,韩英,季峰,李建生,李景南,陆伟,吕宾,缪飞,钱家鸣,沈锡中,施健,施瑞华,田德安,庹必光,汪芳裕,王坚,谢渭芬,杨云生,杨长青,游苏宁,袁耀宗,钟良,邹多武

























