版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胰腺外分泌功能不全(pancreatic exocrine insufficiency, PEI)是指由于各种原因引起的胰酶分泌不足或胰酶分泌不同步,从而导致患者出现营养消化吸收不良等症状[1]。中国医师协会胰腺病专业委员会慢性胰腺炎专委会牵头内科、外科、病理科、影像科等多学科专家,参照最新循证医学证据和多部国际权威指南,对2012年版《中国胰腺外分泌功能不全诊治规范(草案)》进行了修订,供临床诊疗参考。
PEI主要有3个方面的原因:①胰腺实质功能衰退或损伤,胰酶合成能力下降;②胰管阻塞,胰液流出受阻;③分泌反馈失衡,对胰酶生成的刺激减弱。由①和②导致的为原发性PEI,由③导致的为继发性PEI。
PEI的病因主要包括慢性胰腺炎(chronic pancreatitis,CP)、急性胰腺炎(acute pancreatitis,AP)、胃切除术后、肠切除术后、胰腺切除术后、囊性纤维化、胰腺癌、乳糜泻和糖尿病等,见表1。

胰腺外分泌功能不全的发病机制和病因
胰腺外分泌功能不全的发病机制和病因
| 发病机制 | 病因 |
|---|---|
| 胰腺实质功能衰退 | 慢性胰腺炎 |
| 急性胰腺炎 | |
| 囊性纤维化 | |
| 胰腺肿瘤 | |
| 胰腺切除术后 | |
| 胰管梗阻 | 胰腺肿瘤 |
| 胰腺外伤 | |
| 分泌反馈失衡 | 克罗恩病 |
| 糖尿病 | |
| 胃切除术后 | |
| 肠切除术后 | |
| 佐林格-埃利森综合征 | |
| 乳糜泻 | |
| 肠易激综合征 | |
| 艾滋病 |
CP病理变化为进行性、不可逆的胰腺腺泡萎缩、破坏、纤维化,进而引发PEI,但常至疾病晚期PEI才表现出明显的临床症状。CP确诊时PEI发病率为36%,5年后约为60%,晚期CP的PEI发生率可达100%[2,3]。
AP恢复期,胰腺外分泌功能处于低下水平,部分可出现PEI,常见于酒精性AP、重症急性胰腺炎(severe acute pancreatitis,SAP)和AP伴假性囊肿患者[4,5]。约1/3的SAP患者可出现PEI,发生率高于轻症AP[6]。随着病情的缓解,AP患者的胰腺外分泌功能可逐渐恢复[7]。
胃切除术引起的体内神经-内分泌紊乱可导致继发性PEI[8]。胃切除患者体内碳酸氢盐和脂肪酶分泌水平显著降低。胃部分切除患者PEI的发生率约为70%,全胃切除患者PEI发生率高达100%[9]。
胰头肿瘤可因肿瘤直接侵犯胰腺和(或)阻塞胰管,进而导致PEI的发生。胰头肿瘤诊断时PEI的发生率为66%,诊断2个月后PEI发生率超过90%[10]。
胰腺术后患者由于胰腺原发病、胰腺组织切除、胃肠解剖位置变化、餐后刺激减少、胃排空与胰腺分泌不协调等原因,使得胰酶分泌水平不足以维持正常消化功能。胰十二指肠切除术后PEI发生率高,可在60%以上,而中段或远端胰腺切除术后PEI发生率相对较低[11,12]。
囊性纤维化为常染色体显性遗传病,白种人发病率较高,我国极少见。囊性纤维化患者胰腺的主要病理变化为胰管阻塞和腺泡分化差,形成微囊,造成永久性胰腺外分泌组织功能损坏。新生儿囊性纤维化患者PEI的发生率可达85%[13]。
胰腺外分泌和内分泌功能在解剖上和生理上有相关性,两者相互影响。糖尿病患者存在胰腺形态、组织学和功能改变。PEI在1型糖尿病患者中的发生率约为40%,在2型糖尿病患者中的发病率约为27%[14]。
其他疾病如肠道切除术后、佐林格-埃利森综合征、IBS、艾滋病等也存在不同程度的PEI。
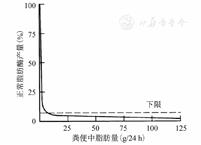
PEI的临床症状主要包括腹痛、腹胀、体质量减轻、脂肪泻、营养不良等。PEI患者脂肪、碳水化合物、蛋白质的消化均受到影响,其中脂肪消化吸收不良较蛋白质或糖类出现得早且较明显。脂肪泻因粪便中脂肪含量高,特征性地出现粪便呈泡沫状,有恶臭味,且浮于水面,常于高脂饮食后出现。因胰腺具有极强的储备能力和代偿机制,早期PEI可无任何临床症状,当分泌的脂肪酶降至正常水平的10%以下时,患者才出现脂肪泻[15],见图1。CP确诊时脂肪泻的发生率为14%,男性、酗酒、胰十二指肠切除术后与合并糖尿病的CP患者更易出现脂肪泻[16]。PEI患者可出现营养状况不良,体内必需氨基酸、脂肪酸、微量元素和脂溶性维生素、高密度脂蛋白C、载脂蛋白A-Ⅰ和脂蛋白A等水平降低,以及由此导致的骨质疏松、免疫力下降、心血管事件风险增高等,严重影响患者生命质量[17,18,19]。
胰腺外分泌功能试验分为直接试验和间接试验。直接试验是检测胰腺外分泌功能的金标准,其灵敏度和特异度均超过90%[21]。此方法用胰泌素直接刺激胰腺分泌后,通过经内镜逆行性胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP)胰管插管或十二指肠插管,收集胰液,了解其外分泌状态,但因成本高昂,属侵入性检查,临床开展受限[22]。
间接试验包括粪便脂肪检测、粪便弹性蛋白酶-1(faecal elastase-1, FE-1)测定、13C-混合三酰甘油呼气试验(13C-labeled mixed triglyceride breath test,13C-MTG-BT)、尿苯甲酰酪氨酰对氨基苯甲酸(N-benzoyl-L-tyrosyl-p-aminobenzoic acid,BT-PABA)试验等[23]。间接试验成本相对低廉,易于操作,但灵敏度和特异度相对不足。目前最常用的是FE-1测定,其含量<200 μg/g时提示存在PEI[24]。弹性蛋白酶-1由胰腺分泌,在肠道中不被分解,完全经粪便排出,检验结果不受外源性胰酶制剂干扰[25]。FE-1测定操作较为方便,适用于PEI的筛查和确诊患者的长期随访。72 h粪便脂肪收集试验是诊断脂肪泻的金标准,粪便脂肪含量>7 g/d即可确诊[26,27],但因受试者较差的依从性和检测的复杂性,其应用受限。胰泌素刺激磁共振胰胆管成像(secretin-stimulated magnetic resonance cholangio-pancreatography,s-MRCP)可根据十二指肠充盈程度对胰腺外分泌功能进行半定量分级评估[28,29]。
此外,脂溶性维生素、血清白蛋白、前白蛋白、镁、视黄醇结合蛋白、脂蛋白等实验室检查指标均有助于反映患者的营养吸收情况,可间接提示PEI的存在[30,31]。
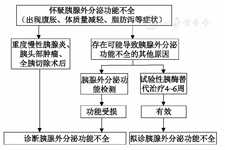
胰腺外分泌功能检测可协助诊断PEI[32,33],但由于我国开展相关检测的单位较少,一般通过患者临床症状、基础疾病、营养状况等综合评估判断。对于怀疑PEI的患者,亦可采用试验性胰酶替代治疗(pancreatic enzyme replacement therapy, PERT)4~6周,如症状改善,可拟诊PEI[1,33,34]。见图2。
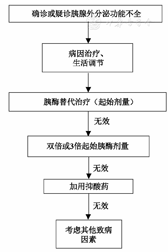
PEI治疗目的在于改善患者消化道症状,预防并消除PEI导致的营养不良及其对健康的长期影响。治疗上以早期、及时、长期治疗为原则,主要治疗方法包括祛除病因、生活饮食调节、PERT和辅助用药等。
主要包括针对CP的内镜微创治疗、体外震波碎石和外科手术,针对AP的药物和外科治疗,针对胰腺肿瘤的外科手术治疗。继发性PEI应注重原发病的治疗。原发病经过有效治疗后可部分改善胰腺外分泌功能。
胰腺炎患者应戒烟、忌酒、少食多餐[35],每天至少进食一餐正常脂肪饮食,在饮食期间同步服用胰酶制剂。患者应每年监测1次维生素水平,按需补充。对于合并骨质减少或骨质疏松的患者应适当补充钙剂及维生素D。
无论何种原因导致的PEI,PERT均是首选治疗方法。PERT的作用是通过在进食时补充胰酶,以帮助营养物质的消化,有利于改善消化道症状,提高生命质量,纠正营养不良[36,37,38,39]。
临床确诊或疑诊PEI,即可行PERT[1]。可根据患者基础疾病、PEI临床症状、胰腺外分泌功能检测、营养不良的客观证据等进行综合评估。
我国目前使用的胰酶制剂有胰酶肠溶胶囊(商品名为得每通)、米曲菌胰酶片(商品名为慷彼申)等。临床常用的得每通所含胰酶含量最高,其pH敏感肠溶包衣可使胰酶在十二指肠处快速释放,超微微粒剂型有利于胰酶与食糜充分混合,促进营养物质吸收。慷彼申除含有高活性胰酶外,还含有米曲菌酶,在胃肠道均发挥作用。
推荐PEI患者餐中服用胰酶制剂,效果优于餐前或餐后服用[40]。胰酶制剂用量主要取决于其所含的脂肪酶量,成人推荐初始剂量为25 000~40 000 IU脂肪酶/餐(40 000 IU/正餐,20 000 IU/小食),如疗效不佳,可依个体增加剂量,最大剂量可用至75 000~80 000 IU脂肪酶/餐。儿童可给予500~4 000 IU脂肪酶/g膳食脂肪。婴幼儿推荐500~1 000 IU脂肪酶/g膳食脂肪。婴幼儿也可予2 000~4 000 IU脂肪酶/母乳喂养或120 mL婴幼儿配方奶粉。婴幼儿和儿童的推荐最大剂量为10 000 IU脂肪酶·kg-1·d-1。
评估指标主要为消化不良症状(脂肪泻、体质量减轻、腹胀)和营养状况的改善[33]。胰腺外分泌功能检测亦可协助评估疗效,如13C-MTG-BT检查有助于评价PERT的治疗效果[41]。FE-1检查只能测定自身胰酶分泌情况,因此不用于评估疗效。
PERT的不良反应少见且多数较轻,主要包括恶心、呕吐、胃肠胀气、痛性痉挛、便秘和腹泻等。其他罕见并发症有纤维化结直肠病和过敏反应。
参加本指南修订的专家(按姓氏笔划排序):王伟(上海交通大学医学院附属瑞金医院普外科),王华(安徽医科大学肝病研究所),王铮(西安交通大学第一附属医院肝胆外科),王琳(空军军医大学西京医院普外科),王鹏(复旦大学附属肿瘤医院中西医介入科),王立生(深圳市人民医院消化内科),王宏光(吉林市人民医院消化内科),王单松(复旦大学附属中山医院胰腺外科),王春友(华中科技大学附属协和医院胰腺外科),王修齐(河南省人民医院消化内科),车在前(上海交通大学医学院附属瑞金医院急诊科),白辰光(海军军医大学长海医院病理科),白雪莉(浙江大学附属第二医院胰腺外科),冯缨(中华消化杂志编辑部),吕芳萍(中华胰腺病杂志编辑部),朱克祥(兰州大学第一医院普通外科),任旭(黑龙江省医院消化内科),任延刚(中国实用内科杂志编辑部),刘丕(南昌大学第一附属医院消化内科),刘一品(滨州医学院烟台附属医院消化内科),刘立新(山西医科大学第一医院消化内科),刘改芳(河北省人民医院消化科),刘杰民(贵州省人民医院内镜科),许威(武警后勤学院附属医院消化内科),许晓勇(安徽医科大学第一附属医院消化内科),孙昊(西安交通大学第一附属医院肝胆外科),孙志广(江苏省第二中医医院消化内科),杜奕奇(海军军医大学长海医院消化内科),李刚(海军军医大学长海医院肝胆胰外科),李强(黑龙江省医院消化内科),李鹏(首都医科大学附属友谊医院消化内镜科),李静(四川大学华西医院消化内科),李延青(山东大学齐鲁医院消化内科),李兆申(海军军医大学长海医院消化内科),李启勇[树兰(杭州)医院肝胆外科],李明阳(解放军总医院消化内科),李晓斌(北京协和医院普通外科),李惠萍(温州医科大学附属第一医院急诊科),杨红(北京协和医院消化内科),杨云生(解放军总医院消化内科),杨妙芳(南京军区总医院消化内科),杨建锋(杭州市第一人民医院消化内科),杨智清(陆军军医大学西南医院肝胆外科),肖斌(南京医科大学第一附属医院胆胰中心),吴浩(海军军医大学长海医院消化内科),吴晰(北京协和医院消化内科),吴国生(空军军医大学西京医院移植外科),邹文斌(海军军医大学长海医院消化内科),辛磊(海军军医大学长海医院消化内科),沈岩(浙江大学附属第一医院胰腺外科),张红(陕西中医药大学基础医学院),张波(复旦大学附属肿瘤医院胰腺外科),张蕾(上海市第一人民医院影像科),张明刚(中日友好医院消化内科),张荣春(空军军医大学西京医院消化内科),陆岽(福建医科大学附属第一医院消化内科),陆逢春(福建医科大学附属协和医院胰腺外科),阿依努尔·阿合曼(新疆维吾尔自治区人民医院消化内科),陈丹磊(海军军医大学长征医院胰腺外科),陈汝福(中山大学孙逸仙纪念医院胰腺外科),陈国栋(北京大学人民医院消化内科),邵卓(海军军医大学长海医院胰腺外科),邵成伟(海军军医大学长海医院影像科),邵晓冬(沈阳军区总医院消化内科),林青(中山大学孙逸仙纪念医院胰腺外科),旺加(西藏自治区人民医院消化内科),金钢(海军军医大学长海医院胰腺外科),周小江(南昌大学第一附属医院消化内科),周思思(青海省人民医院消化内科),郎韧(首都医科大学朝阳医院胰腺外科),赵义军(安徽医科大学第一附属医院胰腺外科),胡良皞(海军军医大学长海医院消化内科),贺奇彬(南京鼓楼医院消化内科),袁方(北京怡德医院肾脏病科),贾玉良(皖南医学院弋矶山医院消化内科),党彤(包头医学院第二附属医院消化内科),殷涛(华中科技大学附属协和医院胰腺外科),郭旭(解放军总医院消化内科),郭涛(北京协和医院消化内科),唐才喜(中南大学湘雅医学院株洲医院肝胆外科),黄力(中山大学附属第一医院胆胰外科),黄李雅(宁夏医科大学总院消化内科),曹亚南(上海交通大学医学院附属瑞金医院内分泌科),常晓燕(北京协和医院病理科),韩钧凌(解放军187医院消化内科),覃山羽(广西医科大学第一附属医院消化内科),程礼(上海市第一人民医院消化内科),雷宇峰(山西省煤炭中心医院消化内科),蔡建庭(浙江大学医学院附属第二医院消化内科),蔡振寨(温州医科大学附属第二医院消化内科),廖专(海军军医大学长海医院消化内科),谭向龙(解放军总医院肝胆外二科),颜廷梅(中国实用内科杂志编辑部)
主要起草者:吴浩(海军军医大学长海医院消化内科),邹文斌(海军军医大学长海医院消化内科),李晓斌(北京协和医院普通外科),刘改芳(河北省人民医院消化科)